甘蔗胚性愈伤高效诱导系列研究II.基础培养基对甘蔗胚性愈伤发生的影响
李纯佳,徐超华,陆鑫,覃伟,刘家勇
(云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,开远661699)
甘蔗胚性愈伤高效诱导系列研究II.基础培养基对甘蔗胚性愈伤发生的影响
李纯佳,徐超华,陆鑫,覃伟,刘家勇*
(云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,开远661699)
在前期工作基础上,以甘蔗栽培品种ROC22、桂11、云蔗06-407为材料,研究了不同类型培养基、氮素铵硝比和碳源对甘蔗胚性愈伤诱导的影响。结果显示,不同类型培养基对甘蔗胚性愈伤诱导差异显著,MK培养基为最佳基础培养基,而氮素铵硝比和碳源作用不明显。研究结果从基础培养基角度优化了甘蔗胚性愈伤直接诱导体系。同时,由于MK为原创培养基,本研究可丰富植物组织培养的基础培养基选择。
甘蔗;胚性愈伤;基础培养基;氮素铵硝比;碳源
甘蔗(Saccharum officinarum L.)是我国和世界最重要的糖料作物。蔗糖约占世界食糖总产量的70%~80%,而在我国达90%以上[1]。优良甘蔗新品种的选育对于我国食糖产业的安全和发展具有重要意义[2]。作为有别于传统杂交育种的新途径,甘蔗分子育种技术正受到世界各国的广泛重视[3]。目前,巴西[4]、美国[5]、澳大利亚[6]、南非[7]和我国[8]的甘蔗科研工作者均已成功使用转基因技术创制出为数众多、各具特色的甘蔗新材料,部分已形成品种。
对于甘蔗而言,胚性愈伤诱导是所有分子育种操作的前提。外植体、生长调节剂、基础培养基均为影响植物胚性愈伤发生的重要因素[9]。在剑麻(Agave sisalana)[10]、苎麻(Boehmeria nivea)[11]、金线莲(Anoectochilus formosanus)[12]、东北红豆杉(Taxus cuspidata)[13]、西洋杜鹃(Rhododendron hybridum)[14]的组培研究中,基础培养基对外植体愈伤诱导和分化均产生了巨大影响。以上研究表明,基础培养基对胚性愈伤发生的影响在植物中是广泛存在的,但具体作用效果随外植体遗传背景和基因型不同而存在差异。甘蔗胚性愈伤诱导研究中,对基础培养基的作用关注较少。作为第一个组培成功的禾本科植物,前人对甘蔗胚性愈伤诱导进行了大量研究,但这些工作大多以MS为基础培养基,对植物激素组合进行优化[15]。然而,戴友铭等[16]发现,甘蔗嫩叶鞘外植体褐化状况随基础培养基的不同而存在差异。这项工作提示了筛选最适基础培养基对甘蔗离体培养的重要作用,基础培养基对甘蔗胚性愈伤发生的影响不应忽视。
此前的研究中,我们以甘蔗栽培品种ROC22幼叶为外植体,使用Dicamba、DA-6、CNS等较新颖的植物生长调节剂,建立了无需继代的甘蔗胚性愈伤直接诱导体系[17]。在此基础上,我们以甘蔗栽培品种ROC22、桂11、云蔗06-407为材料,研究了不同类型培养基、氮源铵硝比和碳源对甘蔗胚性愈伤诱导的影响,以期从基础培养基成分的角度进一步优化甘蔗胚性愈伤直接诱导体系,从而提高新体系在甘蔗育苗和分子育种中的实用价值。
1 材料与方法
所用材料为甘蔗栽培品种ROC22、桂11、云蔗06-407的无性系,种植于云南省农业科学院甘蔗研究所第一科研基地。KM8P培养基有机组分使用过滤灭菌法,无机组分及其他培养基使用湿热灭菌法。MK培养基为自主命名,由MS无机成分和KM8P有机成分组成。
KNO3和NH4NO3为MS培养基的无机氮源,其中钾素含量20 mmol/L,氮素含量60 mmol/L。保证钾素和氮素总量不变的前提下,对氮素铵硝比进行调整,方法见表1。
外植体选取、接种、培养、胚性愈伤判断、发生率计算等方法均与先前报道[17]一致。所得数据使用SPSS 19.0软件进行分析。

表1 氮素铵硝比调整方案
2 结果与分析
2.1 基础培养基类型对甘蔗胚性愈伤发生的影响
表2显示了不同类型基础培养基上的甘蔗胚性愈伤发生情况。基础培养基、植物激素、甘蔗品种对胚性愈伤发生均有着巨大影响。不同材料间胚性愈伤发生率同样具有极显著差异,是为内因,由材料基因型决定。同一种基础培养基和外植体,富含植物生长调节剂的R处理取得的胚性愈伤发生率可比C处理的对照组高出2倍以上,处理间差异达极显著水平。基础培养基同样影响巨大,方差分析结果显示,不同基础培养基造成的差异可达极显著水平。同时,植物激素、甘蔗品种与基础培养基的不同组合间差异分别达到显著和极显著水平,说明甘蔗胚性愈伤发生过程中,基础培养基同两者存在强烈的交互作用。以上结果提示,对于特定的甘蔗材料,摸索适宜的激素组合固然重要,筛选最适基础培养基与之搭配同样是重要的工作,应予重视。
总体而言,N6和1/2MS培养基表现较差,MS和MK8P培养基表现较好,但在所有材料和处理中,最高胚性愈伤发生率均出现在MK培养基上。这说明相对传统常用培养基而言,MK培养基能够更好地支持甘蔗胚性愈伤的发生,并且这种优势不因外植体基因型和植物激素组合而改变。
2.2 培养基无机氮铵硝比对甘蔗胚性愈伤发生的影响
表3中,基础培养基和材料基因型仍然是甘蔗胚性愈伤发生率差异的主要来源。培养基无机氮的不同铵硝比间无显著性差异,说明其并非甘蔗胚性愈伤发生率差异的主要来源。这一结果可能与所选材料优异的氮利用效能有关。
同样,无机氮铵硝比同基础培养基、甘蔗品种间的组合间差异也不显著,表明无机氮铵硝比与二者的作用是彼此独立的。需要注意的是,MK和MS培养基具有相同的无机成分,两者差别仅在于有机成分。因而,本试验中无机氮铵硝比与基础培养基间的相互独立,实际上是无机氮铵硝比与有机组分间的作用独立。
2.3 培养基碳源对甘蔗胚性愈伤发生的影响
如表4所示,材料基因型间差异达到极显著水平,而不同碳源类型和用量对甘蔗胚性愈伤发生均未产生显著影响。同时,碳源类型、用量、材料基因型三者,其两两间交互作用不显著,表明三者的效应是彼此独立的。
本试验中,碳源对甘蔗胚性愈伤发生影响不大。
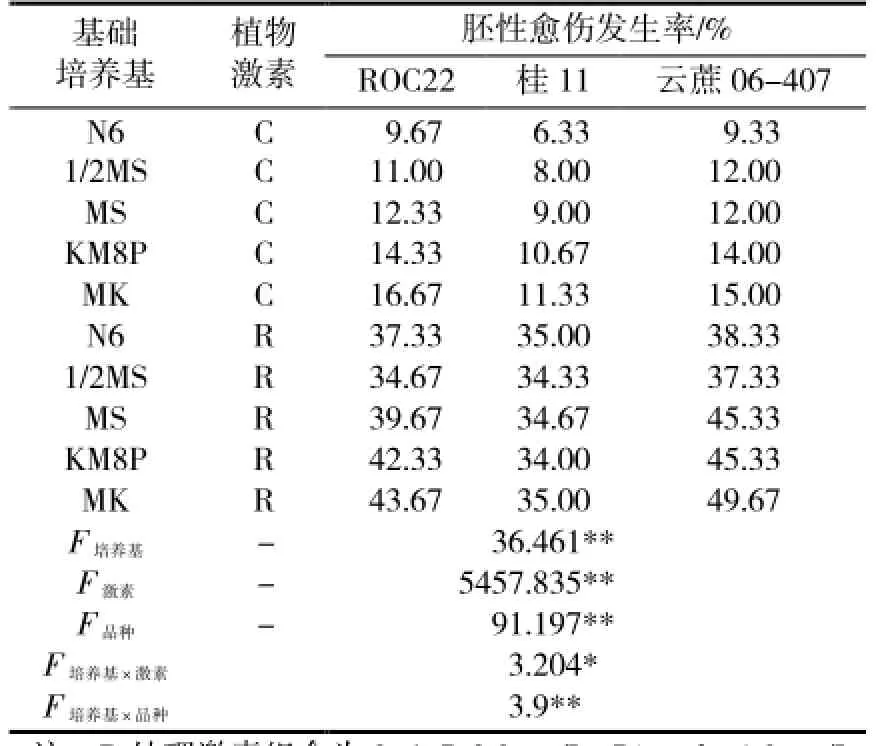
表2 不同基础培养基上甘蔗胚性愈伤发生情况
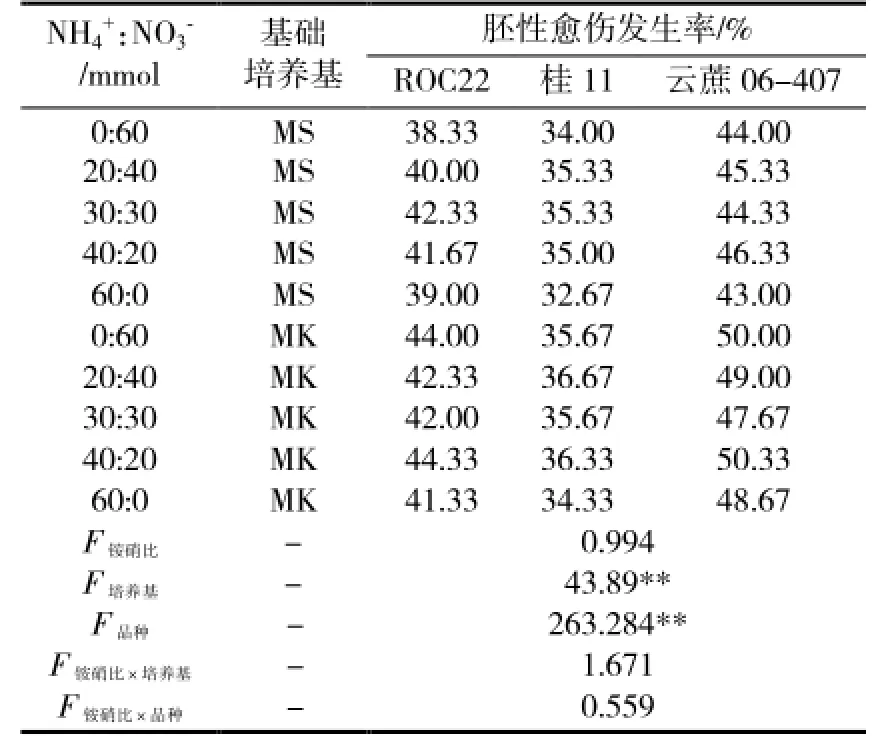
表3 无机氮铵硝比对甘蔗胚性愈伤发生的影响

表4 碳源对甘蔗胚性愈伤发生的影响
3 结论与讨论
基础培养基是植物组织培养的根本基质,为外植体提供水、矿物质、氮源、碳源等最基本的支持,并为植物激素调节外植体细胞分化提供介质[18]。甘蔗不同基因型的遗传、生理、生态特性各异,其胚性愈伤发生过程对营养成分的需求也不尽相同。因此,甘蔗胚性愈伤诱导与基础培养基的选择关系重大。本研究中,MK培养基诱导效果最好。MK培养基由MS培养基和KM8P培养基复合而成,兼具前者高浓度的无机盐[19]和后者丰富的有机质[20]。相对于其他培养基,MK培养基能够更大限度地满足甘蔗胚性愈伤发生的各种营养需求,在适宜的植物激素组合作用下,甘蔗幼叶外植体的分化能力得以充分展示。因此,我们认为,丰富而全面的营养成分,可能是MK优于其他培养基的关键。
培养基中氮素为胚性愈伤发生所必需,不同基础培养基氮素含量与氮素结构不同,而不同植物对氮素的要求也各异[21]。无机氮铵硝比水平可以影响植物组培中外植体分化和器官形成。一般认为,硝态氮作用更温和,效果更理想,因而降低铵硝比可以取得更好的效果。在较低铵硝比的培养基上,西洋杜鹃更易出芽[14],鸡冠花(Celosia cristata L.)也更易开花[22]。但对于甘蔗胚性愈伤诱导而言,不同的无机氮铵硝比间差异不显著。这可能是由于所选甘蔗材料氮素利用效能优异,对两种形态的氮素都能予以充分利用的缘故。
碳源亦为重要的培养基因子。不同的碳源类型和用量均可对组培造成影响。甘薯(Ipomoea batatas L. Lam.)中,葡萄糖和蔗糖对愈伤生长的促进作用大于果糖[23]。浓度为20~30 g/L的葡萄糖、果糖和蔗糖对白桦(Betula platyphylla Suk.)愈伤的增重效果优于10~20 g/L和30~50 g/L[24]。然而,本研究中,碳源不同类型和用量对甘蔗胚性愈伤诱导的作用均未达显著水平。这显示了不同植物对培养基碳源需求的差异。
[1]李杨瑞.现代甘蔗学[M].北京:中国农业出版社,2010.
[2]张跃彬,邓军,黄应昆,等.中国甘蔗产业发展技术[M].北京:中国农业出版社,2011.
[3]张显勇,杨本鹏,张树珍.甘蔗转基因研究进展[J].分子植物育种,2008,5(F11):155-159.
[4]Falco M C,Silva-Filho M C.Expression of soybean proteinase inhibitors in transgenic sugarcane plants:effects on natural defense against Diatraea saccharalis[J].Plant Physiology and Biochemistry,2003,41(8):761-766.
[5]Molinari H B C,Marur C J,Daros E,et al.Evaluation of the stress-inducible production of proline in transgenic sugarcane (Saccharum spp.):osmotic adjustment,chlorophyll fluorescence and oxidative stress[J].Physiologia Plantarum,2007,130(2):218-229.
[6]Zhang L,Xu J,Birch R G.Engineered detoxification confers resistance against a pathogenic bacterium[J].Nature biotechnology, 1999,17(10):1021-1024.
[7]Leibbrandt N B,Snyman S J.Stability of gene expression and agronomic performance of a transgenic herbicide-resistant sugarcane line in South Africa[J].Crop Science,2003,43(2):671-677.
[8]Zhang S Z,Yang B P,Feng C L,et al.Expression of the Grifola frondosa Trehalose Synthase Gene and Improvement of Drought -Tolerance in Sugarcane(Saccharum officinarum L.)[J].Journal of Integrative Plant Biology,2006,48(4):453-459.
[9]高国训.植物组织培养中的褐变问题[J].植物生理学通讯,1999,35(6):501-506.
[10]杨峰,刘巧莲,代真真,等.不同基本培养基和外植体对剑麻愈伤组织诱导及分化的影响[J].热带作物学报,2012,33(3):475-478.
[11]王晓玲,彭定祥,陈小慧.基本培养基对苎麻不同外植体愈伤诱导及分化的影响[J].华中农业大学学报,2003,22(5):431-435.
[12]刘芳,韦鹏霄,岑秀芬,等.外植体和基本培养基对台湾金线莲丛生芽诱导的影响[J].北方园艺,2009(4):103-104.
[13]金贞兰,刘继生,鲁京兰,等.不同培养基对东北红豆杉愈伤组织诱导的影响[J].安徽农业科学,2010(19):9993-9994.
[14]钟宇,张健.西洋杜鹃组织培养技术体系研究(玉)——基本培养基和外植体的选择[J].四川农业大学学报,2001,19(1):37-39.
[15]杨柳,李杨瑞,李小辉.甘蔗组织培养研究进展[J].安徽农业科学,2007,35(12):3490-3492.
[16]戴友铭,岑秀芬,韦鹏霄,等.甘蔗嫩叶鞘外植体褐变相关因子研究[J].广西农业科学,2008,39(2):127-131.
[17]李纯佳,徐超华,姚丽,等.甘蔗胚性愈伤高效诱导系列研究I.幼叶离体培养直接诱导胚性愈伤发生[J].中国糖料,2015,37(1):1-4.
[18]李俊明,朱登云.植物组织培养教程[M].北京:中国农业大学出版社,2005.
[19]Murashige T,Skoog F.A revised medium for rapid growth and bio assays with tobacco tissue cultures[J].Physiologia plantarum, 1962,15(3):473-497.
[20]Kao K N,Michayluk M R.Nutritional requirements for growth of Vicia hajastana cells and protoplasts at a very low population density in liquid media[J].Planta,1975,126(2):105-110.
[21]Dornelas M C,Vieira M L C.Plant regeneration from protoplast cultures of Passiflora edulis var.flavicarpa Deg.,P.amethystina Mikan.and P.cincinnata Mast[J].Plant cell reports,1993,13(2):103-106.
[22]王军玲,陆方方,陈晓梅,等.鸡冠花试管开花初探[J].热带农业科技,2008,30(4):34-35.
[23]吕芝香,王曼丝,董建国.不同碳源对甘薯(Ipomoea batatas L.Lam.)块根愈伤组织的形成和生长的影响[J].植物生理与分子生物学学报,1981.
[24]王博,范桂枝,詹亚光,等.不同碳源对白桦愈伤组织生长和三萜积累的影响[J].植物生理学通讯,2008,44(1):97-99.
Studies on High-efficiency Induction for Sugarcane Embryonic Callus II.Effects of Basal Medium to Sugarcane Embryonic Callus Induction
LI Chun-jia,XU Chao-hua,LU Xin,QIN Wei,LIU Jia-yong
(Yunnan Sugarcane Research Institute,Yunnan Academy of Agricultural Sciences; Yunnan Key Laboratory of Sugarcane Genetic Improvement,Kaiyuan 661699)
Three sugarcane cultivars of ROC22,Gui 11 and Yunzhe 06-407 were tested to study the effects of variant basal mediums,ratio of ammonium to nitrate and carbon sources in sugarcane embryonic callus induction. The results showed that there were significant differences between different kinds of basal mediums,and MK medium was screened to be the optimum.However,there were no significant effects from different nitrogen forms and carbon sources.The results could offer an optimizing for previous inducting system of sugarcane embryonic callus from the aspect of basal medium,and the MK may broaden the choice of basal medium in plant tissue culturing.
sugarcane;embryonic callus;basal medium;ratio of ammonium to nitrate;carbon source
S566.1
A
1007-2624(2015)02-0001-03
10.13570/j.cnki.scc.2015.02.001
2015-02-16
云南省农业科学院甘蔗品种改良与应用省创新团队(2014HC015);云南甘蔗杂交花穗规模化生产与抗旱新品种选育及示范(2014RA059);云南省技术创新人才培养对象(2014HB058)。
李纯佳(1985-),男,湖北省十堰人,硕士,研究实习员,研究方向:甘蔗分子生理学,E-mail:welsper@126.com。
刘家勇(1976-),男,研究员,研究方向:甘蔗遗传育种,E-mail:lljjyy1976@163.com。

