3.0T扩散张量成像定量参数在脑胶质瘤分级中的应用
姜 亮 JIANG Liang
孙 军1 SUN Jun
刘 文2 LIU Wen
肖朝勇2 XIAO Chaoyong
李宗鸿2 LI Zonghong
殷信道1 YIN Xindao
3.0T扩散张量成像定量参数在脑胶质瘤分级中的应用
姜 亮1JIANG Liang
孙 军1SUN Jun
刘 文2LIU Wen
肖朝勇2XIAO Chaoyong
李宗鸿2LI Zonghong
殷信道1YIN Xindao
作者单位
1. 南京医科大学附属南京医院(南京市第一医院)医学影像科 江苏南京 210006
2. 南京医科大学附属脑科医院放射科 江苏南京 210029
目的 探讨3.0T MRI扩散张量成像(DTI)定量参数在胶质瘤分级中的应用价值。资料与方法 回顾性分析经病理证实的51例脑胶质瘤的DTI参数图,将51例患者分为低级别胶质瘤(I~II级,18例)和高级别胶质瘤(III~IV级,33例),比较低级别与高级别胶质瘤肿瘤实质区、瘤周水肿区和健侧脑组织区各向异性分数(FA)、平均扩散系数(MD)、轴向扩散系数(AD)、横向扩散系数(RD)、λ1、λ2及λ3的差异。结果 低级别胶质瘤组肿瘤实质区rMDt、rADt、rRDt、λ1t、λ2t及λ3t高于高级别胶质瘤组(t=-3.235~-2.458,P<0.05),rFAt低于高级别胶质瘤组(t=1.554,P>0.05);低级别胶质瘤组瘤周水肿区rFAe高于高级别胶质瘤组,rMDe、rADe、rRDe、λ1e、λ2e及λ3e低于高级别胶质瘤组,其中仅λ1e差异有统计学意义(t=2.052,P<0.05)。ROC曲线分析显示,rMDt、rADt、rRDt、λ1t、λ2t、λ3t及λ1e鉴别胶质瘤分级的曲线下面积分别为0.746、0.710、0.762、0.735、0.722、0.705、0.374,其中rMDt、rADt、rRDt、λ1t、λ2t、λ3t的ROC曲线下面积在鉴别低级别及高级别胶质瘤中差异均有统计学意义(Z=3.287~4.605,P<0.001)。结论 在应用DTI定量参数对胶质瘤进行分级诊断中,肿瘤实质区rMD、rAD、rRD、λ1、λ2、λ3对低级别及高级别胶质瘤的分级诊断具有一定的价值。
神经胶质瘤;脑肿瘤;磁共振成像;扩散张量成像
胶质瘤是颅内最常见的原发性恶性肿瘤,占颅内肿瘤的35.2%~61.0%[1],不同级别胶质瘤的治疗方案及预后差别很大[2-5],故术前对其级别和恶性程度的准确判断尤为重要。术前胶质瘤的分级常依靠临床表现及影像学特征,如瘤周边界、坏死、肿瘤出血、强化程度等,然而当MRI表现呈相似的强化方式和广泛水肿时则鉴别较困难。扩散张量成像(diffusion tensor imaging,DTI)能在活体检测水分子的扩散运动幅度和方向,其参数可以反映肿瘤组织微观病理特征[3-7]。DTI常用的参数包括各向异性分数(FA)、平均扩散系数(mean diffusivity,MD)、表观扩散系数(ADC)、轴向扩散系数(axial diffusivity,AD)和横向扩散系数(radial diffusivity,RD)。FA、MD、AD及RD均在3个本征值λ1、λ2、λ3基础上计算得出。目前已有较多学者研究DTI常用参数FA、MD在脑胶质瘤分级中的价值,但研究结果存在争议[7-13],而AD、RD和本征值对胶质瘤级别的鉴别诊断较少研究。本文拟全面系统地评价3.0T DTI参数FA、MD、AD、RD、λ1、λ2、λ3在脑胶质瘤术前分级中的应用,为临床诊断提供依据。
1 资料与方法
1.1 研究对象 收集2011年4月1日—2013年12月31日在南京医科大学附属脑科医院诊治并经病理证实的51例脑胶质瘤患者,均行MRI平扫加增强扫描,DTI检查前均未做任何治疗。51例患者中,男32例,女19例;年龄13~71岁,平均(51.7±14.9)岁。主要临床症状:头痛14例,恶心9例,呕吐5例,发作性四肢抽搐4例,意识丧失1例,无明显临床症状18例。WHO分级[14]:II级18例,III级14例,IV级19例,根据WHO分级分为低级别胶质瘤组(I~II级)18例和高级别胶质瘤组(III~IV级)33例。所有患者检查前均签署知情同意书。
1.2 仪器与方法 采用3.0T(Siemens Verio)超导型MRI扫描仪,梯度场强45 mT/m,梯度切换率为150 mT/m·s。使用标准正交头线圈,头颅常规扫描使用自旋回波,扫描序列包括T1WI(TR 250 ms,TE 2.67 ms)、T2WI(TR 3000 ms,TE 102 ms)轴位,层厚6 mm,层间距1.5 mm及横断面DWI(b值=1000 s/mm2)。增强扫描行矢状位、横断面及冠状面T1,造影剂采用钆喷替酸葡甲胺(Gd-DTPA,5 mmol/L),用量0.2 mmol/kg,经肘静脉注射,注射速度2~3 ml/s。DTI扫描采用扩散敏感单次激发回波,扫描参数:TR 9000 ms,TE 104 ms,矩阵128×128,视野230 mm×230 mm,1次采集,b值=1000 s/mm2,扩散敏感梯度方向为30,层厚2.5 mm,层间距0 mm,扫描时间5 min 8 s。
1.3 图像分析 将采集到的数据传至工作站,经工作站自带纤维束成像软件包处理后获得FA图、MD图、λ1图、λ2图、λ3图。由2名影像科主任医师根据常规MRI T1WI、T2WI及增强T1WI图像共同确定感兴趣区(ROI):①肿瘤实质区:T1WI增强扫描强化程度最大区域;②瘤周水肿区:肿瘤周围T1WI呈低信号,T2WI呈高信号区域;③健侧脑组织区:病变对侧相应区域T1WI、T2WI及DTI均未见明显异常区域(图1、2)。ROI范围为15~30像素,避开出血部位和邻近的脑沟、脑池、脑室、血管、颅骨内板。测量FA、MD、λ1、λ2、λ3值,测量3次取平均值,并按公式(1)、公式(2)计算AD、RD值;计算肿瘤实质区(rFAt、rMDt、rADt、rRDt)、瘤周水肿区相对值(rFAe、rMDe、rADe、rRDe),即肿瘤实质区或瘤周水肿区参数值/对应健侧脑组织区参数值,并记录肿瘤实质区(λ1t、λ2t、λ3t)、瘤周水肿区(λ1e、λ2e、λ3e)本征值。

1.4 统计学方法 采用SPSS 19.0软件,低级别胶质瘤和高级别胶质瘤的rFA、rMD、rAD、rRD、λ1、λ2、λ3比较采用成组样本t检验;将P<0.05参数的各数值分别按升序排列,再按等间距均分成5等级,并统计各级的例数,统计结果采用Windows 98版ROCKIT软件进行受试者工作特征(ROC)分析,并绘制ROC曲线,P<0.05表示差异有统计学意义。
2 结果
2.1 低级别与高级别胶质瘤DTI参数比较 51例胶质瘤患者中,肿瘤实质区、瘤周水肿区及健侧脑组织区FA值逐渐升高,而瘤周水肿区MD、AD(λ1)、RD、λ2、λ3值最高,肿瘤实质区次之,健侧脑组织区最低(图1、2)。在肿瘤实质区,低级别胶质瘤组rFAt低于高级别胶质瘤组,但差异无统计学意义(P>0.05),rMDt、rADt、rRDt、λ1t、λ2t、λ3t高于高级别胶质瘤组,差异有统计学意义(P<0.05),见表1;在瘤周水肿区,低级别胶质瘤组rFAe高于高级别胶质瘤组,rMDe、rADe、rRDe、λ1e、λ2e、λ3e低于高级别胶质瘤组,其中仅λ1e在低、高级别胶质瘤组比较差异有统计学意义(P<0.05),见表2。
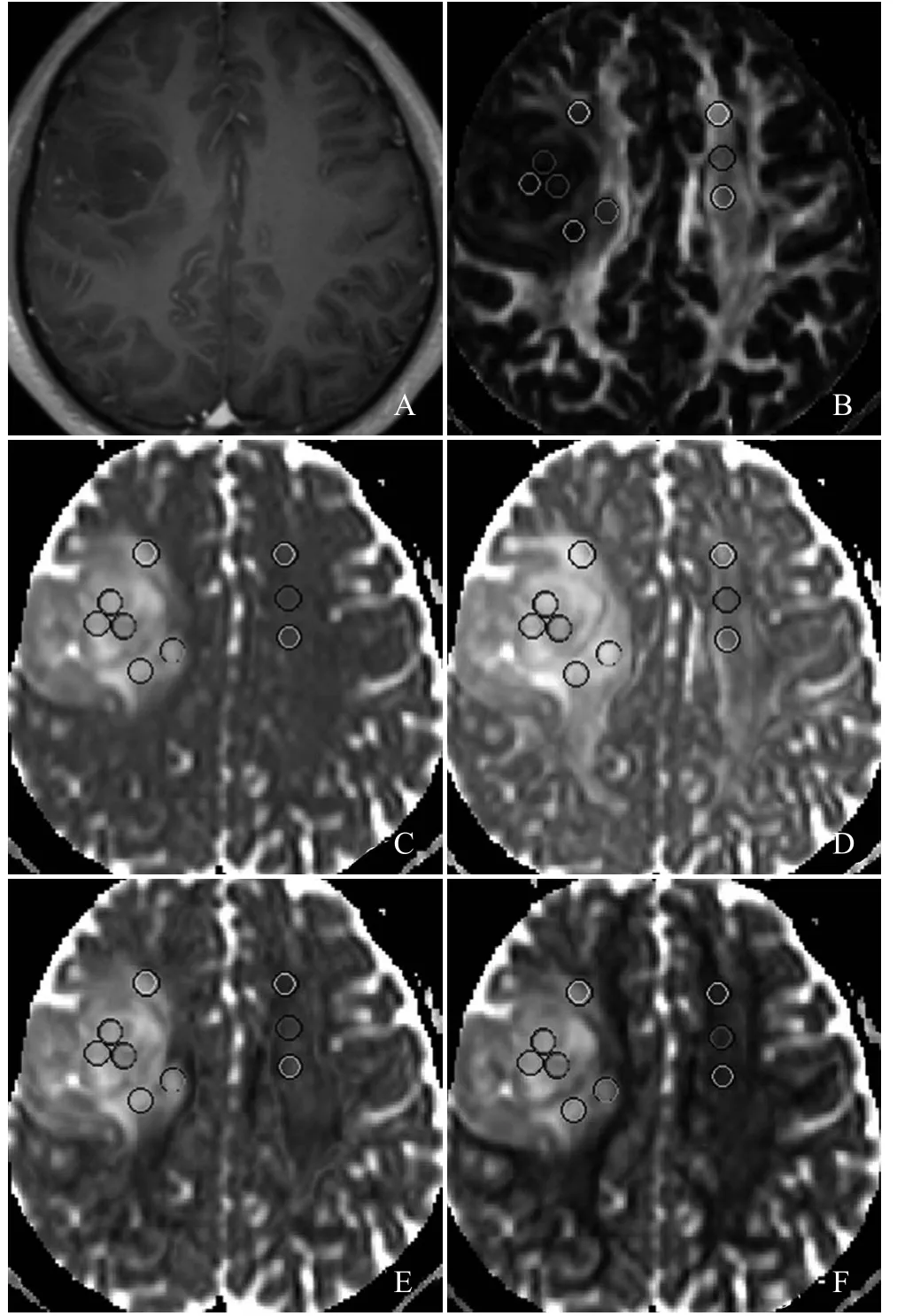
图1 男,49岁,右侧额叶少突胶质细胞瘤(II级)。T1增强扫描示肿瘤强化不明显,可见小片状水肿信号影(A);B~F分别为FA图、MD图、λ1图、λ2图、λ3图,图中圆圈代表ROI,rFAt、rMDt、rADt、rRDt、λ1t、λ2t、λ3t分别为0.14、1.84、1.14、2.83、1.33、1.24、1.13,rFAe、rMDe、rADe、rRDe、λ1e、λ2e、λ3e分别为0.26、2.18、1.46、3.19、1.71、1.40、1.28
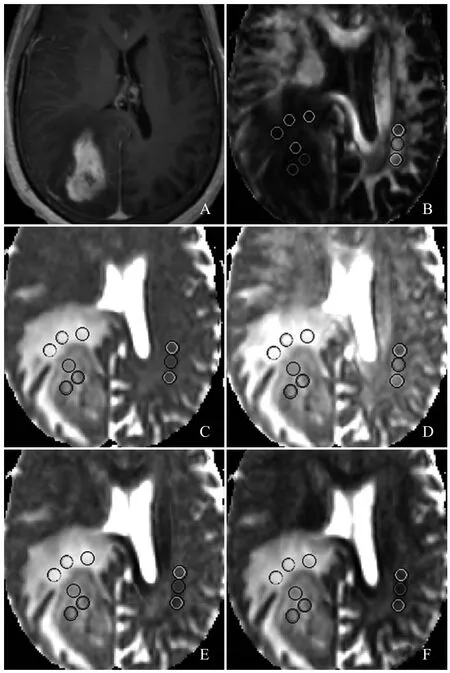
图2 男,58岁,右侧顶枕叶间变型星形胶质细胞瘤(III级)。T1增强扫描示肿瘤实质区明显强化,周围可见大片状水肿信号影(A);B~F分别为FA图、MD图、λ1图、λ2图、λ3图,图中圆圈代表ROI,rFAt、rMDt、rADt、rRDt、λ1t、λ2t、λ3t分别为0.19、1.72、1.14、2.38、1.41、1.22、1.16,rFAe、rMDe、rADe、rRDe、λ1e、λ2e、λ3e分别为0.22、2.47、1.60、3.52、1.99、1.88、1.63
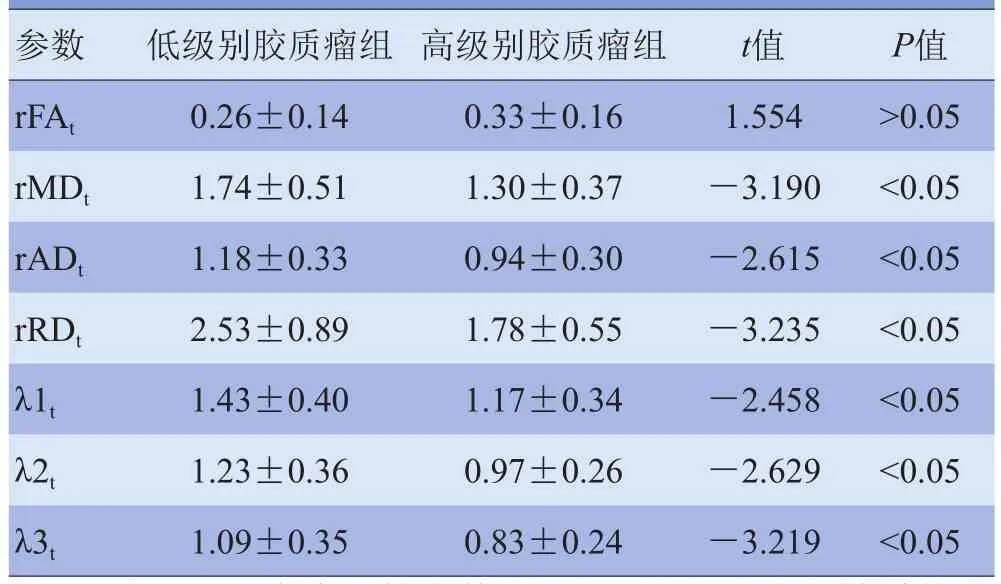
表1 低级别与高级别胶质瘤组肿瘤实质区DTI参数比较
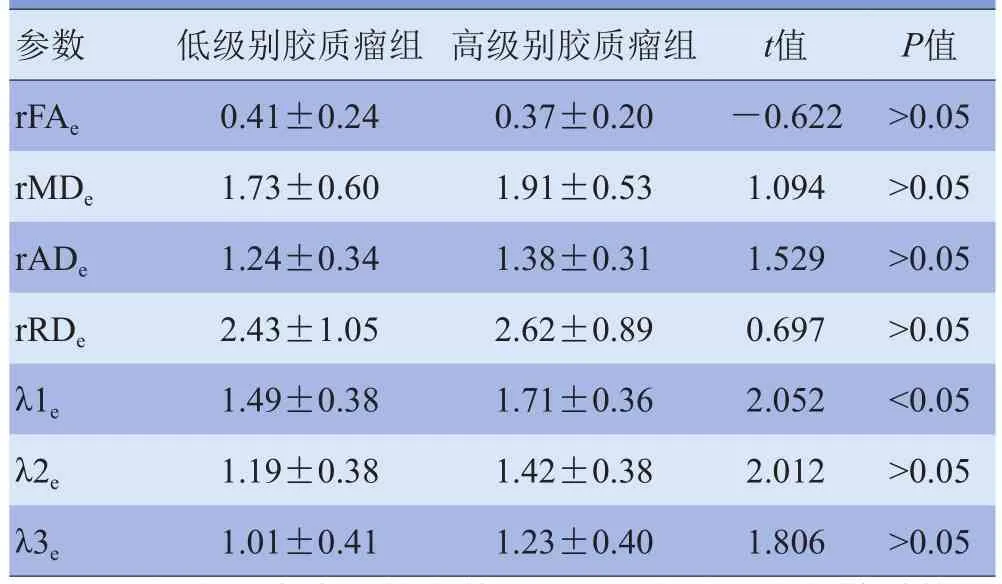
表2 低级别与高级别胶质瘤组瘤周水肿区DTI参数比较
2.2 低级别与高级别胶质瘤的ROC曲线分析 所有胶质瘤rMDt、rADt、rRDt、λ1t、λ2t、λ3t、λ1e的误差条图见图3。所有胶质瘤患者DTI参数的ROC曲线分析见表3及图4。rMDt、rADt、rRDt、λ1t、λ2t、λ3t的ROC曲线下面积两两比较,差异均无统计学意义(P>0.05),而这6个参数的ROC曲线下面积在低级别及高级别胶质瘤中差异均有统计学意义(Z=4.259、3.905、4.605、4.023、3.680、3.287,P<0.001)。

表3 所有胶质瘤DTI参数的ROC曲线分析
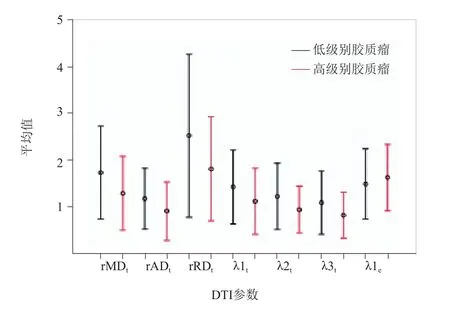
图3 低级别与高级别胶质瘤DTI参数相对值比较。“—”表示将低级别与高级别胶质瘤按等间距均分成5等级;各组第一列数字代表低级别胶质瘤各级例数,第二列代表高级别胶质瘤各级例数
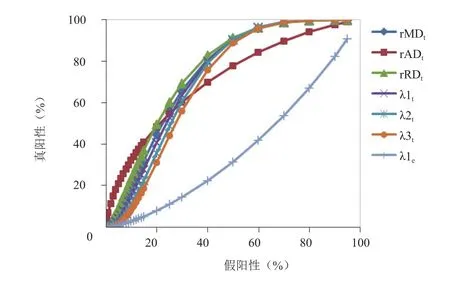
图4 DTI各参数的ROC曲线
3 讨论
DTI的各向异性扩散类似一个椭圆体,可用本征值λ1、λ2、λ3来描述扩散幅度,λ1代表椭圆体的主轴,即最大扩散率(或称轴向扩散系数AD),λ2、λ3为垂直于主轴的两个不同方向,两者的均值即为横向扩散系数RD。MD、FA等DTI常用参数均由λ1、λ2、λ3计算而来,故λ1、λ2、λ3较MD、FA更能从微观上反映肿瘤内部不均质性,评价肿瘤组织的病理特征,进而提高对胶质瘤分级的诊断价值。本研究结果显示,低级别胶质瘤rADt、rRDt、λ1t、λ2t、λ3t均高于高级别胶质瘤,这是因为随着肿瘤级别的增加,肿瘤细胞数量和密度均增加,核异型性大,多核和巨核细胞构成比和核浆体积比增加,由此导致肿瘤实体微环境中的水分子扩散受限更明显,高级别胶质瘤肿瘤实质区轴向扩散和横向扩散均较低级别胶质瘤受限明显。本研究对瘤周水肿区本征值进行比较发现,低级别胶质瘤rADe、rRDe、λ1e、λ2e、λ3e值稍低于高级别胶质瘤,这是因为脑肿瘤在生长过程中,血-脑屏障被破坏,瘤周可出现较明显的血管源性水肿,胶质瘤细胞还可以分泌胶原溶解酶IV对周围胶原产生破坏,正常组织溶解[11]。胶质瘤的瘤周水肿区不仅存在异常形态的毛细血管和间质水肿,还可发现散在的肿瘤细胞沿着新生血管或扩张的血管浸润生长。rADe、rRDe、λ1e、λ2e、λ3e在低级别与高级别胶质瘤中仅λ1e差异有统计学意义,这可能是由于水分子沿神经纤维方向扩散较容易,沿垂直于髓鞘方向的扩散则受限,水分子更倾向于沿神经纤维束走形的方向进行扩散[13],而高级别胶质瘤轴突、髓鞘损伤更严重。由此可见rADe、rRDe、λ2e、λ3e尚不能鉴别胶质瘤分级情况,而λ1e可能有助于胶质瘤分级。
目前关于FA及MD对脑胶质瘤级别预测的研究较多,但结果尚存在争议[7-10,13,15-18]。Lee等[8]和Kinoshita等[7]的研究结果表明FA值与肿瘤实质区细胞密度呈明显正相关,与ADC值呈明显负相关;王昌新等[13]认为在低级别和高级别胶质瘤肿瘤实质区、肿瘤边缘及瘤周水肿区的平均FA和ADC值,除肿瘤实质区平均FA值外,其余差异均有统计学意义;Liu等[17]认为幕上无强化的低级别胶质瘤平均FA值和最大FA值明显低于高级别胶质瘤(P<0.001)。Piyapittayanan等[18]发现低级别和高级别胶质瘤肿瘤实质区及瘤周水肿区的FA值差异无统计学意义,ADC值差异有统计学意义(P<0.05),且ADC肿瘤实质区/ADC正常胼胝体区鉴别两组肿瘤具有较高的准确度(ROC曲线下面积为0.74);而Lu等[10]认为低级别和高级别胶质瘤的ADC值无显著差异(P>0.05)。为了消除不同研究对象间脑组织扩散的个体差异性,提高研究结果的可信度,本研究对肿瘤实质区、瘤周水肿区的相对值(rFA、rMD、rAD、rRD)进行分析,结果表明,低级别与高级别胶质瘤rFAt差异无统计学意义,而rMDt差异有统计学意义,说明在胶质瘤分级中,MD值的测量价值可能更优于FA值,与既往多数研究结果一致[7-8,19-20];而低级别与高级别胶质瘤rFAe、rMDe差异均无统计学意义,与既往研究结果一致[18,21]。
本研究通过对低级别与高级别胶质瘤分级中差异有统计学意义的参数rMDt、rADt、rRDt、λ1t、λ2t、λ3t、λ1e进行ROC曲线分析,结果显示rMDt、rADt、rRDt、λ1t、λ2t、λ3t的ROC曲线下面积均在0.70以上,并在低级别及高级别胶质瘤中差异均有统计学意义,表明rMDt、rADt、rRDt、λ1t、λ2t、λ3t对低级别与高级别胶质瘤的鉴别有一定的诊断能力,高级别胶质瘤的肿瘤实质部分细胞密度或肿瘤细胞核总面积高于低级别胶质瘤[22],肿瘤细胞排列紧密且数量增多,核异形性大,细胞外间隙减小,扩散受限,使得肿瘤实质区DTI各参数有助于胶质瘤分级。rMDt、rADt、rRDt、λ1t、λ2t、λ3t的ROC曲线下面积两两比较差异无统计学意义,可见上述6个参数在低级别及高级别胶质瘤的鉴别诊断中价值相仿。λ1e的ROC曲线下面积<0.5,表明λ1e鉴别低级别与高级别胶质瘤分级时具有较低的真阳性率和较高的假阳性率,当λ1e为某界值点时,低级别胶质瘤极易误诊为高级别胶质瘤;相反,高级别胶质瘤极易误诊为低级别胶质瘤。因此,λ1e尚不能鉴别诊断低级别与高级别胶质瘤。
然而,本研究仅将胶质瘤分为低级别与高级别,尚未达到WHO分级标准(I~IV级);未对DTI定量参数及比值与肿瘤ROI的组织病理学特征进行相关性分析,无法客观评价两者的相关性,有待进行更深入的研究。
总之,在应用DTI定量参数评估胶质瘤的分级中,肿瘤实质区rMD、rAD、rRD、λ1、λ2、λ3在低级别与高级别胶质瘤比较中差异有统计学意义,且ROC曲线下面积均在0.70以上,对低级别与高级别胶质瘤的分级预测诊断具有一定的价值。
[1] 崔建和, 柏根基, 郭莉莉. 脑胶质瘤ADC值及H1-波谱与病理分级的相关性研究. 重庆医学, 2011, 40(14): 1370-1372, 后插1-后插2.
[2] Chen J, Li Y, Yu TS, et al. A restricted cell population propagates glioblastoma growth after chemotherapy. Nature, 2012, 488(7412): 522-526.
[3] Westermark B. Glioblastoma--a moving target. Ups J Med Sci, 2012, 117(2): 251-256.
[4] Van Gool S, Maes W, Ardon H, et al. Dendritic cell therapy of high-grade gliomas. Brain Pathol, 2009, 19(4): 694-712.
[5] Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol, 2009, 10(5): 459-466.
[6] Stadlbauer A, Ganslandt O, Buslei R, et al. Gliomas: histopathologic evaluation of changes in directionality and magnitude of water diffusion at diffusion-tensor MR imaging. Radiology, 2006, 240(3): 803-810.
[7] Kinoshita M, Hashimoto N, Goto T, et al. Fractional anisotropy and tumor cell density of the tumor core show positive correlation in diffusion tensor magnetic resonance imaging of malignant brain tumors. Neuroimage, 2008, 43(1): 29-35.
[8] Lee EJ, Lee SK, Agid R, et al. Preoperative grading of presumptive low-grade astrocytomas on MR imaging: diagnostic value of minimum apparent diffusion coefficient. Am J Neuroradiol, 2008, 29(10): 1872-1877.
[9] Goebell E, Paustenbach S, Vaeterlein O, et al. Low-grade and anaplastic gliomas: differences in architecture evaluated with diffusion-tensor MR imaging. Radiology, 2006, 239(1): 217-222.
[10] Lu S, Ahn D, Johnson G, et al. Diffusion-tensor MR imaging of intracranial neoplasia and associated peritumoral edema: introduction of the tumor infiltration index. Radiology, 2004, 232(1): 221-228.
[11] 史瑞华, 漆剑频, 王承缘. 扩散张量各向异性分数在星形细胞瘤中的诊断价值. 中国医学影像技术, 2005, 21(7): 1006-1008.
[12] 刘兆玉, 孙博, 范国光, 等. 弥散张量成像鉴别高级别胶质瘤与单发转移瘤的价值. 中国医学影像学杂志, 2008, 16(4): 255-258.
[13] 王昌新, 刘影, 费小瑞, 等. 弥散张量成像相对各向异性值和相对表观系数值在评价脑胶质瘤级别中的研究. 实用放射学杂志, 2008, 24(10): 1301-1304.
[14] Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol, 2007, 114(2): 97-109.
[15] 冯晨, 印弘, 宦怡, 等. 脑胶质瘤磁共振扩散张量成像与病理对照研究. 实用放射学杂志, 2010, 26(6): 780-782.
[16] 郭军, 孟郊, 韩彤. 脑胶质瘤磁敏感信号及表观扩散系数与病理分级的相关性研究. 中国医学影像学杂志, 2013, 21(12): 894-898.
[17] Liu X, Tian W, Kolar B, et al. MR diffusion tensor and perfusion-weighted imaging in preoperative grading of supratentorial nonenhancing gliomas. Neuro Oncol, 2011, 13(4): 447-455.
[18] Piyapittayanan S, Chawalparit O, Tritakarn SO, et al. Value of diffusion tensor imaging in differentiating high-grade fromlow-grade gliomas. J Med Assoc Thai, 2013, 96(6): 716-721.
[19] Ma L, Song Z. Differentiation between low-grade and highgrade glioma using combined diffusion tensor imaging metrics. Clin Neurol Neurosurg, 2013, 115(12): 2489-2495.
[20] Hilario A, Ramos A, Perez-Nuñez A, et al. The added value of apparent diffusion coefficient to cerebral blood volume in the preoperative grading of diffuse gliomas. Am J Neuroradiol, 2012, 33(4): 701-707.
[21] Server A, Graff BA, Josefsen R, et al. Analysis of diffusion tensor imaging metrics for gliomas grading at 3 T. Eur J Radiol, 2014, 83(3): e156-e165.
[22] Louis DN, Holland EC, Cairncross JG. Glioma classification: a molecular reappraisal. Am J Pathol, 2001, 159(3): 779-786.
(本文编辑 张春辉)
Application of Diffusion Tensor Imaging Quantitative Parameters in Grading of Cerebral Glioma on a 3.0T Scanner
Purpose To study the application of MR diffusion tensor imaging (DTI) quantitative parameters in grading of cerebral glioma on a 3.0T scanner. Materials and Methods DTI mapping of 51 cases of cerebral glioma confirmed by pathology were retrospective analyzed. All the cases were divided into two groups: low-grade gliomas (grade I-II, 18 cases) and high-grade gliomas (grade III-IV, 33 cases). Value of fractional anisotropy (FA), mean diffusivity (MD), axial diffusivity (AD), radial diffusivity (RD), λ1, λ2, and λ3 of the tumor, peritumoral edema and contralateral tissue area were recorded and compared. Results rMDt, rADt, rRDt, λ1t, λ2tand λ3tof tumor in the low-grade glioma group were higher than those in the high-grade glioma group, and the difference was statistically significant (t=-3.235--2.458, P<0.05). rFAtwas lower in the low-grade glioma group, and the difference was not statistically significant (t=1.554, P>0.05). rFAeof peritumoral edema in the low-grade glioma group was higher than those in the high-grade group, while rMDe, rADe, rRDe, λ1e, λ2eand λ3ewere lower in the low-grade group. All differences were not statistically significant except λ1e(t=2.052, P<0.05). ROC analysis showed the area under the curve (Az) of rMDt, rADt, rRDt, λ1t, λ2t, λ3tand λ1ewere 0.746, 0.710, 0.762, 0.735, 0.722, 0.705 and 0.374, respectively. Az value of rMDt, rADt, rRDt, λ1t, λ2t, λ3twere statistically different between the low- and high-grade gliomas (Z=3.287-4.605, P<0.001). Conclusion Among DTI quantitative parameters on glioma grading, rMD, rAD, rRD, λ1, λ2, and λ3 of tumor area are helpful in grading gliomas.
Glial cell tumors; Brain neoplasms; Magnetic resonance imaging; Diffusion tensor imaging
10.3969/j.issn.1005-5185.2015.04.003
殷信道
Department of Radiology, Nanjing First Hospital, Nanjing Medical University, Nanjing 210006, China
Address Correspondence to: YIN Xindao
E-mail: y.163yy@163.com
R749.41;R730.42
2014-11-08
修回日期:2015-03-12
中国医学影像学杂志
2015年 第23卷 第4期:250-254,259
Chinese Journal of Medical Imaging
2015 Volume 23(4): 250-254, 259

