射频消融联合肝动脉栓塞化疗治疗无法切除的结直肠癌肝转移瘤的疗效
张世杰,石 明,方万强,付春利,邓国敏(开平市中心医院外一科,江门 59300;中山大学肿瘤防治中心肝胆科; 通讯作者,E-mail:Shiming@mail.sysu.edu.cn)
肝脏是结直肠癌转移(colorectal cancer liver metastasis,CRLM)最常见的靶器官,约50%-75%的结直肠癌患者会发生肝转移,并因而死亡[1]。CRLM的治疗方法有多种,手术是可切除CRLM唯一有可能治愈的手段[2],但仅有约10%-15%的结直肠癌肝转移患者能够接受手术。对于无法手术的结直肠癌肝转移患者目前普遍采用全身化疗,患者的中位生存期约为20个月[3]。而肝动脉化疗栓塞(transcatheter artery chemoembolization,TACE)作为原发性肝癌的重要治疗手段之一,也在结直肠癌肝转移治疗中广泛应用,以提高患者中位生存期。近年来,射频消融术(radiofrequency ablation,RFA)已被运用在不能切除的CRCLM患者中。由于RFA具有精确、微创、可重复性的优点;联合TACE时可增强互补作用,但二者联合应用的报道不多,选择广东医学院附属开平市中心医院外一科无法手术切除的62例结直肠癌肝转移患者,对RFA联合TACE治疗34例和TACE治疗28例患者的临床资料进行回顾性分析。
1 对象与方法
1.1 病例选择
选择2006-06~2010-06在广东医学院附属开平市中心医院外一科进行治疗的CRLM患者,符合下列标准的病例进行回顾性分析:①原发灶病理确诊结直肠癌并已切除,影像学表现典型的肝转移瘤;②经评估不适于外科手术切除或行初次手术后肝内复发;③手术前及术后随访期间进行影像学(增强CT或MRI)评估;④在RFA治疗前后接受全身治疗;⑤病例及随访资料完整。经选择符合上述条件的病例共计62例,分为RFA+TACE治疗(联合组)34例,TACE治疗(TACE组)28例。
本组62例患者中男42例,女20例;年龄26-83岁。原发肿瘤位于结肠43例,直肠19例。同时性肝转移22例,延时性肝转移40例。同时伴有肝外其他部位转移7例。肝转移瘤累及单叶27例,累及双叶35例;肝转移瘤病灶单发19例,多发43例;转移瘤最大径<5 cm 14例,≥5 cm 48例。初次发现肝转移时癌胚抗原(carcinoembryonic antigen,CEA)水平正常(≤5 μg/m1)11 例,升高51例;糖类抗原 199(carbohydrate antigen 199,CA199)水平正常(≤37U/m1)43例,升高19例,随访截至2013-06-30。两组患者间平均年龄、原发灶、病灶数目及肿瘤最大直径比较,差异无统计学意义(见表1)。
表1 两组临床资料比较(±s)Table 1 Com parison of baseline between two groups(±s)
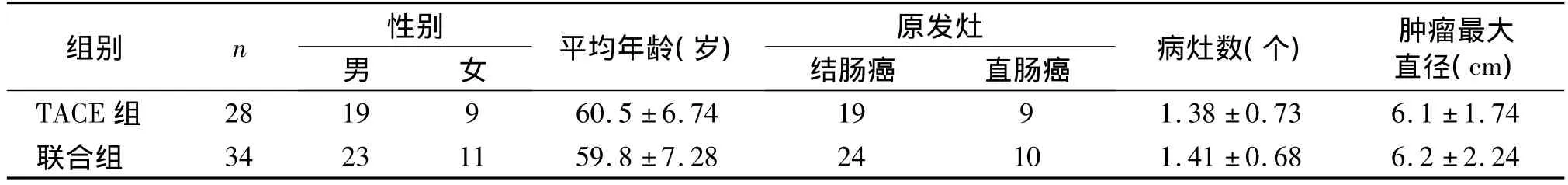
表1 两组临床资料比较(±s)Table 1 Com parison of baseline between two groups(±s)
组别 n 性别男 女 平均年龄(岁) 原发灶结肠癌 直肠癌 病灶数(个) 肿瘤最大直径(cm)TACE组28 19 9 60.5 ±6.74 19 9 1.38 ±0.73 6.1 ±1.74联合组34 23 11 59.8 ±7.28 24 10 1.41 ±0.68 6.2 ±2.24
1.2 治疗方法
TACE 组:采用 Seldinger技术[4],经股动脉用库克或亚希路导管插管至腹腔干造影。根据转移瘤的部位将导管选择进入肝左或肝右动脉或其分支,灌注氟尿嘧啶750-1 000 mg、奥沙利铂100-200 mg、48%超液化碘油5-20 ml与丝裂霉素6 mg混悬剂。治疗间隔≥1.5个月。
联合组(RFA+TACE):TACE治疗基础上,我们采用的RFA电极为welfare公司生产WE7568多极射频消融治疗仪,脉冲功率200 W,脉冲频率为290 kHz;消融针为带侧孔的WHK24多极消融电极,消融针直径为16G,长度为15 cm。所有的RFA治疗在超声或CT导引并在静脉麻醉下经皮穿刺进行,对于<5 cm的单个病灶,采用单位点单次消融,对于5 cm和/或多发病灶一般采用叠加多位点消融,消融范围涵盖周边非肿瘤组织>1.0 cm。所有本组患者均先行TACE治疗,2周后再接受RFA治疗,其中行1次RFA治疗者16例,2次RFA治疗者18例。具体治疗方法:①RFA治疗前准备:术前给予镇静药物,穿刺点1%利多卡因局部麻醉及联合常规静脉麻醉。②操作:患者取仰卧或俯卧位CT扫描定位。若病变范围较大,则行多次穿刺多点治疗,使消融范围超过病变区1.0 cm,达到肿瘤组织充分坏死。拔针前进行电凝针道处理。③术后处理:患者卧床休息4-6 h,护肝、止血对症支持治疗,出院前常规检查血常规及肝功能。RFA消融前例行增强CT扫描或MRI检查以确定病变位置与范围并判断预后,术后4周内随访采用CT或MRI复查病灶坏死情况。
1.3 观察指标
①治疗1周后患者肝功能情况:谷丙转氨酶、血清白蛋白及总胆红素。②治疗后4周增强CT/MRI检查肿瘤缓解率(RR%)。参考WHO实体肿瘤评价标准[5],以 CR+PR 计算,即:完全缓解(CR),所有可见病变完全消失,并至少维持4周;部分缓解(PR),肿瘤病灶最大径及其最大垂径乘积缩小>50%,并维持4周以上;好转(MR),肿瘤病灶两径乘积缩小25%以上,但<50%,无新病灶出现;稳定(SD),肿瘤病灶两径乘积缩小<25%或增大<25%,无新病灶出现;进展(PD),肿瘤病灶两径乘积增大>25%或出现新病灶。自治疗开始之13起计算生存期,所有均经6个月以上的随访。③治疗后的生存率比较。④术后并发症情况。
1.4 统计学分析
2 结果
2.1 治疗1周后患者肝功能变化
两组均在1个疗程治疗开始1周后时行肝功能化验,两组比较无统计学意义(见表2)。
表2 两组间治疗1周后肝功能比较(±s)Table 2 Comparison of liver function at week 1 after treatment between two groups(±s)
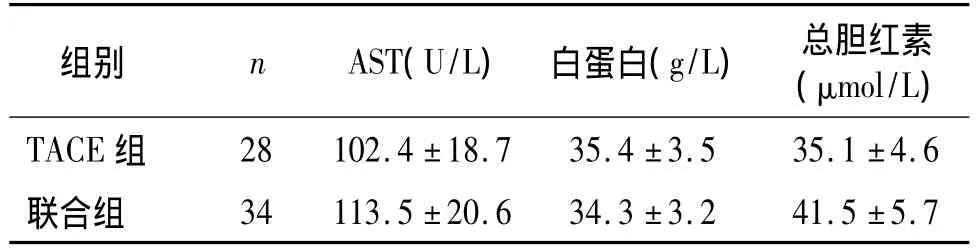
表2 两组间治疗1周后肝功能比较(±s)Table 2 Comparison of liver function at week 1 after treatment between two groups(±s)
组别 n AST(U/L) 白蛋白(g/L) 总胆红素(μmol/L)TACE组28 102.4 ±18.7 35.4 ±3.5 35.1 ±4.6联合组34 113.5 ±20.6 34.3 ±3.2 41.5 ±5.7
2.2 治疗后肿瘤坏死率比较
两组均在1个疗程结束后的4周行强化CT/MRI检查,对比治疗前后影像变化,判断病灶坏死程度。TACE组和联合组治疗后肿瘤坏死总有效率(CR+PR)分别为 60.7%(17/28)和 94.1%(32/34),两组间差异有统计学意义(P<0.05,见表3)。
2.3 生存率比较
随访结果显示,两组半年生存率几乎相同,均在90%以上,差异无统计学意义。而1年、2年、3年的生存率比较,联合组明显优于TACE组,统计显示有较明显的差异(P<0.05,见表4)。
表3 两组间肿瘤坏死率比较(±s)Table 3 Comparison of tumor necrosis rate at week 4 after treatm ent between two groups(±s)

表3 两组间肿瘤坏死率比较(±s)Table 3 Comparison of tumor necrosis rate at week 4 after treatm ent between two groups(±s)
组别 n CR PR MR+SD PD 总有效率TACE组28 6 11 10 1 60.7%联合组34 27 5 2 0 94.1%

表4 两组间不同时间生存率比较 例(%)Table 4 Com parison of survival rate between two groups cases(%)
2.4 术后并发症
两组术后都有不同程度发热、纳差表现,持续时间不一,患者经对症处理后均可好转。无血管损伤内出血及消化道出血病例,1例RFA治疗出现血气胸经引流后治愈,无围手术期死亡。
3 讨论
肝脏是结直肠癌血行转移最主要的靶器官,结直肠癌肝转移是结直肠癌患者最主要的死亡原因,是结直肠癌治疗的重点和难点之一。而肝转移灶无法切除患者的中位生存期仅6.9个月,5年生存率接近0[6],手术切除肝转移灶是目前治愈结直肠癌肝转移最佳治疗方法,中位生存期为35个月,5年生存率达30%-50%[7]。仅有10%-20%的肝转移患者在治疗初始能够接受手术,对于无法切除的结直肠癌肝转移,通过积极的综合治疗可以改善患者的预后、延长生存时间。单一静脉化疗对肝转移瘤治疗的结果也很不令人满意,一般有效率为10%-20%;但动脉化疗栓塞有效率可达30%-50%,中位生存期8-16个月。还有其他几种治疗手段均为局部治疗,其适应证和疗效均受转移灶大小和数目的影响。在肝转移瘤的综合治疗中应充分考虑整体治疗与局部治疗互相促进的辩证关系,才能提高整体疗效与生存率。
经肝动脉灌注化疗药物,肝脏病灶局部的药物浓度远高于静脉化疗,注入栓塞剂进一步起到栓塞肿瘤血管、缓慢释放化疗药物的作用,提高局部疗效。我们回顾性分析28例无法手术切除的结直肠癌肝转移患者经TACE治疗后的疗效,结果显示,患者的中位生存时间为 18个月,2年生存率为52.3%,与闫东等[8]报道的 TACE治疗结直肠癌肝转移者的中位生存时间为16.4个月接近。但由于肝癌具有肝动脉和门静脉的双重血供,单纯TACE常难以取得满意疗效,随着TACE次数的增多,肝功能受损加重,远期效果不够理想,需与其他局部治疗手段相结合。
治疗肝癌的效果与其所产生的组织坏死灶大小直接相关,多电极射频针可产生5 cm的凝固毁损灶,治疗肝癌与其他局部治疗方法相比具有肿瘤完全坏死率较高、肝内复发率较低、治疗次数较少、患者生存时间较长的优势。射频消融(RFA)技术作为一种有效的局部治疗手段越来越广泛运用于CRLM的治疗中,它通过影像导向CT或彩超等引导,单个位点一次消灭直径<5 cm范围内的瘤组织,对于病灶为0级动力学杀灭,具有精准、微创、可重复性的优点;联合化疗时可延长化疗间歇期,近期疗效已经得到越来越多的肯定,但是对于长期生存率较少有大宗报道[9]。赵明等[10]研究报道RFA治疗结直肠癌肝转移可以取得相对较好的临床预后,中位生存期为29个月,1,3年生存率分别为98%,27%,联合化疗更能提高中位生存期至32个月。分析我院RFA联合TACE治疗组,1,2,3年生存率分别为 82.4%,52.3%,26.5%,取得相当疗效。RFA属于微创治疗方法,尽管不同术式并发症的发生率各不相同,总体来看,RFA并发症的发生率为2%-6%,极少发生与RFA治疗相关的死亡[11]。RFA联合TACE可以使患者生存获益的主要原因可归结于:①TACE后由于碘油积聚,更易于FRA治疗时定位准确,有助于乏血供肿瘤治疗;②对化疗残留病灶的彻底杀灭;③可以延长化疗间歇期,有效恢复患者体力状况以接受二线或三线治疗;④部分肝转移患者经RFA治疗后表现为影像学完全缓解,可将化疗再次提升到“术后辅助”的阶段,也非常有利于患者心理状态的调整。联合化疗的RFA在技术层面上需要注意消融范围,理论上包括所有病变部位,以取得较高的局部控制率。
总之,本研究对无法手术切除的CRLM能取得较为满意的效果,且无严重并发症发生,初步说明RFA联合TACE治疗无法手术切除的CRLM是安全有效的。CRLM的疗效与肝转移瘤的大小和数目、是否合并肝外转移等多因素相关,需与全身治疗、分子靶向治疗结合,随着各种治疗方法优化组合的出现,CRLM治疗前景更加广阔,为提高患者生存率、改善生存质量提供了保证,同时应充分考虑个体因素,以选择最佳联合治疗方案。
[1]Aong Y,Fortner J,Sun RL,et al.Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer:analysis of 1001consecutive cases[J].Ann Surg,1999,230(3):309-321.
[2]Kato T,Yasui K,Hirai T,et al.Therapeutic results for hepatic metastasis of colorectal cancer with special reference to effectiveness of hepatectomy:Analysis of prognostic factors for 763 cases recorded at 18 institutions[J].Dis Colon Rectum,2003,46(10 suppl):S22-S31.
[3]Tournigand C,André T,Achille E,et al.FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer:a randomized GERCOR study[J].J Clin Oncol,2004,22:229-237.
[4]王建华,王小林,颜志平,等.腹部介入放射学[M].上海:上海医科大学出版社,1998:63.
[5]杨秉辉,夏景林.“原发性肝癌的临床诊断与分期标准”及说明[J].肿瘤杂志,2002,22:75.
[6]Arru M,Aldrighetti L,Castoldi R,et al.Analysis of prognostic factors influencing long-term survival after hepatic resection for metastatic colorectal cancer[J].World J Surg,2008,32(1):93.
[7]Van den Eynde M,Hendlisz A.Treatment of colorectal liver metastases:a review[J].Rev Recent Clin Trials,2009,4(1):56-62.
[8]闫东,李槐,魏文强,等.消化道肿瘤肝转移经肝动脉介入治疗的疗效评价及预后影响因素分析[J].中华肿瘤杂志,2007,29(11):867-870.
[9]Wong SL,Mangu PB,Choti MA,et al.American Society of Clinical Oncology 2009 clinical evidence review on radiofrequency ablation of hepatic metastases from colorectal cancer[J].J Clin Onco1,2010,28:493-508.
[10]赵明,王健鹏,吴沛宏,等.射频消融治疗结直肠癌肝转移及其预后因素分析[J].中华医学杂志,2010,90(23):1587-1592.
[11]Gillams AR,Lees WR.Radiofrequency ablation of colorectal liver metastases in 167 patients[J].Eur Radiol,2004,14:2262-2267.

