膳食多酚对淀粉消化吸收的影响
吕 霞 叶发银 刘 嘉 赵国华,2
(西南大学食品科学学院1,重庆 400715)
(重庆市特色食品工程技术研究中心2,重庆 400715)
膳食多酚对淀粉消化吸收的影响
吕 霞1叶发银1刘 嘉1赵国华1,2
(西南大学食品科学学院1,重庆 400715)
(重庆市特色食品工程技术研究中心2,重庆 400715)
近年来基于食品成分之间相互作用调节食品质地与功能特性的研究成为食品学科的研究热点。多酚与淀粉的相互作用在食品中广泛发生,二者的相互作用对调控加工食品的风味和质地、提高多酚的生物利用度、抑制淀粉的老化以及降低淀粉的消化吸收速度等具有重要作用。综述了多酚与淀粉的复合作用、多酚对淀粉消化酶活性的抑制以及多酚对肠道葡萄糖吸收转运的抑制作用,为利用食物成分与淀粉的相互作用开发预防和控制高血糖症的新型食品提供了参考。
膳食多酚 淀粉 消化吸收 葡萄糖转运 淀粉酶
淀粉是人类的主要能源物质,其消化吸收速度与人体健康密切相关。降低或抑制淀粉的消化吸收速度,使其转化为慢消化淀粉或抗性淀粉,可生产出低血糖指数的食品[1]。此类食品能有效用于Ⅱ型糖尿病人餐后血糖的控制。天然来源的淀粉消化吸收速度主要取决于三方面的因素:一是淀粉颗粒的结构与组成[2-3];二是食品加工的工艺与条件[4];三是膳食中其他成分的影响[5]。前2个方面已有大量的研究与综述,不再赘述。近年来,食物成分间的相互作用对淀粉消化吸收速度的影响得到极大关注。研究表明膳食中与淀粉共存的亲水性胶体、膳食纤维、脂质、多酚等对淀粉的消化吸收速度有明显的影响。
作为重要的植物次生代谢产物,多酚大量存在于许多植物性食物中,如茶、咖啡、红酒、蔬菜和水果等。膳食多酚种类繁多,结构多样。Ovaskainen等[6]的研究表明人通过饮食每天大约能摄取到1 g多酚。膳食多酚对动脉粥样硬化、肥胖、高血压、高血脂、II型糖尿病、癌症等慢性代谢性疾病的预防和控制有积极作用,其发挥调节血糖的机制之一是抑制淀粉的消化吸收速度[7-10]。在总结近10年文献的基础上,论述了膳食多酚对淀粉消化吸收的影响及其机制,以推进利用膳食成分间的相互作用改善食物营养特性的研究,为开发预防和控制高血糖症的新型食品提供参考。
1 多酚与淀粉的复合作用及其对淀粉消化吸收的影响
多酚与生物大分子的相互作用一直是生物学、营养学和食品科学研究的重点内容。其中,多酚与蛋白质的相互作用研究最为普遍和深入。相比之下,多酚与多糖的相互作用研究显得很不完善,但近年来这已成为研究热点。研究表明,多酚与多糖之间主要通过氢键、范德华力、疏水相互作用等分子间作用力以吸附、包埋、微胶囊等多种形式形成复合物[11]。这种复合作用对多糖或多酚的影响是相互的。一方面通过与多糖复合,多酚的稳定性得到了提升,同时其生物利用率、抗氧化性等均与其游离时有明显差异;另一方面与多酚的复合使多糖的流变学、消化特性等发生明显改变。就淀粉而言,其与多酚可按以下2种方式结合:一方面,多酚通过疏水相互作用占据淀粉分子双螺旋结构的内腔形成复合物[12-13]。另一方面,多酚富含羰基和羟基,可与淀粉分子的羟基通过氢键和范德华力诱导淀粉分子聚集[13-14]。与多酚复合的淀粉,糊化时淀粉分子链之间的相互作用被减弱,淀粉的特性发生以下变化[15-19]:1)淀粉的糊化特性受到影响,淀粉崩解值和最大黏度显著提高,最大黏度时间缩短、最终黏度和热糊黏度降低,这可能是由于多酚物质中的羟基和羧基基团影响了淀粉争夺水分的能力以及酚酸等物质降低了淀粉水溶液的pH。2)淀粉凝胶的组织学特性发生改变,凝胶硬度降低,这可能是由于淀粉与多酚物质的相互作用改变了胶体系连续相的特性。3)淀粉的回生率降低,多酚与淀粉相互作用形成的氢键妨碍淀粉分子的重新排列,阻挡淀粉的回生。4)淀粉的流变学特性发生改变,流变指数降低,屈服应力和稠度系数增加。淀粉与多酚复合导致的淀粉颗粒增大,热稳定性提高和糊化特性改变使得淀粉对消化酶的抵抗性得到提高,形成抗性淀粉。不同淀粉与多酚的复合能力存在差异,直链淀粉因其双螺旋结构更长,与多酚的复合能力较支链淀粉更强。淀粉分子的聚合度对多酚与淀粉复合物的稳定性有影响,聚合度越大,复合物的稳定性越低[11]。不同多酚与淀粉的复合能力也存在差异,Zhu等[16]的研究发现4种羟基苯甲酸对淀粉最大黏度增加的程度各不相同。
研究表明,多酚与淀粉的相互作用可显著降低淀粉的消化吸收速度。Deshpande等[20]很早就发现豆类淀粉和马铃薯淀粉对单宁和儿茶素有复合作用,这种复合作用使淀粉的消化受到抑制。最近,这个方面的研究已受重点关注(表1)。Shen等[12]研究发现,柑橘黄酮通过占据淀粉双螺旋结构的疏水性内腔与淀粉形成复合物,柑橘黄酮与直链淀粉的复合作用比与支链淀粉强。这种复合作用显著地降低了淀粉的消化速率,但降低幅度因黄酮种类而异。Zhang等[19]通过红外分析、X射线衍射、热重量分析和量热分析确认了槲皮素和淀粉之间能形成复合物。复合作用导致原淀粉结晶结构消失并形成了新的结晶结构,使得抗性淀粉含量显著增加,复合物的消化程度大幅度降低(从37.3%到10.1%)。Chai等[23]研究发现茶多酚通过氢键相互作用与高直链玉米淀粉形成复合物,导致淀粉结晶结构发生改变,淀粉颗粒变大;与茶多酚复合的高直链玉米淀粉具备慢消化特性,只能引起温和的血糖反应。前期研究发现,多酚能与具有淀粉类似结构的燕麦β-葡聚糖形成复合物[21-22],并且这种复合作用有明确的结构-效应关系[24]。可惜的是目前有关多酚与淀粉复合作用的结构-效应关系鲜见报道,多酚-淀粉复合物的存在形式与复合物消化特性的关系还不清楚。
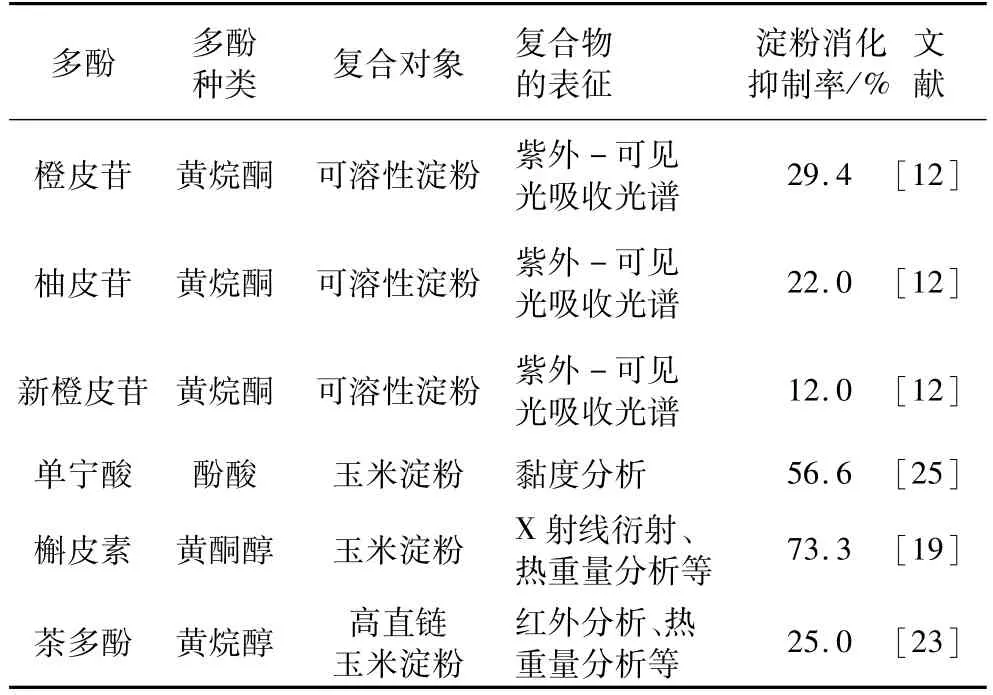
表1 多酚与淀粉的复合作用
2 多酚对淀粉消化酶的抑制作用
消化是淀粉被人体吸收的前提。与淀粉消化密切相关的酶是α-淀粉酶和α-葡萄糖苷酶。首先α-淀粉酶将淀粉水解为麦芽糊精、麦芽糖和少量的葡萄糖[26],接着α-葡萄糖苷酶将麦芽糊精和麦芽糖水解为葡萄糖[27-28]。淀粉消化酶对淀粉的水解速率决定了可吸收糖的生成速度,进而对食物的血糖生成速度具有决定性作用。通过抑制肠道淀粉消化酶的活性就可降低食物的血糖生成速度。口服降糖药阿卡波糖就是通过抑制小肠上皮刷状缘葡萄糖淀粉酶、蔗糖酶及胰腺α-淀粉酶来实现降血糖的[29]。有研究表明某些多酚具有与阿卡波糖类似的效果,可有效抑制α-淀粉酶和α-葡萄糖苷酶的活性[30-32]。
就多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用来看,属于非竞争性抑制作用,这种抑制作用主要是通过多酚与酶分子形成复合物而实现的。不同多酚与酶分子之间的作用力不尽相同,这些作用力主要包括多酚配体中的羟基与酶活性中心极性氨基酸残基之间的氢键和范德华力,以及多酚的疏水性酰基与酶活性中心疏水性氨基酸残基之间的疏水相互作用,还有处于同一平面的多酚环型结构与酶活性位点形成的共轭π键[33-34]。所有这些相互作用都促进了多酚与酶分子的结合,影响了酶活性中心的构象,从而抑制了酶的催化活性,进一步降低了淀粉的水解速率,影响了淀粉的消化吸收。必须指出,多酚结构对多酚与淀粉消化酶之间的结合作用有显著影响,并最终影响了对酶的抑制强度。多酚抑制淀粉消化酶的结构 -效应关系如下[35-38]:1)类黄酮A环和B环的羟基化能提高其对酶的抑制效果,尤其羟基化发生在B环的C-3’和C-4’位置效果更明显。对黄酮和异黄酮而言,A环C-5和C-7位置的羟基化也能提升其抑制淀粉消化酶的活性;2)C2=C3双键的氢化作用和羟基的糖基化能使类黄酮对淀粉消化酶的抑制作用减弱;3)类黄酮的甲基化和甲氧基化明显减弱其对α-淀粉酶的抑制活性;4)C2=C3双键和4-羰基的共轭作用加强了类黄酮抑制淀粉消化酶的作用;5)处于糖苷形式的花青素比游离花青素对淀粉消化酶的抑制作用更强。
表2列出了不同种类多酚对α-淀粉酶和α-葡萄糖苷酶的抑制效果。Elean等[33]研究了19种类黄酮对α-淀粉酶活性的影响,并通过计算机模拟分子对接探索了结构-效应关系,发现多酚是通过氢键和共轭π键与α-淀粉酶结合而影响酶的活性。Miao等[39]的研究还发现茶黄素分子中的羟基和没食子酸酰基能与α-淀粉酶活性中心氨基酸残基以氢键和共轭π键相互作用,进而影响酶的催化活性。不同结构茶黄素对α-淀粉酶活性抑制的强弱顺序为:茶黄素-3,3′-二-O-没食子酸酯>茶黄素-3′-O-没食子酸酯>茶黄素-3-O-没食子酸酯>茶黄素。Sarinya等[29,40]探索了花青素及其不同苷体对α-淀粉酶和α-葡萄糖苷酶的抑制作用,发现具有葡萄糖苷和半乳糖苷的花青素比没有糖苷的抑制作用强;另外发现花青素和阿卡波糖有良好的协同作用,且花青素的加入降低了阿卡波糖的副作用。

表2 多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用
3 多酚对肠道葡萄糖转运吸收的抑制作用
除淀粉在肠道中转化为葡萄糖的速率外,将葡萄糖从肠道吸收进入血液的速率也对食物的血糖指数有明显影响。葡萄糖被肠道细胞吸收进入血液的过程必须借助于跨膜小肠葡萄糖转运蛋白,主要包括SGLT1和GLUT2。图1描述了葡萄糖在肠道中转运吸收的过程。SGLT1是典型的Na+/葡萄糖协同运输者,主要在小肠黏膜的刷状缘表达。SGLT1转运葡糖糖的机制是[43-44]:SGLT1与两分子 Na+的结合改变了其构型,从而可以和一分子葡萄糖结合形成复合物(葡萄糖摄取),顺Na+浓度梯度进入肠上皮细胞,然后SGLT1释放葡萄糖还原为原始状态(葡萄糖转运)。GLUT2是被动载体,分布在肠基底膜。它通过易化扩散把葡萄糖从肠上皮细胞转运进入血液循环,但当出现高浓度的葡萄糖时,可以诱导其几分钟内快速出现在空肠顶模与SGLT1共同完成葡萄糖的转运和吸收[45-46]。通过控制转运蛋白对葡萄糖的转运吸收可以有效达到控制血糖的目的。
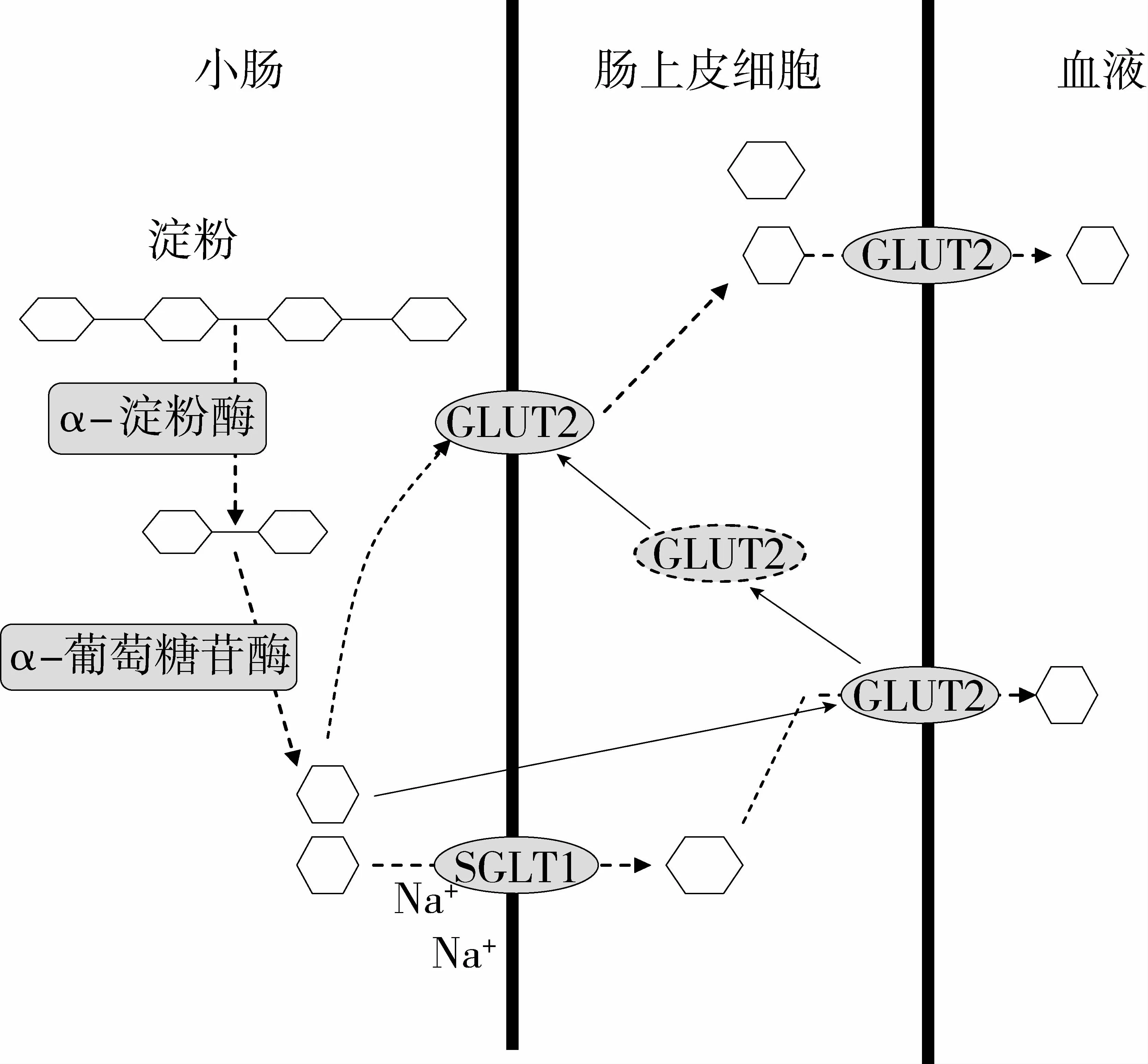
图1 小肠内葡萄糖的转运吸收
研究发现,多酚对葡萄糖的转运吸收具有抑制效果,且不同多酚对葡萄糖转运吸收呈现不同的抑制机理[47-50]:1)处于糖苷形式的多酚通过其苷配基抑制葡萄糖的摄取,而通过其配糖体抑制葡萄糖的转运;2)非糖基化的多酚通过空间位阻抑制葡萄糖转运,即多酚与小肠细胞膜结合,随后破坏磷脂双分子层,达到抑制葡萄糖转运的作用;3)多酚通过疏水相互作用与转运蛋白结合从而影响其葡萄糖转运活性。通过这些作用,淀粉消化形成的葡萄糖在肠道中的转运吸收受到阻碍。同时,众多研究都发现多酚对葡萄糖的转运抑制具有很强的Na+依赖性,即多酚主要是通过抑制SGLT1活性而实现其抑制葡萄糖吸收的效果。在无Na+的环境下,只有在3-、4-和5-位同时具有羟基的多酚才具有显著抑制葡萄糖转运的效果。关于酚类物质对转运体的抑制类型,有些研究认为为非竞争性抑制型,有些则认为是竞争性抑制型,没有统一的结论,有待继续研究。
表3列出了常见多酚对葡萄糖转运体的抑制效果。Cermak等[51]研究了槲皮素 -3-葡萄糖苷与SGLT1的相互作用,发现槲皮素-3-葡萄糖苷能抑制SGLT1摄取D-葡萄糖进入肠刷状上皮细胞,且这种抑制作用呈现剂量效应关系。Oran等[52]发现黄酮类物质对GLUT2转运葡萄糖的活性有抑制效果,但对SGLT1和GLUT5的葡萄糖转运活性无影响。Li等[50]研究发现柑柚皮素的配糖体对葡萄糖转运没有抑制效果,而柚苷配基则效果明显,且这种抑制作用的模式为竞争性抑制。

表3 多酚对葡萄糖转运体的抑制效果
4 结论与展望
膳食多酚在控制淀粉消化吸收方面存在着巨大潜力,目前的研究主要集中在多酚对淀粉消化酶及葡萄糖转运的影响,对多酚-淀粉复合作用的研究有待加强:1)多酚与淀粉复合物形成过程中分子间相互作用力及其对复合物形成的贡献不清楚。2)多酚与淀粉复合作用研究的手段有限,基于诸如13C固体核磁共振等技术的研究需要加强。3)有关二者的结构对多酚-淀粉复合作用的研究鲜见。4)基于真实食品体系的多酚-淀粉复合作用的研究基本空白。
[1]Han X,Ao Z,Srinivas J,etal.Developmentof a low glycemic maize starch:preparation and characterization[J].Biomacromolecules,2006,7(4):1162-1168
[2]Mahasukhonthachat K,Sopade P A,Gidley M J.Kinetics of starch digestion in sorghum as affected by particle size[J].Journal of Food Engineering,2010,96(1):18-28
[3]Mustapha B,Karen A K M,Brucer R H.Rice amylopectin fine structure variability affects starch digestion properties[J].Journal of Agricultural and Food Chemistry,2007,55(4):1475-1479
[4]Mahasukhonthachat K,Sopade P A,Gidley M J.Kinetics of starch digestion and functional properties of twin-screw extruded sorghum[J].Journal of Cereal Science,2010,51(3):392-401
[5]Anthony C D,Guilhem P,Robert G G,et al.Digestion of starch:in vivo and in vitro kinetic models used to characterize oligosaccharide or glucose release[J].Carbohydrate Polymers,2010,80(3):599-617
[6]Ovaskainen M L,Torronen R,Koponen JM,et al.Dietary intake and major food sources of polyphenols in Finnish adults[J].The Journal of Nutrition,2008,138(3):562-566
[7]Scalbert A,Manach C,Morand C,et al.Dietary polyphenols and the prevention of diseases[J].Critical Reviews in Food Science and Nutrition,2005,45(4):287-306
[8]Crozier A,Jaganath I B,Clifford M N.Dietary phenolics:chemistry,bioavailability and effects on health[J].Natural Product Reports,2009,26(8):1001-1043
[9]Clifford M N.Diet-derived phenols in plasma and tissues and their implications for health[J].Planta Medica,2004,70(12):1103-1114
[10]Hendrich S.Battling obesity with resistant starch[J].Food Technology,2010,64(3):22-30
[11]Bourvellec L C,Renard C M G C.Interactions between polyphenols and macromolecules:quantification methods and mechanisms[J].Critical Reviews in Food Science and Nutrition,2012,52(3):213-248
[12]Shen W,Xu Y,Lu Y.Inhibitory effects of citrus flavonoids on starch digestion and antihyperglycemic effects in HepG2 cells[J].Journal of Agricultural and Food Chemistry,2012,60(38):9609-9619
[13]Wu Y,Lin Q,Chen Z,et al.The interaction between tea polyphenols and rice starch during gelatinization[J].Food Science and Technology International,2011,17(6):569-577
[14]Guzar I.Effect of starch-polyphenol interactions on starch hydrolysis[D].Canada:Guelph University,2012:11-13
[15]Zhu F,Cai Y,Sun M,et al.Effect of phytochemical extracts on the pasting,thermal,and gelling properties of wheat starch[J].Food Chemistry,2009,112(4):919-923
[16]Zhu Fang,Cai Yizhong,Sun Mei,et al.Effect of phenolic compounds on the pasting and textural properties of wheat starch[J].Starch-Starke,2008,60(11):609-616
[17]Wu Y,Chen Z,Li X,et al.Effect of tea polyphenols on the retrogradation of rice starch[J].Food Research International,2009,42(2):221-225
[18]Zhu F,Wang Y J.Rheological and thermal properties of rice starch and rutin mixtures[J].Food Research International,2012,49(2):757-762
[19]Zhang L,Yang X,Li S,et al.Preparation,physicochemical characterization and in vitro digestibility on solid complex ofmaize starches with quercetin[J].LWT-Food Science and Technology,2011,44(3):787-792
[20]Deshpande SS,Salunkhe D K.Interactions of tannic acid and catechin with legume starches[J].Journal of Food Science,1982,47(6):2080-2081
[21]Gao Ruiping,Liu Hui,Peng Zhen,et al.Adsorption ofβ-epigallocatechin-3-gallate(EGCG)onto oatβ-glucan[J].Food Chemistry,2012,132(4):1936-1943
[22]Wu Z,Hong L,Ming J,etal.Optimization ofadsorption of tea polyphenols into oatβ-glucan using response surface methodology[J].Journal of Agricultural and Food Chemistry,2011,59(1):378-385
[23]Chai Y,Wang M,Zhang G.Interaction between amylose and tea polyphenolsmodulates the postprandial glycemic response to high-amylosemaize starch[J].Journal of Agricultural and Food Chemistry,2013,61(36):8608-8615
[24]Wang Y,Liu J,Chen F,et al.Effects ofmolecular structure of polyphenols on their noncovalent interactionswith oat β-glucan[J].Journalof Agriculturaland Food Chemistry,2013,61(19):4533-4538
[25]Dilek L A,Nancy D T,Cassandra M M,et al.Effects of sorghum[Sorghum bicolor(L.)Moench]crude extracts on starch digestibility,estimated glycemic index(EGI),and resistant starch(RS)contents of porridges[J].Molecules,2012,17(9):11124-11138
[26]Megh R B,Nilubon JA,Hong Gao,etal.α-Glucosidase andα-amylase inhibitory activities of Nepalese medicinal herb Pakhanbhed(Bergenia ciliata,Haw.)[J].Food Chemistry,2008,106(1):247-252
[27]Roberto Q C,Claudia CR T,Antone R O,etal.Contribution of mucosal maltase-glucoamylase activities to mouse small intestinal starchα-glucogenesis[J].The Journal of Nutrition,2007,137(7):1725-1733
[28]Roberto Q C,Lyann S,Ao Zihua,et al.Luminal starch substrate"brake"on maltase-glucoamylase activity is located within the glucoamylase subunit[J].The Journal of Nutrition,2008,138(4):685-692
[29]Sarinya A,Piyawan C,Sirintorn Y,etal.Inhibitory activities of cyanidin and its glycosides and synergistic effectwith acarbose against intestinalα-glucosidase and pancreaticα-amylase[J].International Journal ofMolecular Sciences,2010,11(9):3387-3396
[30]Karunrat S,Lzabela K.Composition of native Australian herbs polyphenolic-rich fractions and in vitro inhibitory activities against key enzymes relevant to metabolic syndrome[J].Food Chemistry,2012,134(2):1011-1019
[31]Narita Y,Inouye K.Kinetic analysis andmechanism on the inhibition of chlorogenic acid and its components against porcine pancreasα-amylase isozymes Iand II[J].Journal of Agricultural and Food Chemistry,2009,57(19):9218-9225
[32]Ashley B S,Derek S,Gordon JM.Berry components inhibitα-glucosidase in vitro:synergies between acarbose and polyphenols from black currant and rowanberry[J].Food Chemistry,2012,135(3):929-936
[33]Elean L P,Holger S,Nathalie F,etal.Flavonoids for controlling starch digestion:structural requirements for inhibiting humanα-amylase[J].Journal of Medicinal Chemistry,2008,51(12):3555-3561
[34]Gery W.Possible effects of dietary polyphenols on sugar absorption and digestion[J].Molecular Nutrition&Food Research,2013,57(1):48-57
[35]Xiao J,Kai G,Yamamoto K,et al.Advance in dietary polyphenols asα-glucosidases inhibitors:a review on structure-activity relationship aspect[J].Critical Reviews in Food Science and Nutrition,2013,53(5):818-836
[36]Xiao J,NiX,KaiG,etal.A review on structure-activity relationship of dietary polyphenols inhibitingα-amylase[J].Critical Reviews in Food Science and Nutrition,2013,53(5):497-506
[37]Tadera K,MinamiIY,Takamatsu K,et al.Inhibition ofαglucosidase andα-amylase by flavonoids[J].Journal of Nutritional Science and Vitaminology,2006,52(2):149-153
[38]Cao Hui,Chen Xiaoqing.Structures required of flavonoids for inhibiting digestive enzymes[J].Anti-Cancer Agents in Medicinal Chemistry,2012,12(8):929-939
[39]Miao Ming,Jiang Huan,Jiang Bo,et al.Elucidation of structural difference in theaflavins for modulation of starch digestion[J].Journal of Functional Foods,2013,5(4):2024-2029
[40]Sarinya A,Sirintorn Y A,Sum ritW,et al.In vitro inhibi-tory effects of cyanidin-3-rutinoside on pancreaticαamylase and its combined effect with acarbose[J].Molecules,2011,16(3):2075-2083
[41]Li Y,Zhou F,Gao F,et al.Comparative evaluation of quercetin,isoquercetin and rutin as inhibitors ofα-glucosidase[J].Journal of Agricultural and Food Chemistry,2009,57(24):11463-11468
[42]Toshiro M,Takashi T,Satomi T,etal.α-Glucosidase inhibitory profile of catechins and theaflavins[J].Journal of Agricultural and Food Chemistry,2007,55(1):99-105
[43]Drozdowski L A,Thomson A B R.Intestinal sugar transport[J].World Journal of Gastroenterology,2006,12(11):1657-1670
[44]Scheepers A,Joost H G,Schurmann A.The glucose transporter families SGLT and GLUT:molecular basis of normal and aberrant function[J].Journal of Parenteral and Enteral Nutrition,2004,28(5):364-371
[45]Xu Y,Rubin B R,Orme C M,et al.Dualmode of insulin action controls GLUT4 vesicle exocytosis[J].The Journal of Cell Biology,2011,193(4):643-653
[46]Wright E M,Hirayama B A,Loo D F.Active sugar transport in health and disease[J].Journal of Internal Medicine,2007,261(1):32-43
[47]Johnston K,Sharp P,Clifford M,et al.Dietary polyphenols decrease glucose uptake by human intestinal Caco-2 cells[J].FEBS Letters,2005,579(7):1653-1657
[48]Manzano S,Williamson G.Polyphenols and phenolic acids from strawberry and apple decrease glucose uptake and transport by human intestinal Caco-2 cells[J].Molecular Nutrition&Food Research,2010,54(12):1773-1780
[49]Sheikh JH,Hiroko K,Hitoshi A,et al.Polyphenol-induced inhibition of the response of Na+/glucose cotransporter expressed in xenopus oocytes[J].Journal of Agricultural and Food Chemistry,2002,50(18):5215-5219
[50]Li J,Che C,Clara B SL,etal.Inhibition of intestinal and renal Na+-glucose cotransporter by naringenin[J].The International Journal of Biochemistry&Cell Biology,2006,38(56):985-995
[51]Cermak R,Landgraf S,Wolffram S.Quercetin glucosides inhibit glucose uptake into brush-border membrane vesicles of porcine jejunum[J].British Journal of Nutrition,2004,91(6):849-855
[52]Oran K,Peter E,Chen S,et al.Inhibition of the intestinal glucose transporter GLUT2 by flavonoids[J].The Journal of the Federation of American Societies for Experimental Biology,2007,21(2):366-377.
The Digestion and Absorption of Starch Affected by Dietary Polyphenols
LüXia1Ye Fayin1Liu Jia1Zhao Guohua1,2
(College of Food Science,Southwest University1,Chongqing 400715)
(Center of Food Engineering and Technology Research of Chongqing2,Chongqing 400715)
In recent years,the study on regulating the texture and functional properties of foods by their components interactions has become a research hotspot in food science.Interactions between polyphenols and starches occur widely in foods.The Interactions have a large importance for regulating the flavor and texture of foods,improving the bioavailability of polyphenols,inhibiting the starch retrogradation and reducing the rate of digestion and absorption of starch.By the extensive review of available references,the complexation of starch with polyphenols,the inhibition effects of polyphenols on the activity of starch digestive enzymes and the transportation of glucose across intestinal epithelial cell have been researched in the paper.The study results have offered helpful information in developing novel functional foods to prevent and controlling postprandial hyperglycemia.
dietary polyphenol,starch,digestion and absorption,glucose transport,amylase
TS236.5
A
1003-0174(2015)06-0134-06
国家自然科学基金(31371737),863计划(2011AA100 805-2)
2014-01-22
吕霞,女,1990年出生,硕士,食品科学
赵国华,男,1971年出生,教授,食品化学与营养学

