添加不同分子量乳清肽对快速成熟干酪的影响
曹岩,张丽萍,2
(1.黑龙江八一农垦大学,黑龙江大庆163319;2.国家杂粮工程技术研究中心,黑龙江大庆163319)
0 引言
切达干酪成熟期一般为6~12个月,过程缓慢,成本高,促进干酪快速成熟降低成本成为现代干酪研究的主要趋势。近年来,许多学者研究了不同促进干酪快速成熟的方法,但关于添加乳清肽对干酪快速成熟的影响研究很少。曲杜鹃[1]等人研究表明乳清肽能很好的促进乳酸菌的生长。添加6%的乳清肽,可以减少50%的发酵剂使用量。赵谋明[2]等人研究表明乳清肽的添加可以很好的缩短酸乳的发酵时间。韦慧娟[3]等人研究了乳清肽对干酪乳杆菌生长的促进作用,其中超滤部分分子量3 000 u的乳清肽促进干酪乳杆菌生长作用最强。赵新淮[4]、潘思轶[5]等报道了大豆蛋白水解物能够促进乳酸菌的增殖及发酵乳的产酸。
本实验根据前人研究的乳清肽能够促进发酵的研究基础,拟研究不同分子量乳清肽对干酪快速成熟的影响,考察干酪成熟期间的pH值、可溶性氮质量分数、游离脂肪酸以及质构特性的变化,探讨不同分子量的乳清蛋白水解物对干酪快速成熟的影响,为促进干酪快速成熟的研究提供方法依据。
1 实验
1.1 材料
乳清蛋白粉(蛋白质量分数80%),凝乳酶(酶活力30 000 U/g),胰蛋白酶Flavourzyme(酶活500 LAPU/g),脂肪酶 Palatase(酶活 20 000LU/g),发酵剂为R-704,牛乳。
1.2 仪器与设备
干酪槽,干酪刀;牛乳成分分析仪(LACTOSCAN SA型),质构仪(TMS-PRO型),酸度计(pHS-2型),凯氏定氮仪(SKD-800型),WI17496荧光分光光度仪,Neofuge 13台式离心机。
1.3 方法
1.3.1 不同分子量乳清蛋白水解液的制备
配置乳清蛋白溶液,按照水解条件为:[E/S]=1%,pH=8.5,温度45 ℃,时间2.5 h,水解度14.97%,对乳清蛋白溶液进行水解,得到乳清蛋白水解液。以乳清蛋白水解液为原料,用截留分子量为10 000,5 000,3 000,1 000 u超滤膜进行逐级分离[6]。
1.3.2 理化特性分析
(1)干酪成熟期间pH测定。取10 g磨碎的待测干酪样品和l0 mL的蒸馏水在小烧杯中混合,用pH计测定干酪的pH值。
(2)pH4.6可溶性氮的测定。准确称取0.75 g干酪,加入25 mL(pH值这4.6)的醋酸盐缓冲溶液,将干酪充分研磨后,用25 mL缓冲溶液充分冲洗,悬浮液在4 000 r/min的离心机中离心20 min,取上层清液定量移入凯氏消化瓶,进行微量凯氏定氮,以最终占干酪总氮量百分比表示[7]。
(3)12%TCA可溶性氮的测定。准确称取1.5 g干酪,加入25 mL质量分数为12%的TCA溶液,将干酪充分研磨,用20 mL的缓冲液充分冲洗,将悬浮液放在4 000 r/min的离心机中离心20 min,取上清液定量移入凯氏消化瓶,进行微量凯氏定氮,以占干酪总氮量的百分比表示[8]。
(4)游离氨基酸的测定。取2 g干酪样品,加入4 mL浓度为0.75 mol/L的TCA溶液,混匀,4 000 r/min离心5 min,取上清液备用。取100 μL蒸馏水,加入200 μL浓度为0.75 mol/L的TCA溶液后,再加入6 mL的OPA试剂后混匀作为空白样。取100 μL样品(上清液),加入2 mL OPA试剂,混匀后于340 nm波长下检测吸光值(在反应达到最大吸光值时记录,一般为4~7 min)[9]。
1.3.3 质构特性分析
采用质地剖面分析(TPA)的方法对干酪的质地特性进行测定分析。采用特制取样器将干酪样品切割为直径1.5 cm,高1 cm的圆柱形样品供TPA测试用。所有样品取样后至测试前均统一放置于0~4℃冰箱中,以防止温度对产品质地产生影响。采用质构仪,以TPA二次下压法测定[10]。
2 结果与分析
2.1 理化特性测定结果
2.1.1 添加不同分子量乳清肽干酪pH值的变化
在0~35 d成熟期内,添加不同分子量乳清肽的干酪和未添加肽的正常成熟干酪pH值的变化测试结果如图1所示。
由图1可以看出,在35 d成熟期内,未添加乳清肽的干酪pH值呈缓慢降低的趋势;在0~21 d内添加乳清肽的干酪pH值下降速度较快,并且差异显著(p<0.05),在21~35 d内,添加分子量小于3 ku的干酪pH值缓慢增加(P>0.05),添加其他分子量的干酪pH值仍保持缓慢下降。成熟期在35 d时,添加分子量小于3 ku乳清肽的干酪pH值为5.35,高于添加其他分子量的干酪。
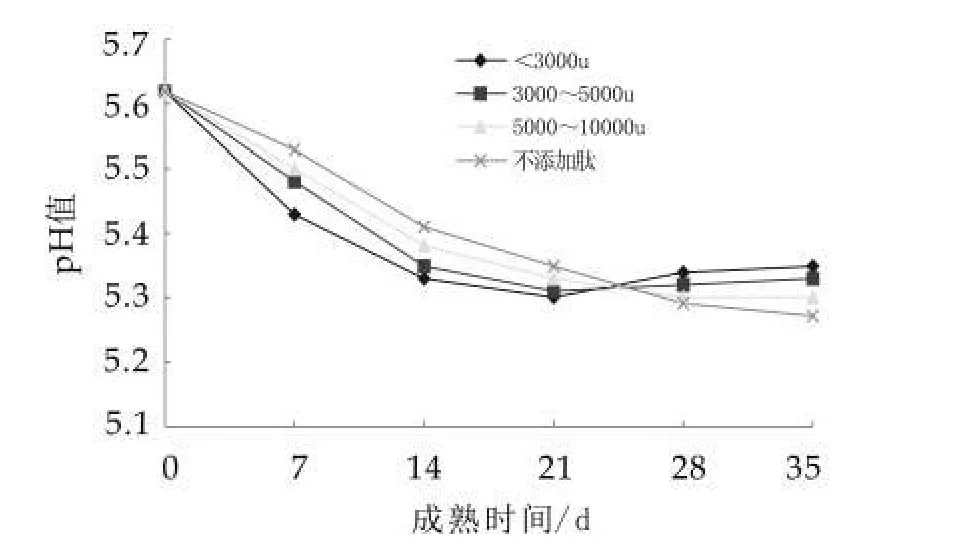
图1 pH值随成熟时间变化
2.1.2 添加不同分子量乳清肽干酪可溶性氮的变化
在0~35 d成熟期内,添加不同分子量乳清肽干酪和未添加肽的正常成熟干酪可溶性氮的变化测试结果如图2所示。
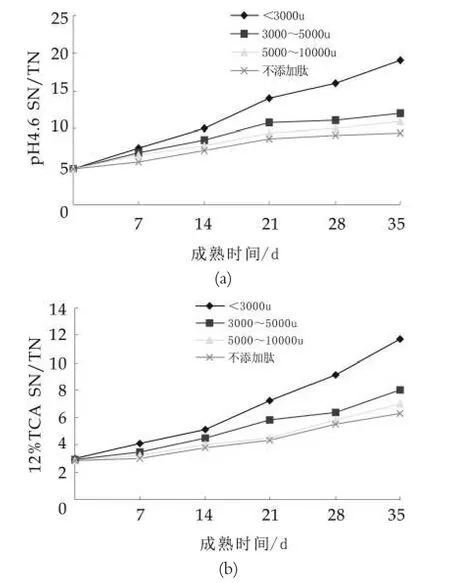
图2 pH4.6N/TN和质量分数12%的TCASN/TN变化
由图2可以看出,添加乳清肽干酪与未添加乳清肽干酪的SN/TN之间有显著差异(P<0.05),尤其以添加3 ku以下乳清肽的干酪最显著,pH值为4.6SN/TN和质量分数12%TCA SN/TN在成熟0~35 d内,由4.8%和3.02%增长到了19.32%和11.7%,并且差异显著(P<0.05),添加3 ku较未添加乳清肽pH为4.6SN/TN和质量分数12%的TCA SN/TN增加了9.5%和5.4%,并且差异显著(P<0.05)。
2.1.3 添加不同分子量乳清肽干酪FAA的变化
在0~35 d成熟期内,添加不同分子量乳清肽干酪和未添加肽的正常成熟干酪FAA的变化测试结果如图3所示。
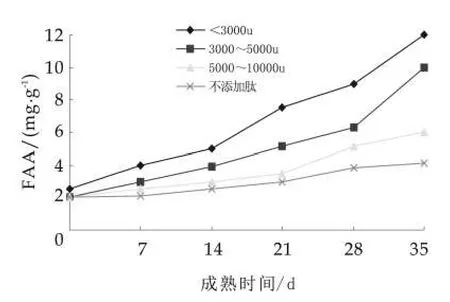
图3 FAA质量分数的变化
由图3可以看出,随着成熟时间的延长,FAA质量分数呈明显增加趋势(P<0.05),在成熟35 d时,添加乳清肽的干酪FAA质量分数明显高于未添加肽的干酪,其中添加分子量小于3 ku的干酪FAA质量分数最高为11.97%,未添加肽的干酪FAA质量分数为4.1%。
2.2 质构特性测定结果
在0~35 d成熟期内,添加不同分子量乳清肽干酪和未添加肽的干酪TPA的变化测试结果如图4所示。

图4 硬度、弹性、黏聚性随成熟时间的变化
由图4(a)可以看出,成熟21 d时,添加乳清肽干酪与未添加乳清肽干酪的硬度分别呈下降的趋势,差异显著(P<0.05);图4(b)可以看出,成熟21 d时,添加乳清肽干酪与未添加乳清肽干酪的弹性均有小幅度上升,随着成熟时间的延长,弹性又呈下降趋势,差异显著(P<0.05);图4(c)可以看出添加乳清肽干酪与未添加乳清肽干酪的凝聚性,在成熟21 d时分别呈下降趋势。
3 讨论
由于在成熟前期干酪残留乳清中的乳糖在微生物的作用下转化为乳酸和脂肪代谢等,干酪产生了大量的H+使得干酪pH值下降,乳清肽促进了乳酸和脂肪代谢[11]。成熟后期乳糖慢慢消耗,由于乳清肽促进菌种生长以及酶的作用,使蛋白质水解产生NH4+增多,导致pH值上升。
添加乳清肽干酪的蛋白水解速度加快。干酪在成熟过程中由于乳酸菌的持续作用使pH值为4.6 SN和质量分数为12%的TCA SN/TN基本呈平滑上升趋势。4组干酪的成熟速度不同,其中添加分子量小于3 ku的干酪成熟速度最快。
FAA质量分数的增加也进一步说明干酪快速成熟干酪在成熟过程中酪蛋白发生水解,这主要由于乳清肽促进乳酸菌生长,而乳酸菌产生的蛋白酶使β-酪蛋白发生降解,并在乳酸菌的蛋白体系下将大肽进一步的分解成小肽和氨基酸所造成的[12]。
由于干酪快速成熟过程中蛋白质和脂肪发生大量水节,产生了大量水溶性物质,酪蛋白原来的网络结构被破坏,干酪的体系变得松散[13],成熟过程中pH值的降低也会使干酪体系发生变化,从而使干酪硬度随之下降,其他各TPA指标都与硬度有相似的变化规律,其弹性和凝聚性在成熟前21 d时均会有不同程度下降。
4 结论
添加乳清肽的干酪在成熟过程中,成熟前期pH呈先下降后上升的变化趋势;在成熟过程中由于乳酸菌产生的蛋白酶的作用使蛋白发生水解[14],pH4.6 SN、质量分数12%TCA SN和FAA质量分数与未添加乳清肽干酪相比较都呈显著增加(P<0.05),添加不同分子量乳清肽干酪成熟35 d时,蛋白分解率分别为 19.32%(<3ku)、12.1%(3~5 ku)、11.09%(5~10 ku),比未添加乳清肽干酪分别增加了9.82%、2.6%、1.59%,(P<0.05);TPA各项指标均有不同程度的下降,添加乳清肽干酪与未添加乳清肽干酪TPA差异显著(P<0.05),由上结论可知,乳清肽的添加加速了干酪的成熟,其中以添加分子量为3 000 u以下的乳清肽效果最佳。
[1]曲杜娟,赵强忠,赵谋明.乳清蛋白中性蛋白酶酶解物对酸奶发酵的促进作用及其对酸奶品质的影响研究[J].食品科技,2009,10:59-63.
[2]赵谋明,卢延辉,林伟锋,等.乳清蛋白对脱脂发酵乳的流变特性及贮存稳定性的影响[J].中国乳品工业,2006,02:4-6.
[3]韦慧娟,陈树兴,李丽丽,等.乳清蛋白水解物对乳酸菌生长影响的研究综述[J].农产品加工(学刊),2013,13:43-45.
[4]赵新淮,关瑞,孙慧光,等.大豆蛋白水解物的乳酸发酵促进作用[J].东北农业大学学报,1998,01:102-104.
[5]潘思轶,陈丽,王可兴.酶解大豆蛋白对酸奶发酵酸度及流变特性的影响研究[J].食品科学,2003,08:35-39.
[6]白凤翎.蛋白水解物促乳酸菌增殖及高密度培养体系研究[D].北京林业大学,2010.
[7]DIANE L,VAN HEKKEN,MIEHAEL H,et al.Rheologieal and proteolytic properties of Monterey Jack Goat′s milk cheese during aging[J],Agrieultural and Food Chemistry,2004,(52):5372-5377.
[8]BERTOLA N C,CALIFANO A N,BEVILAEQUA A E,et al.Textural changes and proteolysis of low-moisture Mozzarella eheese frozen under various conditions[J].Lebensm.-Wiss.u-Technol.,1996,(29):470-474.
[9]KERNNY O,FIT ZGERALD R J,O,CUINN G,et al.Autolysisn of selected Lactobacillus helvelicus adjunct strains during Cheddar cheese ripening[J].International Dairy Journal,2006,(16):797-804.
[10]卢晓明,杨海莺,任发政,等.绿豆和乳清蛋白水解物对双歧杆菌促生长条件的研究[J].食品研究与开发,2010,06:5-9.
[11]刘宏锋,赵谋明,林伟锋.酪蛋白水解物对酸奶的影响研究[A]//广东省食品学会.第三届“益生菌、益生元与健康研讨会”论文集[C].广东省食品学会,2004.
[12]刁静静,孔保华,彭新颜,等.乳清蛋白水解物功能性质的研究[J].食品科技,2010,08:89-93.
[13]张媛媛,张富新.羊奶乳清蛋白水解物的酶解制备[J].广西农业生物科学,2007,03:227-231.
[14]包怡红.乳清多肽及其发酵制品的研究[D].东北农业大学,2001.

