DHA对猪血液单核细胞炎症的影响
苏 欣, 沈 立, 张 宇
(1.白城职业技术学院,吉林白城 137000;2.吉林大学动物医学学院,吉林长春 130062)
二十二碳六烯酸(DHA,22:6n-3)是 Omega-3多不饱和脂肪酸(PUFAs)的一种,哺乳动物自身不能合成,因此,组织和循环系统中的DHA主要来源于饮食摄取。鱼类是提供DHA的主要食品来源,少量α-亚麻酸 (ALA)也可以转化为DHA(Dariush 和 Jason,2011)。 研究表明,DHA 能够影响多种疾病进程,包括糖尿病、动脉粥样硬化、哮喘、高血压、关节炎和非酒精性脂肪肝等(Hemant等,2011),有益于人类健康。
慢性炎症可导致多种疾病的发生,如心血管疾病、代谢疾病、癌症及病毒性疾病。大量研究表明,DHA可以预防炎症诱导型疾病的发生(Howard 和 Dennis,2002;Lisa 和 Zena,2002)。细胞水平试验也证明,DHA抑制促炎转录因子NFκB的活性,抑制促炎因子 IL-6、TNF-α和MCP-1的表达和分泌 (Kumar等,2012;Jia等,2006),从而影响免疫反应;DHA还可以通过抑制NLRP3炎症小体的激活而抑制炎症和代谢紊乱(Yan 和 Jiang,2013)。
猪与人类的基因组大小和组成非常相近,并且猪与人类的器官大小、循环系统和代谢系统极为相似(Lynsey等,2011)。因此,猪不仅可以作为人类的食品,还是研究某些疾病的理想模型。本研究采用荧光定量PCR和Elisa方法观察不同浓度DHA对猪血液单核细胞(PPBMCs)炎症的影响,为深入研究DHA对动物和人类健康的保护作用提供理论依据。
1 材料与方法
1.1 主要试剂 淋巴细胞分层液Histopaque®-1077(Sigma-Aldrich)、LPS、(Sigma-Aldrich)、DHA(Sigma-Aldrich)、Elisa 试剂盒 (武汉博士德)、实时荧光定量试剂 (北京天根)、RPMI1640(Hyclone)、FBS(invitrogen)。
1.2 猪血液单核细胞分离 使用血液抗凝管收集(EDTA-2Na)猪外周血,每次收集 10 mL,按照Histopaque®-1077说明书,进行单核细胞分离,最后用RPMI1640培养液重悬单核细胞,放至培养皿中,37℃、5%CO2培养,备用。
1.3 细胞培养与处理 猪血液单核细胞于含10%FBS的 RPMI1640培养液,37℃、5%CO2培养,次日使用。每次均使用新鲜分离的细胞进行试验。对照组加入DMSO,DHA使用3个浓度(5、10、20 μmol/L),每个浓度为一个处理组,每个处理组3个重复,单独孵育细胞24 h,进行炎症因子检测。LPS使用常规浓度(1 μg/mL),处理 1 h后加入DHA进行共孵育,24 h后进行炎症因子检测。
1.4 CCK-8细胞活力检测 将细胞悬液计数,以104个细胞/孔的密度接种于96孔板中,12 h后加入不同浓度 DHA(5、10、20 μmol/L)进行孵育,每个处理组5个重复,12 h后加入CCK-8溶液,继续孵育4 h,最后使用酶标仪在450 nm处进行测定。
1.5 统计分析 试验数据均使用Prism 5软件进行统计分析,各处理组与对照组之间使用t检验分析,P<0.05为具有显著性差异。
2 结果
2.1 DHA对PPBMCs活力的影响 由图1可见,使用5 μmol/L和10 μmol/L DHA分别处理PPBMCs 12 h和24 h,对细胞活力没有显著影响,但20 μmol/L处理24 h时,细胞活力显著下降。因此选择5 μmol/L和10 μmol/L DHA进行后续试验。

图1 CCK-8检测PPBMCs活力
2.2 DHA对PPBMCs炎症的影响 使用不同浓度 DHA(5 μmol/L 和 10 μmol/L)分别孵育 PPBMCs,在 12 h 和 24 h 分 别 检 测 IL-6、TNF-a 和MCP-1的mRNA水平和分泌浓度。结果显示,DHA呈浓度依赖性抑制PPBMCs中IL-6、TNF-a和 MCP-1的表达和分泌(图 2a、b)。
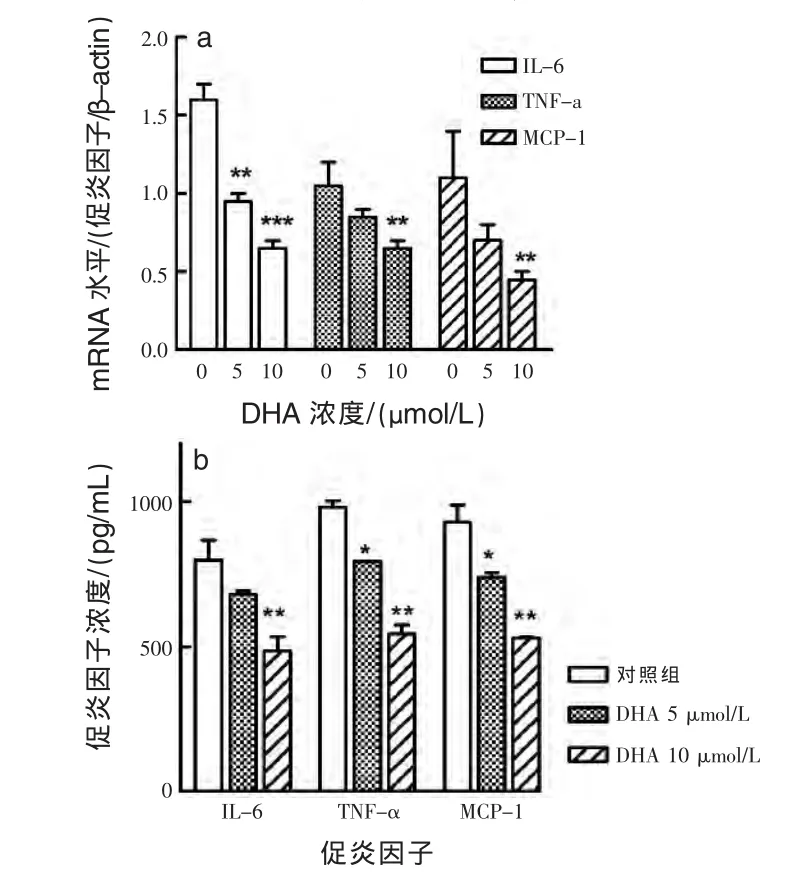
图2 DHA对炎症因子表达和分泌的影响
2.3 DHA对LPS诱导的PPBMCs炎症的影响用1 μg/mL LPS孵育1 h,然后用不同浓度DHA处理 24 h,检测 IL-6、TNF-a和 MCP-1的 mRNA水平和分泌浓度。结果显示,LPS上调PPBMCs炎症水平,而DHA能够抑制LPS诱导的炎症升高(图 3a、b)。
3 讨论
多不饱和脂肪酸是指碳链长度为18~22个碳原子并含有两个或两个以上双键的直链脂肪酸,根据双键的位置不同通常分为ω3和ω6。ω3-PUFAs主要包括DHA、二十碳五烯酸 (EPA)和ALA(Hemant等,2011)。 小鼠体内体外试验结果显示,DHA可以转化为脂蛋白类,存在于脂肪组织,还可作为细胞膜的磷脂成分,而在血液中DHA还能以非酯化的游离脂肪酸形式与白蛋白相结合。大量临床数据显示,DHA保护心血管健康和代谢平衡。DHA的长期摄入伴随着体内炎症和甘油三酯水平降低,因此,研究推测DHA的保护作用主要是通过影响体内炎症反应来实现,并且在人类细胞系和小鼠体内也证实了这一观点。
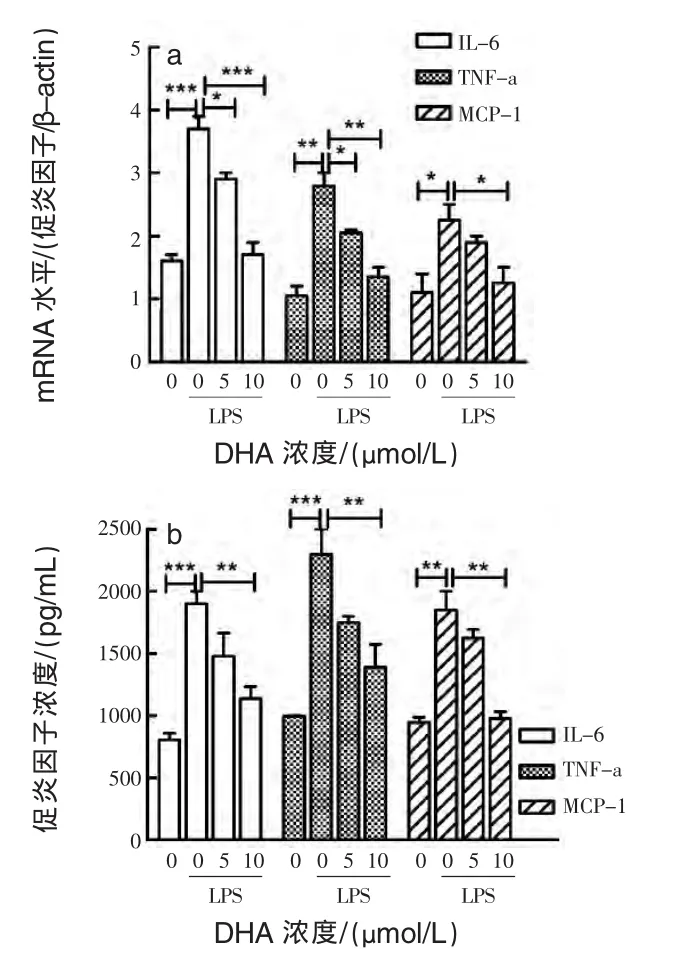
图3 检测DHA对LPS诱导的炎症因子表达和分泌的影响
本研究中,不同浓度DHA对原代猪血液单核细胞基础水平的炎症具有抑制作用,并且能够抑制LPS诱导的炎症反应。因此,本研究为深入研究DHA在猪体内的抗炎作用提供了理论依据。
[1]Carlos Z,Carmen G,Jose L M.Animal Models of Cardiovascular Diseases[J].J Biomed Biotechnol,2011,49:7841.
[2]Dariush M,Jason H,Wu Y.Omega-3 Fatty Acids and Cardiovascular Disease[J].J Am Coll Cardiol,2011,58(20):2047~67.
[3]Hemant P,Panchal S K,Vishal D,et al.Omega-3 fatty acids and metabolic syndrome:Effects and emerging mechanisms of action[J].Progress in Lipid Research,2011,50:372~387.
[4]Howard L W,Dennis J S.Inflammation and therapeutic vaccination in CNS diseases[J].Nature,2002,420:879~884.
[5]Jia Q,Zhou H R,Shi Y H,et al.Docosahexaenoic Acid Consumption Inhibits Deoxynivalenol-Induced CREB/ATF1 Activation and IL-6 Gene Transcription in Mouse Macrophages[J].J Nutr,2006,136:366~372.
[6]Kumar S,Sutherland F,Morton J B,et al.Long-term omega-3 polyunsaturated fatty acid supplementation reduces the recurrence of persistent atrial fibrillation after electrical cardioversion [J].Heart rhythm:the official journal of the Heart Rhythm Society,2012,9:483~491.
[7]Lisa M C,Zena W.Inflammation and cancer[J].Nature,2002,420:860 ~867.
[8]Lynsey F,Ronan K,David P S,et al.The mononuclear phagocyte system of the pig as a model for understanding human innate immunity and disease[J].J.Leukoc.Biol,2011,89:855~871.
[9]Yan Y Q,Jiang W.Omega-3 Fatty Acids Prevent Inflammation and Metabolic Disorder through Inhibition of NLRP3 Inflammasome Activation[J].Immunity,2013,38:1154~1163.

