北黄海冬季沉积物中线虫个体干质量初探
于婷婷 , 徐奎栋
(1.中国科学院 海洋研究所, 山东 青岛 266071; 2.中国科学院大学, 北京 100049)
小型底栖动物是底栖小/微食物网的重要组成部分和环境质量的重要指示生物[1-4]。自由生活海洋线虫是海洋沉积物中丰度最大的后生动物, 也是小型底栖动物群落的永久性成员, 其丰度可高达 2×107个/m2[5],通常占到小型底栖动物总丰度的 70%~90%[6]。因此,对线虫生物量的准确估算是获得小型底栖动物确切生物量的关键。
海洋底栖线虫的生物量通常以单位面积沉积物中的干质量表示(μg/10 cm2)。如果个体干质量的估计出现偏差, 将直接导致生物量估计的不准确。因此,通过实测获得线虫的个体平均干质量具有重要意义。实测干质量的方法有直接称质量和体积换算两种方法。直接称质量可以采用感量为0.1 μg的超微量分析天平, 但该法处理后的样品无法用于后续制片分析, 故大多数学者采用体积换算法, 即通过对线虫体长和体宽的实测来获得个体平均干质量。早在20世纪, 国外对线虫的个体平均干质量已经进行了很多实测[7-9]。但是, 因过筛孔径、生境、季节、测量方法等因素的差异, 不同作者所测得的线虫个体干质量值差距较大(表1)。总体上来看, 当过筛孔径较小时, 获得的干质量值更小, 但二者并无必然的联系。
中国目前仍普遍采用 0.4 μg/个这一经验系数来估算线虫的生物量。通过对南黄海[15]和长江口邻近海域[17-18]沉积物中线虫个体干质量的实测发现, 采用 0.4 μg/个这一经验系数将明显高估该海域线虫的实际生物量。北黄海是中国迄今已报道的线虫及小型底栖动物丰度最高的海域[19-20], 对其生物量的估计均来自 0.4 μg/个经验系数计算的结果, 而这一估测值与实测值之间的差异程度尚不可知。本研究拟通过对北黄海沉积物中线虫个体干质量的实测, 为其生物量的准确估计提供依据, 探讨影响线虫个体干质量的主要因子。
1 材料与方法
1.1 调查海域与站位
2009年 12月, 搭载中国科学院海洋研究所“科学三号”考察船, 对北黄海海域进行了小型底栖动物群落及其相关沉积环境因子的调查研究, 成功获得了如下 4 个站位(图1)的样品: L3(39.4°N, 123°E)、38752(38.8°N, 122.5°E)、 38753(38.7°N, 123°E)和38001(38°N, 122°E)。

表1 不同作者所测线虫个体干质量的比较Tab.1 Comparision of nematode average dry weight measured by different authors

图1 北黄海4个站位取样站位图Fig.1 Map of four sampling stations in the northern Yellow Sea
1.2 样品采集和分析
利用0.1 m2改进型Gray-O′Hara箱式采泥器, 每个站位采集3箱未受扰动的沉积物样品, 用内径23 mm的注射器改造的采样管在每箱沉积物中随机采集一个长度为8 cm的芯样, 并按0~2 cm、2~5 cm、5~8 cm分层。各分层样品分别加入等体积的 10%福尔马林溶液固定, 用于小型底栖动物分析。同时另外采集一组分层样品备用。此外, 以同样方式取另外4个芯样,并按照相应分层合并后, 分别装入封口袋, -20℃ 冷冻保存, 用于沉积物中叶绿素a (Chl-a)、脱镁叶绿素a (Ph-a)、粒度、有机质及含水量的分析。
室内小型底栖动物样品经虎红(Rose Bengal)染色, 用 500 μm 和 31 μm 孔径套筛过滤后, 转入Ludox-HS40硅胶液中悬浮离心, 然后在解剖镜下按类群分选计数[21]。然后进行线虫的透明和封片, 再利用微分干涉相差显微镜(DIC, Nikon E80i)进行观察和测量。针对不同的长度采用不同倍率的物镜进行观察, 用目镜测微尺进行读数。对于一些尾部特别纤长的线虫, 体长仅测量到肛门处左右。体形蜷曲很严重的线虫, 采用描图仪描图后, 用地图测量仪来测量体长和体宽。
采用体积换算法测量线虫的个体平均干质量时,在显微镜下实测线虫的体长(L)和体宽(W), 每条线虫的体积(V)通过公式V=530×L×W2[22]计算得出; 按照密度为 1.13, 干湿比为 1/4[7], 获得每个个体的干质量=530×L×W2×1.13×0.25, 计算得出每个站位的线虫个体干质量平均值。然后, 将经由这一平均值计算得出的线虫生物量, 与利用 0.4 μg/个这一系数估算得出的结果进行比较。小型底栖动物其他类群的个体干质量采用以下参数: 桡足类以 1.86 μg[8]计算; 其他类群的平均个体干质量依据 Widbom[9]给出的参数, 即多毛类: 14 μg; 双壳类: 4.2 μg; 动吻类: 2.0 μg; 介形类:26 μg; 端足类: 15 μg; 原足类: 15 μg; 其他: 3.5 μg。
沉积物粒度分析采用Cilas (940L)型激光粒度仪进行测定。有机质测定参照《海洋调查规范》[23]及刘昌岭等[24]改进的方法。有机质含量为有机碳含量乘以系数 1.724。叶绿素 a 和脱镁叶绿素 a 的测定采用湿样法[25]。含水量数据藉由沉积物烘干前后质量的差异计算得出。水深和底层水温度、盐度数据来自随船温盐深测定仪 (CTD)现场测定。
线虫个体平均干质量与环境因子之间的相关性,采用SPSS 16.0 软件包中的Pearson相关分析。
2 结果
2.1 环境因子
北黄海4个站位的沉积环境因子如图2所示。L3站的水深为15.2 m, 该站的底层水温(3.3℃)和底层水盐度(31.0)最低。其他3站的水深均为50~53.4 m,水温(6.5~8.5℃)和盐度(31.9~32.3)比较接近。沉积物中含水量的最低值出现在 38753站(28.8%), 最高值出现在 38001站(50.1%)。4个站位有 3种沉积物类型: 38001站为黏土质粉砂, 粉砂-黏土含量 100%;38753站为粉砂质砂, 粉砂-黏土含量 50.5%; 38752和L3站为砂质粉砂, 粉砂-黏土含量72.4%~79.9%。有机质含量与粉砂-黏土含量的分布趋势相同, 最高值出现在粉砂-黏土含量最高的38001站, 为1.8 %;最低值出现在粉砂-黏土含量最低的38753站, 为0.6%。叶绿素a和脱镁叶绿素a因具有同源性, 二者的分布趋势基本重合, 其最高值均出现在 L3站, 分别为 3.2 μg/g 和 13.5 μg/g; 最低值出现在 38753 站, 分别为 0.6 μg/g 和 1.8 μg/g。

图2 4个采样站位的沉积物环境参数Fig.2 Benthic environmental parameters at four sampling stations
2.2 线虫个体平均干质量
在北黄海38001、38752、38753和L34个站位, 通过对总计 955条线虫体长和体宽的测量, 利用体积换算法, 获得 4个站位的线虫个体平均干质量分别为 0.091 μg±0.131 μg(0.006~0.545 μg)、0.450 μg±0.928 μg(0.011~5.078 μg)、0.211 μg±0.385 μg(0.005~3.093 μg)和0.127 μg±0.218 μg(0.006~2.023 μg), 平均为 0.196 μg±0.140 μg(图3, 表2)。线虫的个体平均干质量在不同站位间差异较大, 个体干质量的最大值是最小值的1028倍。Pearson相关分析显示, 线虫的个体平均干质量与所测各项环境因子的相关性均不显著。

图3 4个采样站位的线虫个体平均干质量Fig.3 Average individual dry weight of nematodes at four sampling stations
2.3 实测和经由 0.4 μg/个估算所获线虫及小型底栖动物生物量的比较
北黄海38001、38752、38753和L34个站位, 基于个体平均干质量实测所获线虫的生物量(干质量)分别为(107.5 μg±32.7 μg)/10 cm2、(1494.3 μg±344.9 μg)/10 cm2、(423.4 μg±32.3 μg)/10 cm2和(531.4 μg±91.9 μg)/10 cm2。经由经验系数0.4 μg/个估算的线虫生物量分别为(472.6 μg±143.6 μg)/10 cm2、(1328.3 μg±306.6 μg)/10 cm2、(802.7 μg±61.3 μg)/10 cm2和(1673.8 μg±289.6 μg)/10 cm2。估算的线虫生物量分别是实测的线虫生物量的4.4、0.9、1.9和3.1倍(图4)。仅在38752站, 实测和估算的线虫生物量接近; 在其他站位, 若采用经验系数 0.4 μg/个, 均会对线虫的生物量造成不同程度的高估。
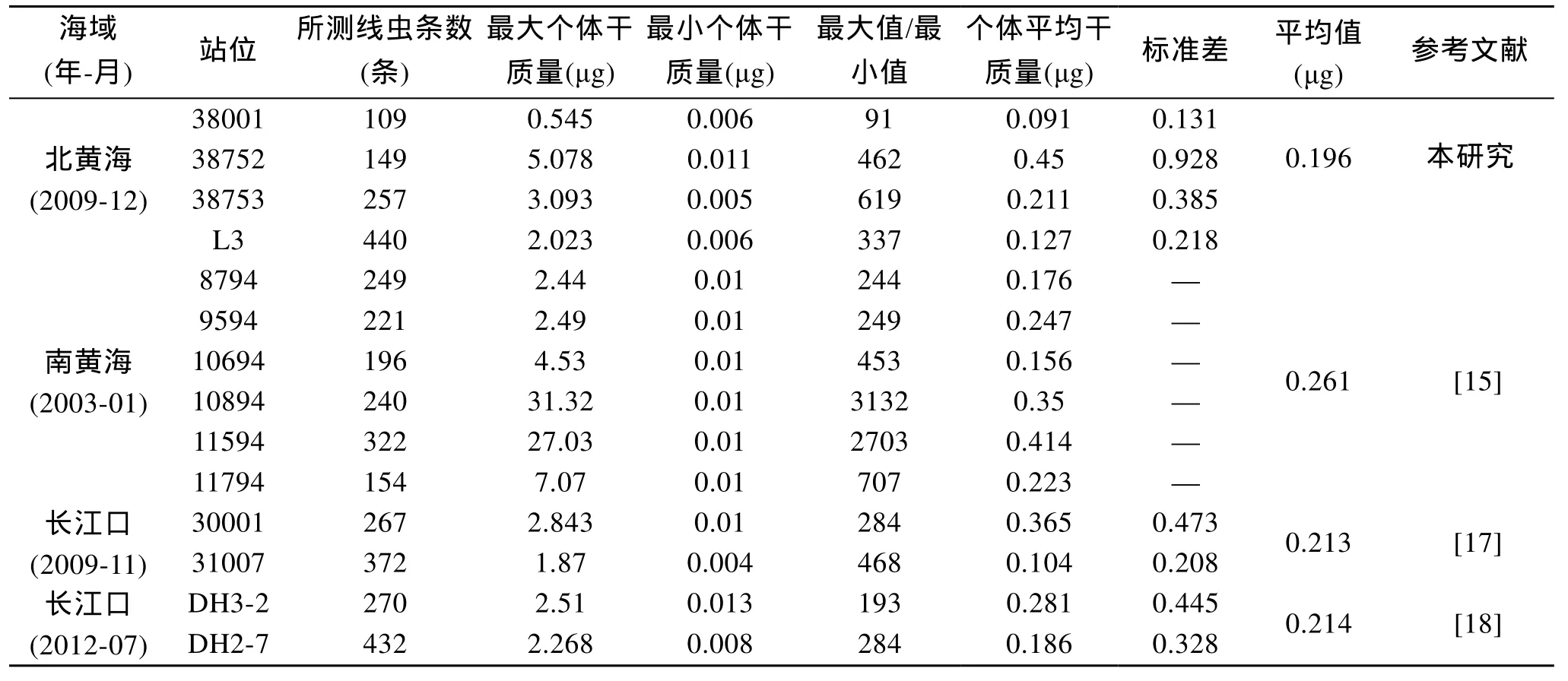
表2 不同海域线虫的个体干质量比较Tab.2 Comparison of individual dry weight of nematodes from different sea areas

图4 实测和估算的线虫生物量比较Fig.4 Comparison of nematode biomass obtained by direct measurements and that based on 0.4 μg/ind
在除线虫外其他类群的生物量均采用经验系数进行估算的情况下, 经由线虫生物量实测所获 4个站位的小型底栖动物生物量(干质量)分别为(116.2 μg±38.6 μg)/10 cm2、(3220.5 μg±1381.9 μg)/10 cm2、(802.2 μg±128.3 μg)/10 cm2和(816.5 μg±87.5 μg)/10 cm2。若对线虫的生物量也采用估算法, 所得 4个站位的小型底栖动物生物量则分别为(481.3 μg±149.3 μg)/10 cm2、(3054.5 μg±1344.1 μg)/10 cm2、(1181.5 μg±118.1 μg)/10 cm2和(1958.9 μg ±279.0 μg)/10 cm2。估算与实测线虫生物量两种方法所获小型底栖动物生物量的比值分别为4.1、0.9、1.5和2.4(图5)。同样地, 仅在38752站, 两种方法所获的小型底栖动物生物量接近; 在其他站位, 错误高估的线虫生物量也会相应地导致小型底栖动物生物量的高估。

图5 基于线虫实测与基于经验系数估算的小型底栖动物生物量比较Fig.5 Comparison of meiofaunal biomass obtained by direct measurements of nematodes and that by 0.4 μg/ind
3 讨论
本研究发现, 即使在同一季节、同一站位, 由于种类和个体生活史阶段的不同, 沉积物中线虫的大小差异悬殊, 导致各站位内线虫个体干质量变化极大, 其中 38753站个体干质量的最大值是最小值的619倍。黄勇[15]在南黄海10894站所测个体干质量的最大值甚至是最小值的 3132倍(表2)。从线虫群落结构的角度来看, 种类组成和幼体所占比例可能是影响个体平均干质量的主要因素。毋庸置疑, 当个体小的线虫种类(如Quadricoma,Prochromadorella,Chromadorita和Halalaimus等)占优势, 且幼体所占比例较大时, 线虫的个体平均干质量较小, 反之较大。
对于线虫群落中幼体所占的比例, 大多数学者认为季节是主要的影响因子[26-28]。黄勇[15]对冬季南黄海线虫群落年龄结构的分析中发现幼体占线虫总数的 60%以上; 郭玉清[29]对春、秋季节渤海线虫群落结构的研究中发现幼龄个体数占到线虫总数的50%以上; 华尔[30]和笔者发现夏季长江口及其邻近海域线虫群落中幼体所占比例分别为 39%和 42%。从现有数据来看, 冬季的幼体比例高于夏季。由此看来, 季节确实会对线虫群落中幼体比例产生影响,从而影响线虫的个体平均干质量。
在同一季节, 由于各站位线虫的繁殖阶段大致相近, 因此幼体所占比例往往比较接近, 这时种类组成就成为个体平均干质量的主要影响因子。郭玉清等[31]对渤海 12种线虫成体平均干质量的测量显示,不同种类的个体平均干质量差别巨大(0.06~2.08 μg)。黄勇等[32]在 对南黄海冬季 鳀 鱼越冬场22个站位海洋线虫群落结构的研究中指出, 与线虫群落结构相关性最高的环境因子组合为有机质含量、黏土含量和叶绿素a含量。另外, 季节和恶劣天气还会影响线虫群落的种类组成[33]。至于种类组成和幼体比例这两个因素在影响线虫个体平均干质量的程度上孰轻孰重, 作者通过对 2012年夏季长江口及其邻近海域DH2-7和 DH3-2站的再分析中, 发现种类组成对个体干质量的影响更大。DH2-7站的优势种为体积较小的种类, 幼体比例较低; DH3-2站的优势种为体积较大的种类, 幼体比例较高。史本泽等[17]通过体积换算法测得DH2-7站的个体平均干质量低于DH3-2站(表3)。

表3 种类组成和幼体比例对个体平均干质量影响的比较Tab.3 Comparision of species composition and juvenile proportion as well as its influence on average individual dry weight
此外, 线虫的个体大小与沉积环境有着密切的联系[34-36]。在不同类型的沉积物中, 线虫的体形会产生适应性变化。泥土质沉积物中的线虫一般身体细小, 且刚毛短; 而砂质沉积物中的线虫则趋向于身体偏长, 刚毛较长或者短粗[30]。为探明影响线虫个体平均干质量的主要环境因子, 在控制过筛孔径、季节、采样和分选操作等因素相同的情况下, 我们利用本研究中北黄海 4个站位的数据, 结合于婷婷等[16]在同一航次长江口邻近海域两个典型站位所得结果,将线虫个体平均干质量与水深、底层水温度、底层水盐度、含水量、中值粒径、粉砂-黏土含量、叶绿素a和脱镁叶绿素a含量、有机质含量进行了Pearson相关性分析。结果显示, 线虫的个体平均干质量与上述环境因子均未见有相关性。究其原因, 一方面可能系所涉站位较少, 另一方面说明线虫个体干质量可能更受种类组成及多个环境因子的共同影响。
综上所述, 线虫群落的种类组成和幼体所占比例是影响线虫个体平均干质量的主要因素, 其中种类组成对个体平均干质量的影响更大。鉴于沉积物的中值粒径、有机质含量和叶绿素 a含量与线虫群落的种类组成相关性较高, 是影响种类组成的主要因素, 而季节是影响幼体比例的主要因子。综合国内已有数据(表1)可以看出, 当采用31 μm这一过筛孔径进行分选时, 我国目前普遍采用的 0.4 μg/个这一估算线虫生物量的经验系数过高。本研究仅38752站位与此经验系数接近, 其他站位均明显小于0.4 μg/个。因此, 如采用经验系数对所涉海域的线虫生物量进行大体估测, 建议采用 0.2 μg/个这一系数, 以减少估测的误差。另一方面, 由于我国已发表的绝大部分线虫及小型底栖动物的生物量数据均经由0.4 μg/个经验系数所得。因此, 建议在小型底栖动物生态调查中明确给出线虫的丰度数据,便于对线虫及小型底栖动物的生物量重新进行估算和校正。
致谢:搭载中国科学院海洋研究所“2009年秋季中国近海海洋科学考察开放共享航次”采样并获得水文数据, 感谢本课题组在底栖环境因子测试中提供的帮助。
[1]Coull B C.Role of meiofauna in estuarine soft-bottom habitats[J].Australian Journal of Ecology, 1999, 24(4):327-343.
[2]Ansari Z A.Inter-relationship between marine meiobenthos and microbes[C]//Ramaiah N ed.Marine Microbiology:Facets & Opportunities.Goa: National Institute of Oceanography, 2005: 175-179.
[3]Moens T, dos Santos G A P, Thompson F, et al.Do nematode mucus secretions affect bacterial growth?[J].Aquatic Microbial Ecology, 2005, 40(1): 77-83.
[4]Moreno M, Ferrero T J, Gallizia I, et al.An assessment of the spatial heterogeneity of environmental disturbance within an enclosed harbour through the analysis of meiofauna and nematode assemblages[J].Estuarine, Coastal and Shelf Science, 2008, 77(4):565-576.
[5]Platt H M, Warwick R M.The significance of free-living nematodes to the littoral ecosystem[C]//Price J H, Irvine D E G, Farnham W F.The shore environment: 2.Ecosystems.London and New York:Academic Press, 1980: 729-759.
[6]Miljutin D M, Gad G, Miljutina M M, et al.The state of knowledge on deep-sea nematode taxonomy: how many valid species are known down there?[J].Marine Biodiversity, 2010, 40(3): 143-159.
[7]Wieser W.Benthic studies in Buzzards Bay.II.The meiofauna[J].Limnology and Oceanography, 1960, 5:121-137.
[8]McIntyre A D.Meiobenthos of sub-littoral muds[J].Journal of the Marine Biological Association of the United Kingdom, 1964, 44(3): 665-674.
[9]Widbom B.Determination of average individual dry weights and ash-free dry weights in different sieve fractions of marine meiofauna[J].Marine Biology,1984, 84(1): 101-108.
[10]Olsson I.On methods concerning marine benthic meiofauna[J].Zoon, 1975, 3: 49-60.
[11]Guille A, Soyer J.La faune benthique des substrates meubles de Banyuls-sur-Mer premiéres données qualitatives et quantitatives[J].Vie Milieu (Ser B),1969, 19: 329-359.
[12]Coull B C.Shallow water meiobenthos of the Bermuda platform[J].Oecologia, 1970, 4(4): 325-357.
[13]Ólafsson E L M G R E N, Elmgren R.Seasonal dynamics of sublittoral meiobenthos in relation to phytoplankton sedimentation in the Baltic Sea[J].Estuarine, Coastal and Shelf Science, 1997, 45(2):149-164.
[14]Ankar S, Elmgren R.The benthic macro- and meiofauna of the Askö-Landsort ara (northern Baltic proper).A stratified random sampling survey[M].Sweden: Contributions from the Asköe Laboratory,University of Stockholm, Sweden, 1976: 1-115.
[15]黄勇.南黄海小型底栖生物生态学和海洋线虫分类学研究[D].青岛: 中国海洋大学博士学位论文, 2005:1-184.
[16]张青田.天津近岸海域小型底栖动物生物学研究[D].天津 : 南开大学博士学位论文, 2009: 1-161.
[17]于婷婷, 徐奎栋.长江口及邻近海域秋冬季小型底栖动物类群组成与分布[J].生态学报, 2013, 33(15): 4556-4566.
[18]史本泽, 于婷婷, 徐奎栋.长江口及东海夏季小型底栖动物的丰度和生物量及近十年的变化[J].生态学报, 2014.
[19]王家栋, 类彦立, 徐奎栋, 等.中国近海秋季小型底栖动物分布及与环境因子的关系研究[J].海洋科学,2009, 33(9): 62-70.
[20]王家栋, 类彦立, 徐奎栋, 等.黄海冷水团及周边海域夏初小型底栖动物现存量及空间分布研究[J].海洋与湖沼, 2011, 42(3): 359-366.
[21]Pfannkuche O, Thiel H.Sample processing[C]//Heggins R P, Thiel H, eds.Introduction to the Study of Meiofauna.Washington DC: Smithsonian Institution Press, 1988: 134-145.
[22]Nozais C, Perissinotto R, Tita G.Seasonal dynamics of meiofauna in a South African temporarily open/closed estuary (Mdloti Estuary, Indian Ocean) [J].Estuarine,Coastal and Shelf Science, 2005, 62(1): 325-338.
[23]中华人民共和国国家质量检验检疫总局和中国国家标准化管理委员会.GB/T 12763.6-2007.海洋调查规范 第 6部分: 海洋生物调查[S].北京: 中国标准出版社, 2007, 1-159.
[24]刘昌岭, 朱志刚, 贺行良, 等.重铬酸钾氧化-硫酸亚铁滴定法快速测定海洋沉积物中有机碳[J].岩矿测试, 2007, 26(3): 205-208.
[25]王荣.荧光法测定浮游植物色素计算公式的修正[J].海洋科学, 1986, 10(3): 1-5.
[26]Lorenzen S.Die Nematodenfauna der sublitoralen Region der Deutschen Bucht, insbesondere im Titanabwassergebiet bei Helgoland[J].Veröffentlichungen Des Instituts für Meeresforschung in Bremerhaven,1974, 14: 305-327.
[27]Juario V J.Nematode species composition and seasonal fluctuation of a sublittoral meiofauna community in the German Bight[J].Veröffentlichungen Des Instituts für Meeresforschung in Bremerhaven, 1975, 15: 283-337.
[28]Warwick R M, Price R.Ecological and metabolic studies on free-living nematodes from an estuarine mud-flat[J].Estuarine and Coastal Marine Science,1979, 9(3): 257-271.
[29]郭玉清.渤海自由生活海洋线虫的群落结构和多样性研究[D].青岛海洋大学博士学位研究生学生论文, 2000.
[30]华尔.长江口及其邻近海域小型底栖动物群落结构和多样性研究[D].青岛: 中国海洋大学博士学位论文, 2006: 1-209.
[31]郭玉清, 张志南, 慕芳红.渤海小型底栖动物生物量的初步研究[J].海洋学报, 2002, 24(6): 76-83.
[32]黄勇, 张志南, 刘晓收.南黄海冬季自由生活海洋线虫群落结构的研究[J].海洋与湖沼, 2007, 38(3): 199-205.
[33]华尔, 张志南, 张艳.长江口及邻近海域小型底栖生物丰度和生物量[J].生态学报, 2005, 25(9): 2235-2242.
[34]Warwick R M.Nematode associations in the Exe estuary[J].Journal of the Marine Biological Association of the United Kingdom , 1971, 51: 439-454.
[35]Bouwman L A, Romeijn K, Admiraall W.On the ecology of meiofauna in an organically polluted estuarine mudflat[J].Estuarine, Coastal and Shelf Science, 1984, 19(6): 633-653.
[36]McIntyre A D, Murison D J.The meiofauna of a flatfish nursery ground[J].Journal of the Marine Biological Association of the United Kingdom, 1973, 53(1): 93-118.

