禽源空肠弯曲杆菌ERIC-PCR分型及毒力因子研究
王 娟,黄秀梅,崔晓娜,翟海华,曲志娜,赵思俊,王玉东,盖文燕,王君玮
(1.中国动物卫生与流行病学中心,山东青岛 266032;2. 山东畜牧兽医职业学院,山东潍坊 261061)
禽源空肠弯曲杆菌ERIC-PCR分型及毒力因子研究
王 娟1,黄秀梅1,崔晓娜2,翟海华1,曲志娜1,赵思俊1,王玉东1,盖文燕1,王君玮1
(1.中国动物卫生与流行病学中心,山东青岛 266032;2. 山东畜牧兽医职业学院,山东潍坊 261061)
[目的] 通过对禽源空肠弯曲杆菌分子分型和毒力研究,了解禽源空肠弯曲杆菌在禽肉产品生产过程中的主要传播途径和携带的主要致病因子。[方法] 对从家禽养殖场、屠宰场等采集的720份泄殖腔拭子和禽肉表面拭子样品分离的311株空肠弯曲杆菌进行ERIC-PCR分型和16种毒力因子检测。[结果] 禽源空肠弯曲杆菌的分离率为43.19%;肉鸡生产链中空肠弯曲杆菌沿生产链传播,且有优势菌株型;90%以上分离菌株携带11种毒力基因。[结论] 肉鸡生产链中空肠弯曲杆菌存在水平传播现象,且没有外源性污染;16种毒力基因中,14种毒力基因的携带率均在50%以上。加强禽源空肠弯曲菌的监测是控制空肠弯曲菌的前提,对公共卫生具有重要意义。
禽源;空肠弯曲杆菌;ERIC-PCR分型;毒力因子
空肠弯曲杆菌是一种重要的人兽共患病原菌,是引起人胃肠道感染最常见的病原菌之一,主要引起腹泻,并引发严重的并发症。在我国空肠弯曲杆菌也是主要的腹泻病原菌之一[1]。空肠弯曲杆菌广泛散布在各种动物体内,其中鸡是带菌率最高的动物,接触或食用鸡肉是主要传染途径。本文分析了禽产品生产过程中空肠弯曲杆菌的分子分型和毒力基因携带情况,为我国动物产品安全和公共卫生监管提供了技术支持,也为空肠弯曲杆菌引起的疾病溯源及其分子流行病学研究提供了一定的基础。
1 材料与方法
1.1 材料
1.1.1 标准菌株。空肠弯曲菌(ATCC 33560),购自中国微生物菌种保藏中心。
1.1.2 主要试剂。空肠弯曲杆菌选择性琼脂基础以及配套添加剂购自sigma公司;哥伦比亚血琼脂基础购自英国OXOID公司;绵羊全血购自青
岛海博生物科技公司;微需氧产气袋购自日本三菱MGC公司;DNA Marker DL-2000、Takara LA Taq ®购自宝生物工程(大连)有限公司;2×Taq PCR Master Mix购自Promega公司。
1.1.3 主要仪器设备。凝胶成像系统、PCR仪、CLASSⅡ生物安全柜、电热恒温水浴锅、电子天平、旋涡混合仪。
1.1.4 样品来源。2013年,从青岛地区的3个蛋鸡场、2个肉鸡场、1个肉鸡屠宰加工企业、以及2个农贸市场共采集720份样品。
1.2 方法
1.2.1 样品采集与运送。从养鸡场采集被检鸡泄殖腔拭子样品420份,从屠宰场和农贸市场鸡肉产品表面拭子采集表面拭子样品300份,合计720份。
1.2.2 细菌分离与鉴定
1.2.2.1 细菌分离与纯化 将拭子样品直接在空肠弯曲菌SKIRROW选择培养基上划线,再用接种环划开,42 ℃微需氧培养48 h后;选择灰白色、扁平、湿润,沿接种线向外扩散的倾向的菌落,接种于哥伦比血平板上进行纯化培养,同时,涂片、染色镜检。
1.2.2.2 细菌鉴定 将纯化菌落采用煮沸法提取模板后,应用建立的双重PCR方法对本次分离到的空肠弯曲菌进行鉴定。选取hipO,mapA基因作为检测引物,具体引物序列如下hipO上:ACT GCA AAA TTA GTG GCG,hipO下:GAG CTT TAG CAA ACC TTC C,片段长度为1028 bp;mapA上:CTA TTT TAT TTT TGA GTG CTT GTG,mapA下:GCT TTA TTT GCC ATT TGT TTT ATT A,片段长度为589 bp。
1.2.3 ERIC-PCR分型。参照文献方法[2-3],设计空肠弯曲杆菌ERIC-PCR引物。上游引物ERIC1:5’-ATGTAAGCTCCTGGGGATTCA-3’; 下 游引 物ERIC2:5’-AAGTAAGTGACTGGGGTGAGC-3’,由上海生工生物技术有限公司合成。反应条件:94℃预变性5 min;94℃变性30s,35℃退火1 min,72℃延伸4 min,35个循环;72℃延伸10 min。
1.2.4 毒力基因检测。根据文献报道[4-5]合成fl aA,cadF,racR,ceuE,VirBII基因的引物,其他引物根据GenBank公布的基因序列设计,引物序列、片段大小和PCR扩增条件见表1。引物由上海生工生物工程技术服务有限公司合成。
2 结果
2.1 细菌分离鉴定结果
利用建立起来的双重PCR方法对分离到的疑似空肠弯曲菌进行PCR鉴定,在720份样品中,检出311份空肠弯曲菌阳性,其中在农贸市场和养殖场检出209份,肉鸡生产链检出102份,鸡源空肠弯曲菌的平均阳性率为43.2%,对部分分离株的鉴定结果如图1所示。
2.2 ERIC-PCR 分型结果
2.2.1 各养殖场的ERIC-PCR分型结果。应用ERIC-PCR分型方法对3家蛋鸡养殖场和2家肉鸡
养殖场的空肠弯曲菌分离株进行分型,均可产生清晰的指纹图谱,扩增产物有多条特异性片段,大小约在100 bp~2000 bp之间,构成不同的基因图谱,根据扩增结果发现空肠弯曲杆菌的传播规律:同一来源的空肠弯曲菌分离株存在相同的基因图谱,不同来源的菌株差异较大,同一场内的空肠弯曲菌分离株存在相同的图谱,不同场的分离株没有相同的图谱,说明空肠弯曲菌主要是水平传播,具有局限性和多型性(图2)。

表1 毒力基因PCR引物
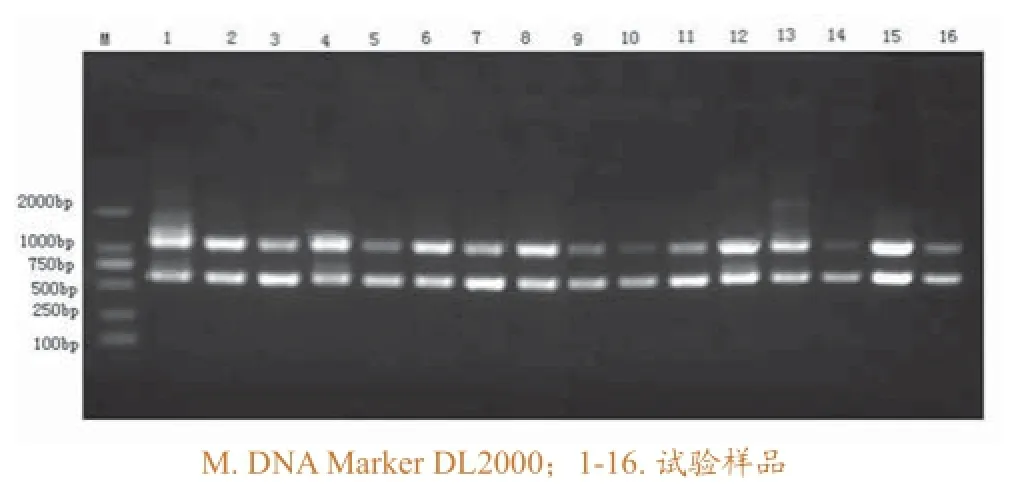
图1 样品的PCR扩增结果
2.2.2 肉鸡生产链空肠弯曲菌分离株的ERICPCR分型结果。本次对肉鸡场A所属企业的肉鸡生产链不同环节分离到的空肠弯曲菌进行了ERICPCR分型分析,分型得到的结果与从肉鸡场空肠弯曲菌分离株的分型结果一致(表2),得到的分离图谱都包含在肉鸡场A分离株的4种基因型中,其中盲肠分离株有4型,胴体体表分离株有3型,屠宰场储藏鸡肉分离株有2型,市场鸡肉分离株有1种基因型,胴体体表和鸡肉样分离株得到的基因型都包含在泄殖腔分离株的四种基因型中。结合A肉鸡养殖场的分型结果,说明肉鸡生产链中空肠弯曲菌存在水平传播现象,且没有出现外源污染现象。4种基因型中,BA1型同时存在于肉鸡整个生产链中,说明BA1型是优势菌株。
2.3 毒力基因检测结果
2.3.1 毒力基因扩增结果。16种毒力基因中,除virBⅡ的检出率为0外,其他毒力基因均可在分离菌株中扩增出与预期目的片段大小一致的特异性片段,扩增结果见图3。

表2 肉鸡生产链空肠弯曲菌ERIC-PCR分型情况
2.3.2 空肠弯曲菌分离株毒力基因分析

图3 空肠弯曲菌毒力基因PCR检测图
如图4所示,除neuB和virBⅡ较低,其他14种毒力因子携带率都较高,有11种达到90%以上。针对所检测的16种毒力因子,311株空弯分离株中4株含有除vir BⅡ以外的15种毒力因子,占总分离数的1.3%;97株含有14种毒力因子,占总数的31.2%;110株含有13种毒力因子,占总数的35.4%;92株含有12种毒力因子,占总数的29.6%;还有5株含有11种毒力因子,占总数的1.6%;只有3株含有5种毒力因子。
对自己设计合成的10对毒力基因引物的PCR产物进行纯化,采用直接测序法进行核苷酸的测定,比较质控菌株和分离株的同源性。分离株的flaA,cdtA,cheW,grpE,dnaK,cheY,cdtB,pldA的序列与质控菌株的同源性在93%~99%之间,neuB1的扩增序列与GenBank上公布的序列同源性为99%,cfrA的与GenBank上公布的序列同源性为98%。
2.4 分析
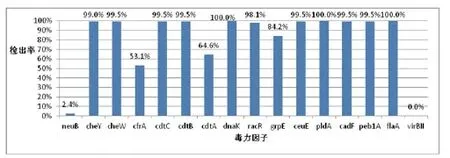
图4 311株空肠弯曲菌毒力因子检出情况
本实验利用ERIC-PCR技术对不同养殖场和肉鸡生产链的空肠弯曲菌分离株进行了分型,显示了良好的分型能力。不同来源的空肠弯曲菌的ERICPCR分型结果得到不同的基因图谱,说明空肠弯曲菌基因具有多态性。同一鸡场的不同个体会存在相同的基因型,并且同一鸡场存在优势基因型。同时相对于蛋鸡场,肉鸡场得到的基因型数量较少,说明在商业化的肉鸡养殖场内,空肠弯曲菌具有相对较低的异质性,与相关文献报道[6-8]相符。
肉鸡生产链的分型结果表明,该厂肉鸡生产链中空肠弯曲菌存在水平传播现象,且没有出现外源污染现象。市场上的鸡肉中的空肠弯曲菌多是来源于生产源头,在养殖场内肉鸡就由于多种原因自身带有了空肠弯曲菌,而这些带有空肠弯曲菌的肉鸡在加工过程中,沿着生产链进行水平传播,这一过程中存在优势菌株,而优势菌株在环境中的生存能力要强于其他菌株,应引起重视。
通过进一步对蛋鸡与肉鸡的毒力因子携带情况,以及不同规模鸡场空肠弯曲菌的毒力因子携带情况的比较,主要在neuB1、cfrA、cdtA和grpE 4种毒力基因上存在差异,其他几种毒力因子的差异不明显,蛋鸡和中等规模养殖场的毒力因子携带率较高,可能与饲养条件和鸡的品种有关。
3 讨论
从720份样品中分离出的311株鸡源空肠弯曲菌毒力基因携带率较高,所分离到的菌株所携带的毒力基因数都超过10种,表明这些毒力基因广泛存在于空肠弯曲杆菌中,且与菌株的分布无关。动物实验发现健康动物分离到的空肠弯曲具有一定的致病性,但致病性较弱,说明空肠弯曲菌的致病性还有其他原因。空肠弯曲菌的毒力因子高携带率及致病性,对公共安全具有一定的风险,需要加强监测。
尽管鸡源空肠弯曲菌的毒力基因携带率很高,但是对宿主并没有致病,说明其致病性受多种因素影响,所以关于毒力因子在空肠弯曲菌致病过程中的作用还需进一步研究。但菌株毒力基因分布的相似性提示人们,这些菌株无论是分离自何种环境,都具有引起空肠弯曲杆菌病的潜在能力,如果人们接触到被这些菌污染的没有加工成熟的食品,很容易造成感染,应加强各生产环节的安全控制,保证食品安全;同时,加强空肠弯曲菌及其毒力基因的检测对空肠弯曲菌病的防控具有重要意义。
[1] 陈荀,刘书亮,吴聪明,等.鸡肉生产链中空肠弯曲杆菌的污染分析及PFGE分型研究[J].中国人兽共患病学报,2012,28(10):1012-1026.
[2] 唐梦君,高玉时,张小燕,等. 空肠弯曲杆菌 ERICPCR 分型技术研究[J]. 中国动物检疫,2013,30(10):57-60.
[3] 郑扬云,吴清平,吴克刚,等. 空肠弯曲菌分离株ERIC-PCR 分型和生化分型的比较研究[J]. 现代食品科技,2013,29(8):1843-1850.
[4] 薛峰,许飞,张小荣,等.空肠弯曲杆菌PCR-RAPD分子亚分型及其毒力相关基因分析[J].农业生物技术学报,2010,18(3):586-591.
[5] 彭凌,朱必凤,杨旭夫,等. 副猪嗜血杆菌野外分离株的 ERIC-PCR 及其外膜蛋白图谱分析[J]. 中国预防兽医学报,2011,33(6):423-426.
[6] Acik M N,Karahan M,Ongor H,et al. Investigation of Virulence and Cytolethal Distending Toxin Genes in Campylobacter spp. Isolated from Sheep in Turkey[J]. Foodborne pathogens and disease,2013,10(7):589-594.
[7] Camarda A,Circella E ,Pennelli D,et al. Typing of Campylobacter jejuni and C.coli isolated from laying hens during the production cycle[J]. Italian Journal of Animal Science,2011,5(3):295-297.
[8] Khoshbakht R,Tabatabaei M,Hosseinzadeh S,et al. Distribution of nine virulence-associated genes in Campylobacter jejuni and C. coli isolated from broiler feces in Shiraz,Southern Iran[J]. Foodborne pathogens and disease,2013,10(9):764-770.
Study on ERIC-PCR Typing and Virulence Genes of Avian Campylobacter jejuni
Wang Juan1,Huang Xiumei1,Cui Xiaona2,Zhai Haihua1,Qu Zhina1,Zhao Sijun1,Wang Yudong1,Gai Wenyan1,Wang Junwei1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032; 2. Shandong Vocational Animal Science and Veterinary College,Weifang,Shandong 261061)
To understand the main transmission route and pathogenic factors of Campylobacter jejuni (C. jejuni)during poultry production process,720 samples were collected from poultry cloaca and chicken meat for isolation and identifi cation of C. jejuni resulting in 311 C. jejuni isolates. ERIC-PCR typing and virulence of the 311 C. jejuni isolates were analyzed with PCR assay. The result revealed that more than 90% isolates carried 11 virulence genes. C. jejuni was spread along the broiler production chain,and there existed dominant strains. In conclusion C. jejuni was horizontally transmitted in broiler production chain without exogenous contamination. 50% or more C. jejuni isolates carried 14 virulence genes. It is signifi cant for public health to strengthen the monitoring and control of C. jejuni from avian.
poultry source;Campylobacter jejuni;ERIC-PCR typing;virulence genes
R378.3
A
1005-944X(2015)05-0069-04
农业部“农产品质量安全风险评估项目”(NO. GJFP2014007)资助
王君玮
——基于行业数据的测度

