猪蛔虫各期虫体基因片段(2G04)表达情况分析
曾玉梅 福建省武平县下坝乡畜牧兽医站364309
猪蛔虫各期虫体基因片段(2G04)表达情况分析
曾玉梅福建省武平县下坝乡畜牧兽医站364309
采用半定量RT-PCR(Reverse Transcription-Polymerase Chain Reaction)方法,探讨编码铁蛋白基因(命名为2G04)在猪蛔虫不同发育期虫体的表达丰度。结果表明该基因在雄虫中没有检测到表达量,在其他各期幼虫均有较高表达,其中在虫卵中表达量最高。试验结果可为猪蛔虫的发育生物学和免疫防治奠定基础和提供科学依据。
猪蛔虫各期虫体半定量RT-PCR基因表达
猪蛔虫属于蛔虫科蛔虫属,为黄白色或淡红色大型线虫。其发育不需要中间宿主,一条雌蛔虫能产卵20万个[1]。猪蛔虫感染极为普遍,在卫生条件差、饲养不足或品质差、拥挤的猪群中最易感染。其虫卵有三层软膜,对理化因素抵抗力很强,一年四季均可发生。猪蛔虫和人蛔虫在形态上极其相似,在农村,人群和猪群蛔虫感染往往并存。养猪业是我国养殖业的支柱产业之一,在中国,猪肉一直是主要的肉食产品。因此,在蠕虫耐药性和药物残留普遍存在的今天,对猪蛔虫进行分子生物学研究具有重要意义。
猪蛔虫幼虫移行过程对猪造成的危害以对肺脏和肝脏的危害较大,造成肺脏和肝脏的小血管破裂,造成大量的小点出血和水肿,严重感染者可伴发蛔虫性肺炎,引起咳喘,同时可引发气喘病、猪瘟等其他疾病[2]。猪蛔虫病流行和分布广泛,是一种常见的寄生虫病,由猪蛔虫寄生在猪的小肠中而引起的,主要危害3月龄至6月龄仔猪。当成虫大量寄生时常引起小肠阻塞,猪体消瘦,贫血,被毛粗糙,生长发育不良,有的成为僵猪,肺部被幼虫侵害引起蛔虫性肺炎时,体温上升,呼吸急促,咳嗽,食欲减少及精神不振。有时虫体钻入胆管,阻塞胆道,引起腹痛和黄疸。成虫产生的毒素可作用于中枢神经系统,引起神经症状,阵发性痉挛,兴奋和麻痹,还可引起荨麻疹等[3]。猪蛔虫成虫长圆柱形,形似蚯蚓,头、尾两端逐渐变细,尾部呈圆锥形。雌虫消化道末端开口于肛门,生殖器官为双管型。据报道,在四川发现一例三管型雌性生殖系统的猪蛔虫[4],在江苏发现一例单子宫的猪蛔虫[5]。雄虫消化道末端与射精管共同开口于泄殖腔,有单管生殖器,一对交合刺。受精卵呈宽椭圆形,卵壳厚,通常由3层构成,最外层是蛋白质构成的蛋白膜,厚且有黏性,使虫卵对外界环境条件具有较强抵抗力,在蛔虫的流行病学上具有重要意义。
目前,对猪蛔虫病的研究主要在药物治疗和预防两方面,例如,抗蠕虫药的研发,但由于药物的滥用或长时间使用,常常引起蛔虫的耐药性和药物残留等问题。因此,免疫防治成为新的研究方向之一。由于寄生线虫的不同发育期具有的生物学特性不相同,因此,通过选择性抑制或阻断某一特定发育期猪蛔虫的发育,使猪蛔虫的传播受阻或降低成为可能。现今,国内外这方面的资料十分匮乏,只有从几种寄生线虫克隆出数量很少的呈期特异性表达的基因。为此,在已构建猪蛔虫感染期幼虫消减cDNA文库的基础上,以β-actin基因为内参,采用半定量RTPCR技术,探讨2G04基因在猪蛔虫各期的表达丰度,并为进一步阐明猪蛔虫的发育生物学奠定基础。
1 材料与方法
1.1材料和设备以猪蛔虫各期虫体总RNA为材料,应用ReverTra Ace-a-TM试剂盒、rTaq酶溶液,PCR仪、Bio-RAD电泳系统、凝胶图像分析系统、微量取液器(2μL、200μL、1 000μL)、电泳仪(DYCP-31BN)、Thermo Forma低温冰箱等设备。
1.2方法
1.2.1逆转录反应参照ReverTraAce-a-TM试剂盒说明书并做适当的调整,根据不同样品RNA浓度调整加入的RNA体积,使RNA初始量都为1μg。反应体系见表1。

表1 逆转录反应体系
反应条件为:30℃10min、42℃40 min、99℃5 min、4℃5 min。
1.2.2内参β-actin基因的PCR扩增反应内参基因β-actin参考邓艳(2006)设计的引物[6]和反应条件并做适当的调整进行扩增。上游引物为5'-CTC GAA ACA AGA ATA CGA TG-3',下游引物为5'-A CA TGT GCC GTT GTA TGA TG-3'。反应体系见表2。
反应条件如下:94℃预变性5 min;94℃变性30 s、55℃退火30 s、72℃延伸30 s,25个循环;72℃后延伸10 min。

表2 内参基因PCR扩增反应体系
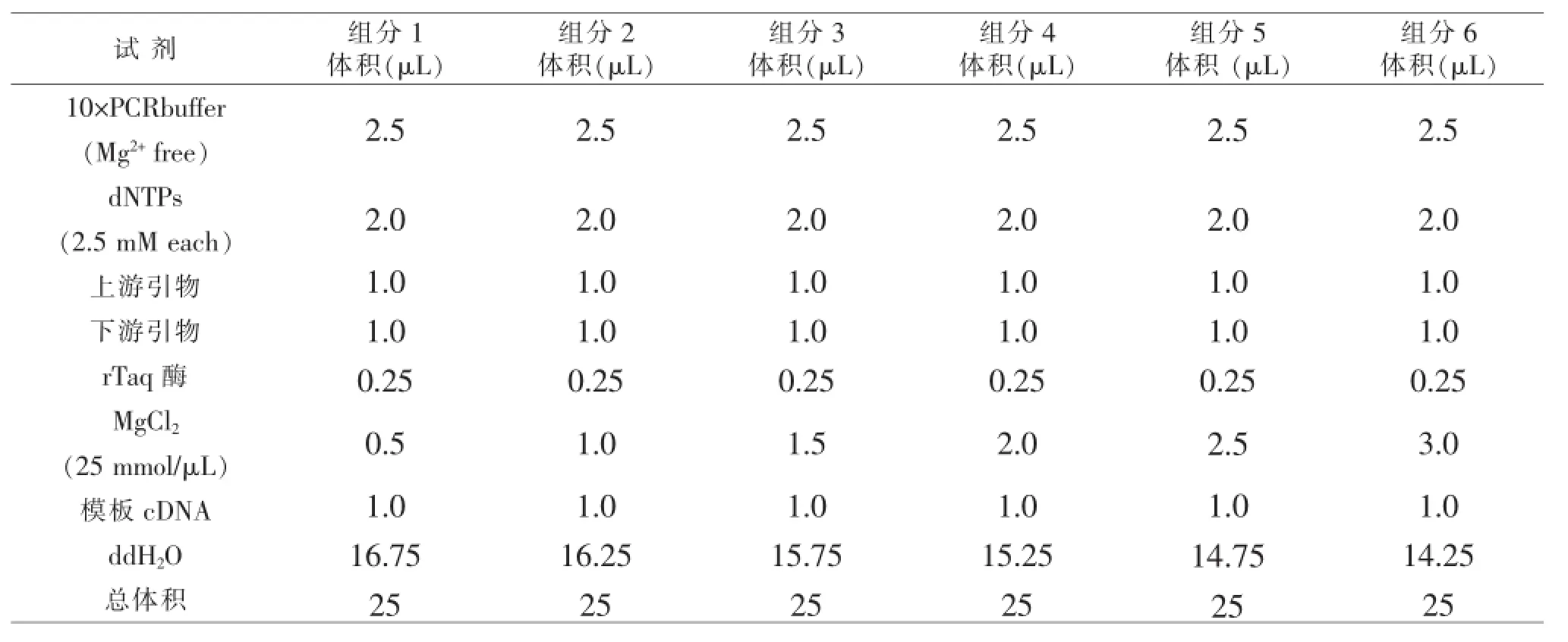
表3 Mg2+优化PCR反应体系
1.2.32G04基因的PCR扩增
1.2.3.1引物设计以已知的2G04EST序列(基因登录号:ES291034)为模板,利用primer自动搜索结合oligo软件人工分析设计引物。引物合成后加入DEPC水稀释为10 pmol/μL,分装后-20℃保存备用。引物序列为:上游引物5'AAGGTGGTTCGG CTGTTC 3,下游引物5'CTCGTCCTGCTCGTTTCA 3'。
1.2.3.2 Mg2+浓度优化通过构建不同Mg2+浓度的PCR反应体系来确定每对引物进行PCR扩增的最佳Mg2+浓度。构建的Mg2+浓度分别为0.5、1.0、1.5、2.0、2.5、3.0 mmol/L,PCR反应后,取5μL产物进行琼脂糖凝胶电泳分析。根据条带亮度和特异性,判断对应引物适合的Mg2+浓度。Mg2+优化PCR体系见表3。
PCR反应条件:94℃预变性5 min;94℃变性30 s、引物退火温度30 s、72℃延伸30 s,30个循环;72℃后延伸10 min。
1.2.3.3退火温度的优化一般情况下,退火温度比引物的解链温度低5℃左右。根据PCR仪的程序设定退火的梯度进行PCR扩增,取5μL PCR扩增产物进行琼脂糖凝胶电泳分析,根据其亮度和特异性,确定其适宜的退火温度。反应条件同Mg2+优化的PCR条件。见表4。

表4 退火温度优化PCR反应体系
1.2.3.4循环数的优化线性扩增范围内的循环数对半定量RT-PCR很重要,设定2G04基因以26、28、30、32、34、36六个梯度进行循环数优化,取5μL PCR产物进行琼脂糖凝胶电泳分析。用Quantity One软件对电泳条带进行光密度测定,选择循环数在线性范围内且电泳条带好的次数作为最佳次数。
1.2.3.5猪蛔虫感染期幼虫差异基因在不同发育期的表达分析以2G04基因与内参基因β-actin的积分光密度比值代表2G04基因的mRNA含量。根据优化结果,选择最佳的PCR反应条件对感染期幼虫差异表达基因在不同发育期的表达情况进行研究。在同一次PCR反应中进行反应,取5μL PCR产物进行琼脂糖电泳,用Quantity One软件对电泳条带进行光密度测定。
1.2.4RT-PCR产物测序分析将RT-PCR产物进行测序,将测序结果与已知EST片段进行比对分析。
2 结果和分析
2.1内参基因扩增内参基因β-actin在虫体各期表达稳定,一般不受外界环境的变化而影响其表达水平。
2.2Mg2+浓度优化所有的热稳定DNA聚合酶都需要有游离的二价阳离子,通常是用Mg2+激活DNA聚合酶[7]。因此,Mg2+是影响PCR反应的一项重要因素。根据Mg2+浓度优化电泳结果分析,该基因的最佳Mg2+浓度为1.0 mM。
2.3退火温度优化复性过程(即退火)采用的温度很关键,如果复性温度太高,扩增效率将会非常低,因为寡核苷酸引物不能与模板很好地复性。如果复性温度太低,引物将产生非特异性复性,从而导致非特异性DNA片段的扩增[6]。不同的序列其最佳的退火温度也不同。根据退火温度优化电泳结果分析,2G04基因的最佳退火温度为47.5℃。
2.4循环数对PCR产物光密度值的影响半定量PCR分析的原理是通过PCR产物来推断样品中原始模板的量,该技术一般要求在PCR扩增的指数期进行[8]。PCR扩增产物的量与循环数之间有一线性的关系,前期扩增产物的量随循环数的递增而成比例增加,但由于DNA聚合酶活性下降和溶液中反应底物不断减少,扩增产物的量将会达到一个平台。因而,循环数的优化对半定量PCR来说至关重要。表达丰度不同的基因其半定量PCR分析的循环数亦不一样。根据电泳结果,2G04基因在36循环数内扩增在指数增长期。
2.5猪蛔虫感染期幼虫差异基因(2G04)在不同发育期的半定量RT-PCR结果取5μL PCR产物进行1.5%琼脂糖凝胶电泳分析,用Quantity One软件对每条电泳条带进行光密度测定,用各目的基因与内参基因β-actin积分光密度的比值代表目的基因在不同发育期的表达量。结果表明,2G04基因除了在雄虫发育期不表达外,在其他发育期都有表达,在虫卵中表达量最高。
2.6测序结果分析将测序所得的序列与目的基因已知EST序列片段进行比对,碱基序列98%相同,证明RT-PCR扩增片段是目的片段,且没有发生碱基突变。
3 讨论
猪蛔虫感染广泛,是猪体内最常见的寄生虫,流行性强,给集约化养殖和散户都造成一定程度的损失,是引起养猪业损失最大的寄生虫病之一。且猪蛔虫的幼虫在人和动物体内移行会引起一系列的疾病[9-11],因此,对猪蛔虫的研究和控制刻不容缓。
传统的贝尔曼氏法分离L3、L4经常有许多杂质存在,即使采用不同孔径的分样筛过滤,也总会有与虫体大小差不多的杂质存在,而且耗时费事[12]。Murrell等(1997)采用终浓度为1.0%的琼脂糖凝胶法将含有幼虫的碎组织凝固后,浸泡在0.9%生理盐水中收集幼虫[13],这样收集的幼虫纯度很高,数量却偏少,当要获得大量幼虫时,因不能一次性获得大量虫体,其试验次数和成本必然增加,本研究将两种方法相结合,但使用较低浓度琼脂凝胶(0.4%)收集幼虫,结果表明该方法获得的幼虫不仅数量多,而且纯度高。对培养含有感染性幼虫虫卵和分离各发育期幼虫的方法和条件进行优化,获得了大量纯度较好的虫卵和幼虫,并获得良好质量的虫卵、各期幼虫及成虫的总RNA。用化学脱鞘法结合玻璃珠振荡的物理脱鞘方法能够得到大量纯度较好的感染期幼虫。相较于其他研究者所采用的方法[14-16],通过次氯酸钠氧化卵壳再加以玻璃珠振荡的方法具有操作简单、纯度好、分离率高等优点。猪蛔虫各期虫体总RNA的提取是本研究的一个关键,总RNA的纯度直接影响后面的逆转录反应。为此本研究在试验方法上做了一些改进,样品从液氮中取出时就加入少量的Trizol,这样既能加速样品在冻存管的溶解,使样品能够更快拿出在研磨上研磨,也能更有效地防止RNA降解。
近年来半定量RT-PCR常被用来定量测定特异性mRNA丰度,其原理主要是通过在线性增长期内目的片段的扩增强度与内参基因的扩增强度相比较,从而判断目的基因的拷贝数[17]。该方法的优点在于mRNA经反转录后,再由PCR数次循环,其产物的量以指数形式增长,因此,模板的浓度即使比较低也能够检测得到。选择合适的看家基因是关键之一,本试验选择在各组织和细胞稳定表达的β-actin作为内参基因。由于试验设计的目的片段与内参基因片段相差不大,而且内参的丰度一般远远大于目的基因的丰度,使得二者要是同时在线性范围内扩增往往导致内参基因已饱和而目的基因还不饱和,因此,试验采用同一次PCR反应,在参照邓艳(2006)研究的基础上,内参基因选用25个循环[6],目的基因2G04根据循环数优化的结果而选择34个循环数,从而保证两个基因的扩增都在线性增长期。
在猪蛔虫感染期幼虫已构建的cDNA文库基础上,采用半定量RT-PCR对2G04基因在5个发育期的表达情况进行分析。试验结果显示,该基因只在雄虫不表达。将目的基因2G04在GenBank中的非冗余数据库进行blast分析,发现与异色鲍属软体动物编码ferritin的基因有61%相似性,与秀丽隐杆线虫编码Ferritin family member(ftn-2)的基因有59%相似性。铁蛋白(Ferritin)是普遍存在于生物体内的一种保守性较高的多功能多亚基蛋白,具有调节体内铁的含量和细胞增殖、抗氧化等重要作用,说明该目的基因和机体的免疫反应有一定的相关性。
[1]张道永林毅.兽医手册[M].成都:四川科学技术出版社, 2001.
[2]甘孟侯.科学养猪问答[M].北京:中国农业出版社,2003.
[3]王旭,杨晋.猪蛔虫有三管型雌性生殖系统的解剖记录[J].四川动物,2000,19(4):251.
[4]Douvres F W,Tromba F G,Malakatis G M.Morphogenesis and migration of Ascaris suum larva developing to fourth stage in swine[J].JParasitol,1969,55(4):689-712.
[5]薛俊增.单子宫猪蛔虫一例[J].四川动物,1994,13(2):53.
[6]邓艳.猪蛔虫雄虫cDNA文库的构建及性别差异表达基因的筛选和鉴定[D].广州:华南农业大学,2006.
[7]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].3版.黄培堂,译.北京:科学出版社,2002:596-618.
[8]黄翠琴.猪蛔虫感染期幼虫差异表达基因的筛选及其功能研究[D].广州:华南农业大学,2007.
[9]Inatomi Y,Murakami T,Tokunaga M,et al.Encephalopathy caused by viscerallarva migrans due to Ascaris suum[J].J Neurol Sci,1999,164(2):195-199.
[10]Nakamura-uchiyama F,Tokunaga Y,Suzuki A,et al.A case of Ascaris suum visceral larva migrans diagnosed by using A.suum larval excretory-secretory(ES)antigen[J]. Scand JInfect Dis,2006,38(3):221-224.
[11]李国清.兽医寄生虫学[M].1版.北京:中国农业大学出版社,2006:135-140.
[12]张荣光,崔晶,毛福荣,等.旋毛虫移行幼虫收集方法的研究[J].河南医学研究,1999,8(2):126-128.
[13]Murrell K D,Slotved H C,Eriksen,et al.Improved method for the recovery of ascaris suum larvae from pig intestinalmucosa[J].J Parasitol,1997,83(2):321-324.
[14]刘志刚,罗佛全,严涛,等.人蛔虫幼虫分离制备的动态观察[J].中国人兽共患病杂志,2004,20(1):49-51.
[15]Douvres F W,Malakatis G M.In vitro cultivation of Ostertagia ostertagi,the medium stomach worm of cattle.I. Development from infective larvae to egg-laying adults[J]. Jparasitol,1997,83(3):520-527.
[16]Han Q,Eriksen L,Boes J,et al.Effects of bile on the in vitro hatching,exsheathment,and migration of Ascaris suum larvae[J].Parasitol Res,2000,86:630-633.
[17]刘宝娟,张文兵.铁蛋白的结构功能及表达调控[J].饲料工业,2009,30(4):42-46.
The analysis of the expression condition of gene(2G04)in polypide in different developmental phases of Ascaris sum
Zeng Yumei
(Livestock Farm Veterinary Station,Xiaba Township Wuping County,Fujian 364309)
This experiment adopted semiquantitative RT-PCR(Reverse Transcription-Polymerase Chain Reaction)method to discuss the expression abundance of coding ferritin gene(named 2G04)in polypide in different developmental phases.The result showed that no expression was found in maleworm for this gene,and there have high expression in other different stages,among which the highest expression was found in eggs.The experimental result lays the foundation and provides the scientific basis for the developmental biology and immune control in Ascaris suum.
Ascaris sum different stages of Ascaris suum semi-quantitative RT-PCR differentially expressed gene
A
1003-4331(2015)05-0001-04

