一株既产表面活性剂又高效降解石油烃菌株的鉴定及降解效果
刘虹,王航,汪雪格,刘娜*,温钢,付净,翦英红
1. 吉林化工学院资源与环境工程学院,吉林 吉林 132022;2. 吉林大学环境与资源学院,吉林 长春 130021;3. 松辽水环境科学研究所,吉林 长春 130021;4. 吉林化工学院生物与食品工程学院,吉林 吉林 132022
一株既产表面活性剂又高效降解石油烃菌株的鉴定及降解效果
刘虹1,王航2,汪雪格3,刘娜2*,温钢4,付净1,翦英红1
1. 吉林化工学院资源与环境工程学院,吉林 吉林 132022;2. 吉林大学环境与资源学院,吉林 长春 130021;3. 松辽水环境科学研究所,吉林 长春 130021;4. 吉林化工学院生物与食品工程学院,吉林 吉林 132022
在修复石油烃污染的环境时,多采用表面活性剂增强修复效果,而一些微生物既能降解石油烃,又能代谢分泌表面活性剂,从而促进油的乳化,提高油的分散程度,增大菌株和油珠的接触面积,提高其对石油烃的降解,增强修复效果。该研究从石油污染土壤中筛选出一株既产生物表面活性剂又高效降解石油烃的菌株B-6。通过观察形态特征、生理生化试验及16S rDNA序列分析,对菌株进行鉴定。并研究了菌株产生物表面活性剂及降解石油烃的特性。实验结果表明,B-6初步鉴定为假单胞菌属(Pseudomonas sp.)。菌株B-6的发酵液经粗提后,得到黄褐色粘稠状生物表面活性剂粗品,其产量为2.19 g·L-1。红外光谱分析表明,菌株B-6在代谢过程中能产生糖脂类生物表面活性物质。该菌株用于水中石油烃的降解,石油烃初始浓度为2 000 mg·L-1,120 r·min-1、30 ℃下振荡培养5 d后,菌株对石油烃的降解率达99.13%。
产生物表面活性剂;石油烃;降解;鉴定
LIU Hong, WANG Hang, WANG Xuege, LIU Na, WEN Gang, FU Jing, JIAN Yinghong. Identification of A Surfactant-producing and Petroleum Hydrocarbon Degrading Strain and Its Degradation Efficiency [J]. Ecology and Environmental Sciences, 2015, 24(12): 2035-2039.
近年来,由于人类在进行石油开采、储运和生产加工等过程中不可避免地造成的石油泄漏以及含油污水的不合理排放等,致使大量的石油烃进入环境,造成土壤和地下水污染(杨明星等,2011;Farhad et al.,2000),其污染量大且面广,危害着人类的健康,给生态环境也造成了很大的危害(程金香等,2004;陆秀君等,2003)。在石油烃污染环境的修复技术中,微生物修复技术由于清洁、投资低和效益高等优点受到重视(黄艺等,2009)。
目前,国内外已有大量关于石油烃微生物降解方面的研究报道。根据微生物在代谢石油烃过程中是否分泌生物表面活性剂,可将其分为两大类:产生物表面活性剂菌株和不产生物表面活性剂菌株。有研究表明在石油泄漏污染场地,大部分石油烃吸附于土壤或其他介质上,或由于毛细力作用被包裹在介质孔隙中(Rober et al.,2006)。因此,在修复石油烃污染环境时,多采用表面活性剂增强修复效果(马玉新等,2005)。而生物表面活性剂是带有亲水及亲脂基团的两性化合物(丁立孝等,2003),具有增加有机污染物的溶解性、降低表面张力和临界胶束浓度、增加脂溶性污染物的生物可利用性(Banat,1995;刘桂萍等,2011;赵辉等,2010)等优点。目前对生物表面活性剂的研究,主要集中在产生物表面活性剂菌株的筛选(Albahry et al.,2012),而研究既产表面活性剂又具有降解石油烃能力的菌株的报道较为少见。曾有研究粘质沙雷氏菌Serratia marcescens、居植物柔武氏菌Raoultella planticola、克雷伯氏菌Klebsiella variicola和蜡状芽孢杆菌Bacillus cereus产物性质及降解性能的报道(花莉等,2013)。本文从石油污染土壤中筛选出一株既产生物表面活性剂又高效降解石油烃的菌株,对其产生的生物表面活性剂进行分析,并研究了菌株对石油烃的降解率效果,为石油烃污染的微生物修复提供基础理论和数据支持。
1 材料与仪器设备
1.1实验菌株
菌株来源:来自松原油田被石油污染的土壤表层,经富集筛选得到,于冰箱4 ℃保存备用。
1.2主要仪器设备
QBZY全自动表面张力仪(上海方瑞)、GC-2014气相色谱仪(日本岛津)、HZQ-QX全温振荡器(哈尔滨东联)、JMS-6700F场发射扫描仪、PTC-200型PCR仪(美国)、红外光谱仪等。
1.3培养基
发酵培养基:(NH4)2SO410.0 g,KCl 1.1 g,KH2PO43.4 g,K2HPO44.4 g,MgSO40.5 g,酵母膏0.5 g,微量元素溶液 5.0 mL,菜油 20 mL,pH 7.2~7.4,去离子水1 L,分别在锥形瓶中加入100 mL,密封,湿热灭菌20 min,温度为121 ℃。其中,微量元素溶液:ZnSO40.29 g,CaCl20.24 g,CuSO40.25 g,MgSO40.17 g,去离子水1 L。
无机盐液体培养基(单位:mg·L):(NH4)2SO42000,K2HPO41550,NaH2PO4850,MgCl2·6H2O 100,EDTA 10,FeSO4·7H2O 5.0,ZnSO4·7H2O 2.0,MnCl2·2H2O 1.0,CaCl2·2H2O 1.0,CoCl2·6H2O 0.4,NaMoO4·2H2O 0.2,CuSO4·5H2O 0.2。
LB培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,蒸馏水1000 mL,pH值7.2。
磷酸盐缓冲液(0.2 mol·L-1,pH值7.0):39 mL 0.2 mol·L-1NaH2PO4·2H2O溶液与61 mL 0.2 mol·L-1Na2HPO4·12H2O溶液混匀即得。
1.4样品总石油烃(Total petroleum hydrocarbons,简称TPH)测试分析方法
色谱条件:注入口SPL1;注入方式:切片;温度:280.0 ℃;载气:氮气·空气;流量控制方式:压力;压力:59.5 kpa;流量总量:37.7 mL·min-1;柱箱流量:1.65 mL·min-1;线速度:30.9 cm·s-1;清洗流量:3.0 mL·min-1;分流比:20.0;高压力注入:关闭;载气保存:关闭;分流器定位:关闭。柱箱的初始温度:80.0 ℃;平衡时间:3.0 min;总程序时间:31.50 min。柱箱信息包括柱箱名:Rtx-1;序列号:10124;薄膜厚度:0.25 mm;柱箱长度:30.0 m;内径:0.32 mm ID;柱箱最大温度:330 ℃。检测器通道为DFID1,温度:290.0 ℃;信号采集:是;采样速率:40 ms;停止时间:31.00 min;延迟时间:0.00 min;极性:+。进样体积:1.0 μL。
2 实验方法
2.1菌株的鉴定
(1)菌株的形态观察
取菌株用LB液体培养基培养至对数期,分别取10 mL培养液于离心管中,于4000 r·min-1离心10 min,沉淀用磷酸盐缓冲液清洗2次后,将菌体悬浮于磷酸盐缓冲液中。各菌株采用JMS-6700F场发射扫描仪进行电子显微镜扫描成像,观察菌株大小及形态。
(2)菌株生理生化实验
按(包木太等,2013)进行生理生化实验。
(3)16S rDNA的扩增与测序
16S rDNA基因的 PCR扩增引物包括上游引物:5'-CAGAGTTTGATCCTGGCT-3';下游引物:5'-AGGAGGTGATCCAGCCGCA-3'。
PCR扩增条件:94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共进行30个循环,最后72 ℃延伸10 min。取5 μL反应液与1 μL 6×上样缓冲液混合,在1%的琼脂糖凝胶中,于150 V电压下电泳检测。
引物合成及 PCR产物测序由上海生工生物工程技术有限公司完成。
2.2生物表面活性剂的提取及初步鉴定
(1)生物表面活性剂的提取
将发酵液于 8000 rpm、4 ℃条件下离心 20 min,重复两次后除去菌体;上清液用 12 mol·L-1的HCl调节pH至 2.0,出现絮状沉淀,4 ℃静置过夜;在10000 rpm、4 ℃条件下离心30 min,倒掉上清液,沉淀用少量的pH 2.0的HCl溶液全部洗下,再用1 mol·L-1的NaOH调节pH至 7.0,冷冻干燥,即得到表面活性剂粗品。
(2)生物表面活性剂的红外扫描(张翠竹等,2000)
取生物表面活性剂适量,KBr压片,用红外光谱仪进行红外分析。
2.3菌株石油烃降解效率
于6个100 mL的锥形瓶中分别加入50 mL的无机盐培养液、100 mg 0#柴油。其中1个样品不加菌作为空白对照,其余5个样品分别加入5 mL降解菌培养液(OD 600约为0.6),于120 rpm、30 ℃下振荡培养5 d。每隔1天取样,加入10 mL正己烷进行萃取。萃取后的有机相经无水硫酸钠干燥后,用GC测定总石油烃(TPH)残留量,计算石油烃的降解率。石油烃降解率计算公式如下:

3 结果与讨论
3.1菌体形态及生理生化特性
经电镜扫描,菌株B-6形态图见图1。生理生化实验结果见表1。由图1可知,菌株B-6为短杆菌,长度约为1.0 µm。

图1 B-6的扫描电镜照片Fig. 1 SEM photo of B-6

表1 菌株B-6的生理生化特征Table 1 Physiological and biochemical characteristics of strain B-6
3.2菌株分子鉴定
3.2.116SrDNA片段测序结果
菌株B-6通过PCR反应得到长1458 bp的片段,其测序结果如下。PCR扩增产物电泳图如图2。
如图2所示,菌株B-6的16S rDNA的扩增产物大小约1500 bp,测序结果表明其16S rDNA序列全长为1422 bp。
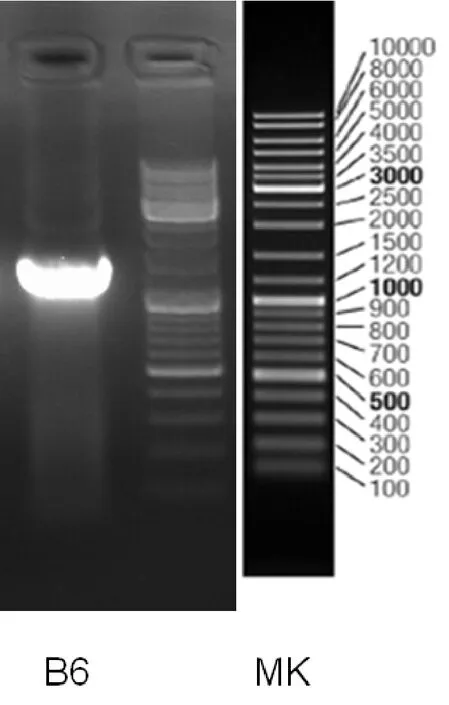
图2 菌株B-6的16S rDNA PCR扩增产物电泳图Fig. 2 Electrophoresis result of 16S rDNA PCR amplification production from strain B-6
3.2.2菌株16S rDNA系统发育分析
将菌株16S rDNA序列输入GenBank数据库中(http://www.ncbi.nlm.nih.gov),以BLAST软件进行序列同源性比较,选择同源性大于 98%的基因序列,采用Bioedit和MEGA5.0软件对B-6进行系统发育分析,用Neighbor-joining法构建系统发育树,500次重复检测,计算自引导值(Bootstrap)以估计系统进化树的置信度。结果如图3所示。
由图 3可知:B-6菌与 Pseudomonas otitidis(MCC10330)进化距离较近,并结合生理生化特性,判定 B-6菌株在分类学上属于假单胞菌属(Pseudomonas sp.)。已有的研究表明,假单胞菌既可产生物表面活性剂,又具有降解石油烃的特性,在石油烃污染环境修复中具有潜在的应用价值(章慧等,2013)。
3.3生物表面活性剂的鉴定
3.3.1表面活性物质
从B-6菌株发酵液提取的生物表面活性剂粗品为黄褐色粘稠状固体(如图 4所示),具有极大粘性并具有良好的水溶性,产量为2.19 g·L-1。
3.3.2红外光谱
菌株B-6的粗产品干燥后经KBr压片做FT-IR分析,结果见图5。
图5中的吸收带表明该分子中存在大量-OH、-CH2、C=C不饱和双键、C=O和C-O-C键,表明分子中存在环状内酯结构和糖苷键;羰基的存在,表明该生物表面活性剂为不饱和脂肪和芳香类化合物;存在酮和羰基之间的化合物吸收带。因此,初步断定该生物表面活性剂为不饱和糖脂类物质。
3.4菌株对石油烃的降解效果
由图 6可以看出,B-6菌株对石油烃的降解率在初始的2 d增加较快,3 d后降解较为缓慢。降解 5 d后,B-6菌株对石油烃的降解率达到99.13%。
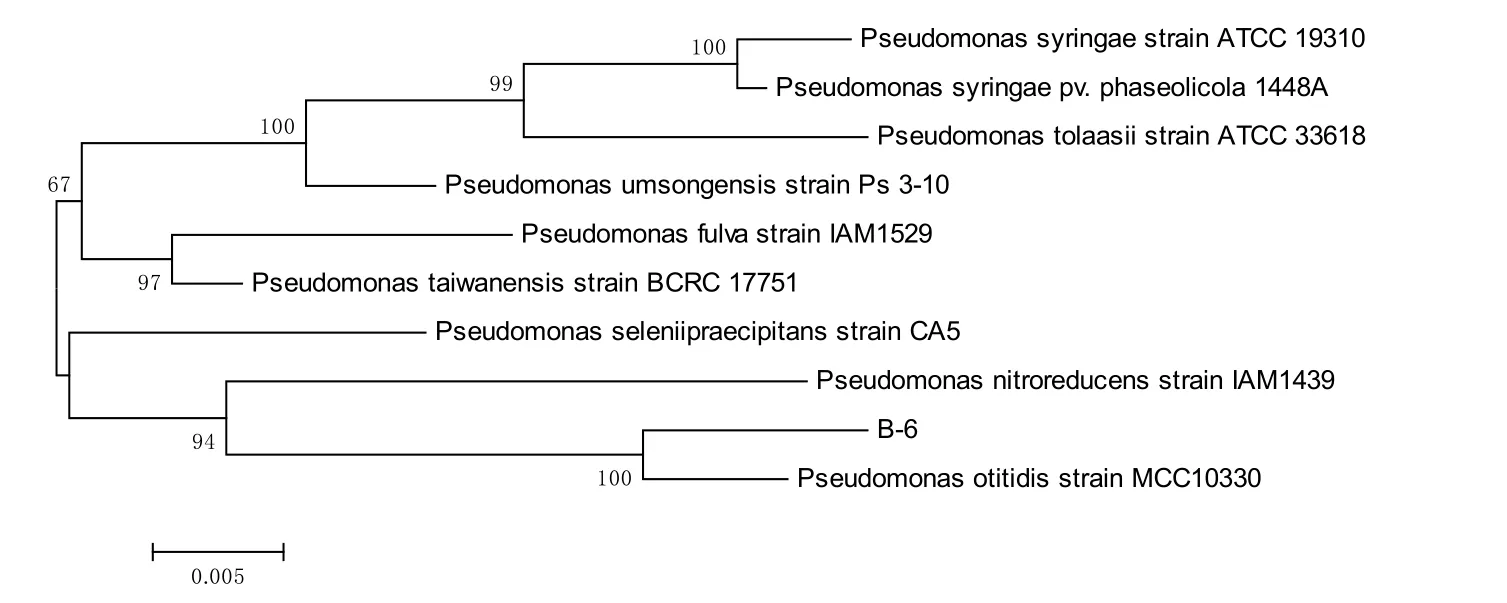
图3 菌株B-6基于16S rDNA的系统发育分析Fig. 3 Phylogenetic analysis of strain B-17 based on 16S rDNA gene sequences

图4 生物表面活性剂粗品Fig. 4 Biosurfactant crude products

图5 生物表面活性剂的红外吸收光谱Fig. 5 Results of biosurfactant analysis by FT-IR spectrogram
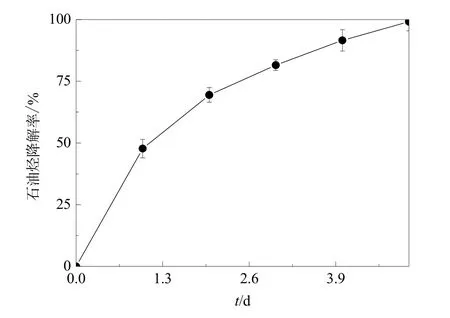
图6 菌株对石油烃的降解率曲线Fig. 6 Petroleum hydrocarbon degradation rate curve of the strain
4 结论
从石油污染土壤中分离出的B-6菌株经形态特征、生理生化试验及16S rDNA序列分析,鉴定为Pseudomonas sp.。其所产的生物表面活性剂经红外光谱分析为糖脂类生物表面活性剂。菌株对石油烃的降解率在5 d后达到99.13%。在实际石油烃污染环境的修复中,可以通过添加该菌种降解石油烃,同时该菌代谢产生的表面活性剂可增强石油烃污染的修复效果。
ALBAHRY S N, ALWAHAIBI Y M, ELSHAFIEAl A E, et al. 2012. Biosurfactant production by Bacillus subtilis B20 using date molasses and its possible application in enhanced oil recovery [J]. International Biodeterioration & Biodegradation, 8(1): 1-6.
BANAT I M. 1995. Bioproduction and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review [J]. Bioresource Technology, 51(1): 1-12.
FARHAD NADIM, GEORGE E HOAG, LIU SHI LI, et al. 2000. Detection and remediation of soil and aquifer systems contaminated with petroleum products: an overview [J]. Journal of Petroleum Science and Engineering, 26(1-4): 169-178.
ROBER T ANDERSON. 2006. DOE. Genomics: Applications to in situ subsurface bioremediation [J]. Remediation Journal, 17(1): 23-38.
包木太, 张金秋, 张娟, 等. 2013. 产糖脂类生物表面活性剂菌株鉴定及发酵条件优化[J]. 环境工程学报, 7(1): 365-370.
程金香, 马俊杰, 王伯铎, 等. 2004. 石油开发工程生态环境影响分析与评价[J]. 环境科学与技术, 27(6): 64-65.
丁立孝, 何国庆, 孔青, 等. 2003. 微生物产生的生物表面活性剂及其应用研究[J]. 生物技术通报, 13(5): 52-54.
花莉, 洛晶晶, 彭香玉, 等. 2013. 产表面活性剂降解石油菌株产物性质及降解性能研究[J]. 生态环境学报, 22(12): 1945-1950.
黄艺, 礼晓, 蔡佳亮. 2009. 石油污染生物修复研究进展[J]. 生态环境学报, 18(1): 361-367.
刘桂萍, 刘巍巍, 刘文杰, 等. 2011. 生物表面活性剂产生菌的筛选及培养条件优化[J]. 环境保护科学, 37(6): 12-15.
陆秀君, 郭书海, 孙清, 等. 2003. 石油污染土壤的修复技术研究现状及展望[J]. 沈阳农业大学学报, 34(1): 63-67.
马玉新, 史风梅, 袁家淼. 2005. 水-土环境有机污染表面活性剂增效修复技术[J]. 青岛大学学报(工程技术版), 20(4): 87-94.
杨明星, 杨悦锁, 曹玉清, 等. 2011. 包气带土壤对石油烃的截留作用研究[J]. 环境污染与防治, 33(3): 52-57.
张翠竹, 张心平, 梁凤来, 等. 2000. 一株地衣芽孢杆菌产生的生物表面活性剂[J]. 南开大学学报(自然科学版), 33(4): 41-45.
章慧, 郭楚玲, 卢桂宁, 等. 2013. 具有产表面活性剂功能石油降解菌的筛选及其发酵条件优化[J]. 农业环境科学学报, 32(11): 2185-2191.
赵辉, 闫华晓, 杨腾, 等. 2010. 高效生物表面活性剂产生菌筛选及其性质研究[J]. 生物技术通报, 20(4): 76-78.
Identification of A Surfactant-producing and Petroleum Hydrocarbon Degrading Strain and Its Degradation Efficiency
LIU Hong1, WANG Hang2, WANG Xuege3, LIU Na2*, WEN Gang4, FU Jing1, JIAN Yinghong1
1. School of Resources and Environment Engineering, Jilin Institute of Chemical Technology, Jilin 132022, China; 2. College of Environment and Resources, Jilin University, Changchun, 130021, China; 3. Songliao institute of water environmental science, Changchun 130021, China; 4. College of Biology and Food Engineering, Jilin Institute of Chemical Technology, Jilin 132022, China
A great amount of petroleum hydrocarbons inevitably enter the environment as a result of oil leakage in oil exploitation, transport, production and processing, which lead to soil and groundwater contamination. In oil contaminated sites, most of petroleum hydrocarbons are adsorbed on soil or other medium and wrapped in pore medium by capillary force. Surfactant can be employed to enhance efficiency in remediation of petroleum hydrocarbons pollution. There exists biosurfactant- producing microbes which are capable of degrading petroleum hydrocarbons and surfactants can be produced in its metabolic, which promote the oil emulsion, improve the dispersion degree of oil, increase contact between strain and oil droplet, improve the microbial degradation of petroleum hydrocarbons and strengthen the remediation effect. A biosurfactant-producing stain designated as B-6 which was capable of degrading petroleum hydrocarbons was screened out from crude oil-contaminated soil. The strain was identified based on morphological characteristics, physiological and biochemical test and 16s rDNA sequence analysis. The characteristics of surfactant producing and petroleum hydrocarbons biodegradation were studied. The results showed that the strain was preliminary identified as Pseudomonas sp. and the crude biosurfactant produced was tan, viscous solid with yield 2.19 g·L-1. Infrared spectrum analysis indicated that glycolipid biosufactant was produced by strain B-6 in its metabolic process. In biodegradation of petroleum hydrocarbons, it revealed that petroleum hydrocarbon degradation rate of the strain was up to 99.13% after the strain incubated in a rotary shaker at 30 ℃ and 120 r·min-1for 5 days and initial concentration of petroleum hydrocarbons was 2 000 mg·L-1.
biosurfactant production; petroleum hydrocarbons; degradation; identification.
10.16258/j.cnki.1674-5906.2015.12.017
X172
A
1674-5906(2015)12-2035-05
国家自然科学基金项目(41302185)
刘虹(1980年生),女,副教授,博士,主要从事环境污染生物修复研究。E-mail: wo_zhao_lh@163.com *通信作者:刘娜(1977年生),女,教授,博士生导师,主要从事环境污染生物修复研究。E-mail: liuna@jlu.edu.cn
2015-11-05
引用格式:刘虹, 王航, 汪雪格, 刘娜, 温钢, 付净, 翦英红. 一株既产表面活性剂又高效降解石油烃菌株的鉴定及降解效果[J]. 生态环境学报, 2015, 24(12): 2035-2039.

