磁共振扩散加权成像在家兔肝纤维化分期的诊断价值
邓乾华,阮继银,江锦赵,冯飞,谢家钧,邹立秋*
1.北京大学深圳医院医学影像科,深圳 518036
2.香港大学深圳医院放射科,深圳518053
肝纤维化(liver fi brosis)是各种致病因素引起肝细胞炎症反应后组织修复、肝内结缔组织异常增生及细胞外基质过度沉积引起慢性肝脏损害,最终导致肝硬化及其并发症。如果疾病早期给予抗纤维化治疗,可以减缓或逆转肝纤维化的进程。
目前,肝脏穿刺活检仍是监测和量化肝纤维化的“金标准”[1-2]。但是,它是一种创 伤性的检查方法,存在着自身的局限性和风险(致死率0.01%~0.1%)。肝纤维化时,细胞外胶原和蛋白多糖等大分子沉积,导致水分子在肝实质内扩散受限。磁共振扩散加权成像(diffusion weighted imaging,DWI)正是以突出水分子扩散运动为图像对比的成像方法,可反映活体组织结构的微环境[2-4],但临床上一直未得到广泛的应用。本研究拟通过测量兔肝纤维化模型不同分期的DWI量化指标——表观弥散系数(apparent diffusion coefficient,ADC值),探讨D WI在肝纤维化分期诊断中的价值。
1 材料与方法
本研究经医院动物伦理委员会审查批准。
1.1 动物模型制作
新西兰大白兔60只,雄性,6月龄,平均体重(2.66±0.126)kg,随机分成HF组(n=32只)、对照组(n=16只)、补充组(n=12只)。兔检疫合格后,将100%CCl4与橄榄油按体积比为1∶1配成50%的CCl4油溶液。HF组和补充组兔在颈部及背部皮下注射50%的CCl4油溶液,第1~3周剂量为0.1 ml/kg。根据动物状态每周注射1~2次,第3~6周调整剂量为0.2 ml/kg,6~8周调整为0.3 ml/kg,正常对照组兔颈部皮下注射生理盐水溶液。分别在注射50% CCl4第4、5、6、10周从模型组随机选取8只HF组兔和4只正常对照组兔进行MR扫描。当HF组有动物死亡时,用补充组动物随机进行补充,确保每组8只实验兔。
1.2 MR-DWI检查
采用高场3.0 T Siemens Spectra扫描机,采用聚能膝关节线圈。扫描前3%戊巴比妥钠以0.1 ml/kg经耳缘静脉注射进行全身麻醉。兔取仰卧位,腹部加压固定,包括肝脏轴位常规序列及轴位DWI序列。
常规序列包括:轴位T1WI:TR 165 ms,TE 2.9 ms,FOV 160 mm×140 mm,矩阵256×168,层厚5 mm,层间距1 mm;轴位T2WI:TR 4500 ms,TE 82 ms,FOV 160 mm×120 mm,矩阵256×144,层厚5 mm,层间距1 mm。
DWI扫描及图像后处理:采用SE-EPI序列,b值施加在X、Y、Z轴3个方向上,b值分别取50 s/mm2、400 s/mm2、800 s/mm2。扫描参数:TR 3000 ms,TE 67 ms,层厚5 mm,层间距1 mm,矩阵128×128,FOV 136 mm×180 mm。使用Syngoview软件对DWI图像进行后处理,每只家兔在ADCmap图连续3个层面,避开大血管和胆管,每层选取5个兴趣区,测量ADC值,取平均值。
1.3 病理学检查
MRI扫描后立即气体栓塞法处死兔,取兔肝脏,10%甲醛固定,行HE、Masson胶原纤维和网状纤维染色。肝脏纤维化程度采用Scheuer分期[5],即:S0为无纤维化;S1为无汇管区扩大纤维化及局限窦周纤维化;S2为汇管区周围纤维化或纤维间隔形成,小叶结构保留;S3为大量纤维间隔形成伴小叶结构紊乱,无肝硬化;S4为可能的或肯定伴有肝硬化形成。
1.4 统计学分析
采用SPSS 19.0软件进行统计学分析。采用单因素方差分析比较不同病理分期和ADC值均数之间差异,方差分析前对各组数据进行Levene方差齐性检验。P<0.05为差异有统计学意义。采用Spearman相关性分析研究各期ADC值均数与HF病理分期之间的相关性。运用受试者工作特征曲线(receiver operating characteristic curve,ROC)比较DWI诊断HF病理分期的价值。P<0.05为差异有统计学意义。将实验兔根据病理结果分为不同的组群:S0:S1-2-3-4(≥S1),S0-1:S2-3-4(≥S2),S0-1-2:S3-4(≥S3)和S0-1-2-3:S4(S4)。比较DWI鉴别不同组群的曲线下面积(AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 组织病理学结果
HF组兔第5周2只、第6周5只由于急性肝坏死、肝破裂出血、全身衰竭等原因死亡,由补充组随机补充。16只对照组中,1只病理检查出现肝纤维化,Scheuer分期结果显示:S0期15只,S1期8只,S2期8只,S3期8只,S4期8只(图1、2)。
2.2 DWI
HF各分期的平均ADC值(×10-3mm2/s)为S0:1.392±0.29,S1:1.247±0.27,S2:1.381±0.29,S3:1.032±0.20,S4:0.932±0.23。随HF级别的升高,平均ADC值相应降低。不同HF病理分期之间ADC值存在明显差异(F=5.344,P<0.005)。但是S0、S1和S2三者之间以及S3和S4之间ADC值无明显差异(P>0.1)。ADC值与HF病理分期之间存在明显相关性(r=-0.630,P<0.001;图3)。
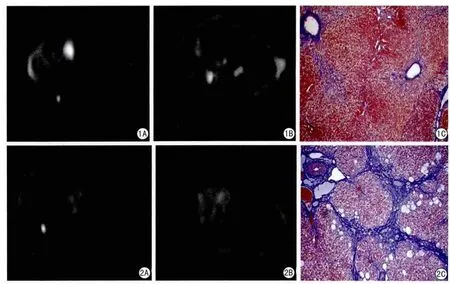
图1 肝纤维化S2期。A:DWI,b=800 s/mm2;B:ADC图,ADC=1.216×10-3 mm2/s;C:Masson染色病理图片( ×100)图2 肝纤维化S4期。A:DWI,b=800 s/mm2;B:ADC图,ADC=0.757×10-3 mm2/s;C:Masson染色病理图片( ×100)Fig.1 S2 of liver fi brosis.A:DWI,b=800 s/mm2; B:ADC mapping,1.216×10-3 mm2/s; C:picture of Masson staining(×100).Fig.2 S4 of liver fi brosis.A:DWI,b=800 s/mm2; B:ADC mapping,ADC=0.757×10-3 mm2/s;C:picture of Masson staining( ×100)
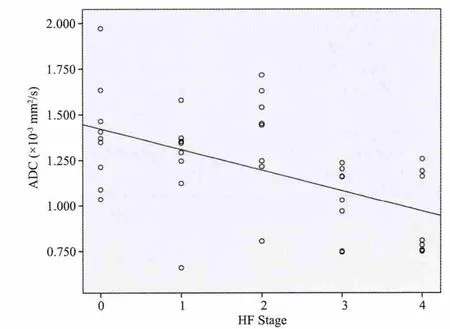
图3 肝脏ADC值与HF病理分期明显负相关Fig.3 Scatterplot shows the relationship between the ADC value and HF stages.The ADC values inversely correlated with HF stages.

表1 ADC值不同肝纤维化分期的诊断价值Tab.1 Diagnostic value of ADC values at different HF stages
2.3 ROC曲线分析
ADC值肝纤维化的曲线下面积(AUC)≥S1:0.712;≥S2:0.699;≥S3:0.867;S4:0.795。ADC值鉴别各组群的阈值、敏感性、特异性、阳性预测率(PPV)及阴性预测率(NPV)见表1。
3 讨论
HF是各种病因导致的慢性肝损伤向肝硬化发展的必然病理过程,病理上主要表现为肝窦毛细血管化与肝小叶内以及汇管区纤维化。如果能够早期诊断HF,为临床阻断HF进展、减轻甚至逆转HF、改善预后提供帮助。目前,肝穿刺活检是HF病理分期的“金标准”,但该技术作为一种有创检查,会引起疼痛、甚至危及生命,且肝穿活检存在一定的取样误差(取样长度一般在2.5 cm),由于整个肝脏纤维化是不一致的,肝穿刺活检对HF病理分期存在一定的误判。因此运用无创检查手段对HF进行评价,对病情的监测、疗效观察具有重要价值。MRI是迄今为止肝病诊断最主要、最准确的检查手段之一[5-7]。理论上,DWI可反映生物组织内水分子布朗运动,它反映毛细血管床的微循环(或微灌注)、扩散。肝纤维化对时内胶原纤维沉积、胶原纤维内水分子少并与其紧密结合,通过测量ADC值,可以评估整个肝脏的肝纤维化程度[4,8-9]。较多的研究结果已表明,水分子在纤维化肝组织中扩散减弱,ADC值出现有意义的下降[10-11]。
本研究显示不同HF病理分期之间ADC值存在明显差异。DWI在诊断早期肝纤维化S1、S2期的敏感性分别在75%、79%。扫描和数据分析简便可行,对已肝脏穿刺活检的患者可采用DWI进行疗效观察及复查。但是,S0、S1和S2三者之间以及S3和S4之间ADC值无明显差异(P>0.1)。
文献报道肝纤维化的ADC值测量受到与血管相关的扩散程度D值和与毛细胞血管床相关的f值影响,一般较低的b值(<200 s/mm2)主要反映实质的微量灌注,较高的b值(250~1000 s/mm2)可较好地反映扩散情况而减少血流灌注的影响[8,12-14],但随着b值的增高,图像质量下降影响测量。有文献建议取b≥750 s/mm2可计算出更为准确的ADC值[14-16]。本研究所得ADC值通过b=50 s/mm2、800 s/mm2计算得出。
本研究存在的不足主要有:研究对象为实验动物,无法屏气扫描,只能加压抑制腹部呼吸运动伪影,所以图像质量稍差。CCl4诱导兔肝纤维化模型,与人体合并肝基础病变所致的肝纤维化可能存在不同。人体肝纤维化不同分期间的ADC值差异仍需要进一步深入研究。
[References]
[1]Kanwal F,Hoang T,Kramer JR,et al.Increasing prevalence of HCC and cirrhosis in patients with chronic hepatitis C virus infection.Gastroenterology,2011,140(4):1182-1188.
[2]Talwalkar JA,Yin M,Fidler JL,et al.Magnetic resonance imaging of hepatic fi brosis:emerging clini cal applications.Hepatology,2008,47(1):332-342.
[3]C Aubé,P X Racineux,J Lebigot,et al.Diagnosis and quantifi cation of hepatic fi brosis with diffusion weighted MR imaging:preliminary results.J Radiol,2004,85(3):301-306.
[4]Lewin M,Poujol-Robert A,Boelle PY,et al.Diffusion-weighted magnetic resonance imaging for the assessment of fi brosis in chronic hepatitis C.Hepatology,2007,46(3):658-665.
[5]Annet L,Peeters F,Abarca-Quinones J,et al.Assessment of diffusion weighted MR imaging in liver fi brosis.J Magn Reson Imaging,2007,25(1):122-128.
[6]Martínez SM,Crespo G,Navasa M,et al.Noninvasive assessment of liver fi brosis.Hepatology,2011,53(1):325-335.
[7]Guo QY,Shi Y.Applications and advances of magnetic resonance imaging in diagnosing liver disease.Chin J Magn Reson Imaging,2014,5(S1):10-14.郭启勇,石喻.磁共振成像在肝病的应用及进展.磁共振成像,2014,5(S1):10-14.
[8]Taouli B,Tolia AJ,Losada M,et al.Diffusion-weighted MRI for quantification of liver fibrosis:preliminary experience.AJR Am J Roentgenol,2007,189(4):799-806.
[9]Patel J,Sigmund EE,Rusinek H,et al.Diagnosis of cirrhosis with intravoxel incoherent motion diffusion MRI and dynamic contrastenhanced MRI alone and in combination:preliminary experience.J Magn Reson Imaging,2010,31(3):589-600.
[10]Pandharipande PV,Krinsky GA,Rusinek H,et al.Perfusion imaging of the liver:current challenges and future goals.Radiology,2005,234(3):661-673.
[11]Hagiwara M,Rusinek H,Lee VS,et al.Advanced liver fibrosis:diagnosis with 3D whole liver perfusion MR imaging initial experience.Radiology,2008,246(3):926-934.
[12]Ichikawa T,Haradome H,Hachiya J,et al.Diffusion-weighted MR imaging with single-shot echo-planar imaging in the upper abdomen:preliminary clinical experience in 61 pa tients.Abdom Imaging,1999,24(5):456-461.
[13]Ozkurt H,Keskiner F,Karatag O,et al.Diffusion Weighted MRI for Hepatic Fibrosis:Impact of b-Value.Iran J Radiol,2014,11(1):3555.
[14]Liu ZY,Chen X,Yan LF,et al.Effect of b value on ADC value and its repeatability in hepatic magnetic resonance diffusion weighted imaging.Chin J Med Imaging,2013,5(16):370-373.刘再毅,陈鑫,颜丽芬,等.b值对肝脏磁共振扩散加权成像ADC值及其可重复性和影响.中国医学影像学杂志,2013,5(16):370-373.
[15]Huang YY,Jin J,Tang XL,et al.Comparative study of DWI and Fibroscan in diagnosis of liver fibrosis.Chin J Magn Reson Imaging,2013,4(4):261-265.黄勇跃,金军,汤小莉,等.扩散加权成像和瞬时弹性成像在肝纤维化诊断价值中的对比研究.磁共振成像,2013,4(4):261-265.
[16]Pasquinelli F,Belli G,Mazzoni LN,et al.MR-diffusion imaging in assessing chronic liver diseases:does a clinical role exist?.Radiol med,2012,117(2):242-253.

