一株源于红树林根际土壤的枯草芽孢杆菌产淀粉酶条件及酶学性质研究
马军++魏明婉++王耀嵘++李麒麟++陈燕

摘 要 从三亚红树林保护区中筛选出一株产淀粉酶枯草芽孢杆菌,通过改变培养温度、初始pH值和盐浓度等因素研究该菌株的最适产酶条件,同时也分析了该菌株所产粗酶的热稳定性及pH稳定性。结果表明:该菌株属于中温产酶菌,产淀粉酶的最适温度为40℃,最适pH值为8,盐耐受能力可达到4%。酶学性质分析发现,该菌株产生的淀粉酶在40℃保温150 min后仍有70%以上的相对酶活力,在pH为9的环境中孵育1 h,相对酶活力可达到90%以上。这些结果表明,该产淀粉酶菌株对热带地区海水环境具有较好的适应性,其作为消化酶类饲料添加剂具有广阔的应用前景。
关键词 红树林 ;枯草芽孢杆菌 ;酶学性质 ;淀粉酶
分类号 TQ925
Amylase-producing Conditions and Enzymatic Properties of
Bacillus subtilis from Mangrove Rhizosphere Soil
MA Jun WEI Mingwan WANG Yaorong LI Qilin CHEN Yan
(College of Tropical Biology and Agronomy, Qiongzhou University, Sanya, Hainan 572022)
Abstract A Bacillus subtilis strain which could produce amylase was isolated from mangrove rhizosphere soil in Sanya. The effects of culture conditions on the enzyme producing ability of strain were studied with different culture temperature, initial pH and salt concentration. In addition, The properties of amylase excreted by this strain were analyzed by the thermal stability and pH stability. The results showed that the strain was belonged to the mesophilic enzyme producing bacteria, the amylase-producing optimum temperature was 40℃, the optimal pH value was 8, and the salt tolerance ability could reach 4%. The study on enzymatic properties showed that the amylase produced by this strain was still 70% relative enzyme activity after 150 min at 40℃, and the relative enzyme activity of the amylase could reach more than 90% after 1h in the pH=9 environment. It suggested that the amylase producing strain had better adaptability for tropical marine environment, and had broad application prospects as a digestive enzyme feed additive.
Keywords mangrove ; Bacillus subtilis ; enzymatic properties ; amylase
红树林位于热带、亚热带陆海交汇的潮间带,由于其独特的地理环境,常年遭受海水周期性浸淹、河口有机质沉积及落叶腐败作用等影响,红树林形成了独特的生态系统。在红树林内,植物凋落与动物残体非常丰富,这为孕育特殊的微生物提供了特殊的营养与生境,同时也为分离可分泌蛋白酶、淀粉酶、纤维素酶、几丁质酶等酶类的微生物类群提供了必要的资源基础[1-2]。
淀粉酶广泛存在于动植物和微生物中,是用途最广、产量最大的酶制剂产品之一。淀粉酶种类繁多、特点各异,可应用于酿酒、食品、医药、纺织、饲料等多种领域,具有广阔的应用前景及市场开发潜力。由于枯草芽孢杆菌具有较强的环境抗逆性,其不但能够产生淀粉酶、蛋白酶、纤维素酶、果胶酶等[3],还能够提高动物免疫力[4],促进动物营养消化吸收[5],拮抗多种病原体[6],是中国农业部公布的可直接用于饲喂动物且允许使用的益生菌菌种之一。因此,筛选产淀粉酶枯草芽孢杆菌,并将其作为饲料添加剂分解饲料中含淀粉的营养物质,帮助养殖动物充分吸收和利用饲料营养,已成为饲料行业的一个新突破点。
随着水产养殖业集约化程度的不断提高,高效利用饲料营养,减少残存饲料堆积和排放,已经成为改善养殖水质恶化的新途径。枯草芽孢杆菌能通过产生大量的淀粉酶、蛋白酶、脂肪酶等胞外酶来分解转化饲料营养物质,从而产生小分子有机酸、氨基酸、糖类等物质,促进养殖动物的营养吸收和利用,这为水产养殖业的健康发展提供了新的动力。本研究对从红树林根际土壤中分离出的一株产淀粉酶芽孢杆菌进行淀粉酶学性质分析,以期为该株菌的进一步研究及其在海水养殖饲料添加剂中的应用提供参考依据。
1 材料与方法
1.1 材料
菌株由本实验室从三亚市白鹭公园红树林保护区根际土壤中分离得到,编号为JCHL0207(KP834902)。endprint
淀粉培养基(固体):可溶性淀粉1%+蛋白胨1%+葡萄糖0.5%+NaCl 0.5%+牛肉膏0.5%,琼脂粉0.8%,用去离子水配制,pH 7.0,于121℃中蒸汽灭菌20 min。
种子培养基:牛肉膏0.5%+蛋白胨1%+氯化钠0.5%,用去离子水配制,pH 7.0~7.4,于121℃下蒸汽灭菌20 min。
发酵培养基:玉米粉1%+麸皮1%+酵母粉1%+氯化钠0.5%+磷酸二氢钾0.2%+磷酸氢二钠0.2%,用去离子水配制,pH 7.0,于121℃下蒸汽灭菌20 min。
1.2 方法
1.2.1 粗酶液的制备
将菌株接种到种子培养基中,于30℃培养18~24 h;以1%的接种量接种到基本发酵培养基中,于130 r/min、30 ℃摇床中培养48 h。菌液以5 000 g的离心力离心2 min,上清液即为待测粗酶液。
1.2.2 淀粉酶水解圈测定
用滴种法将菌液接种于淀粉培养基上并培养48 h,采用碘液染色,在菌落周围若有透明圈产生则证明芽孢杆菌产淀粉酶。用游标卡尺分别测量透明圈直径和菌落直径,根据两者比值大小初步确定淀粉素酶活性的高低。
1.2.3 酶活力测定
淀粉酶活力测定参考DNS法[7-9]。取1 mL粗酶液,加1 mL 2%的可溶性淀粉及3 mL去离子水,于60℃水浴中预热5 min,加入1 mL浓度为0.1 mol/L的柠檬酸缓冲液(pH=6.0),于60 ℃水浴中保温30 min;加入3,5-二硝基水杨酸1.5 mL,置于沸水中5 min,迅速冷却,加蒸馏水定容至20 mL,空白对照采用加酸钝化的粗酶液,用分光光度计分别测定OD520nm值。
酶活力根据下式计算:
酶活力=(N×A)/(K×t×V)
A为520 nm处的吸光度;K为葡萄糖标准曲线的斜率;t为反应时间;V为参与反应的酶液体积;N为酶液的稀释倍数。
酶活定义:在60℃,pH为6.0的条件下,单位体积粗酶液30 min内将淀粉转化成1 mg麦芽糖所需的酶量为一个单位酶活,用MMU表示。
1.2.4 培养条件对菌株产酶能力的影响试验
(1)温度对菌株产酶能力的影响。以1%的接种量将该菌株接种于发酵培养基中,分别于20、30、40、50、60℃下培养48 h后,以500×g离心10 min,收集上清粗酶液进行酶活力测定。
(2)初始pH对菌株产酶能力的影响。以1%的接种量将该菌株接种于发酵培养基中,分别调整发酵培养基初始pH值为5、6、7、8、9、10和11,于30℃培养48 h后,以500×g离心10 min,收集上清粗酶液进行酶活力测定。
(3)盐浓度对菌株产酶能力的影响。以1%的接种量将该菌株接种于含不同浓度氯化钠的发酵培养基中,氯化钠浓度分别为0、1%、2%、3%、4%、5%、6%、7%、8%、9%和10%,培养基初始pH为7,于30℃培养48 h后,以500×g离心10 min,收集上清粗酶液进行酶活力测定。
1.2.5 酶稳定性和pH稳定性测定
酶稳定性测定。以1%的接种量将菌株接种于发酵培养基中,于30 ℃培养48 h后,以500×g离心10 min,收集上清粗酶液,将粗酶液分别孵育于40、60、80℃的水浴锅中,保温不同时间后,直接测定残余酶的活力,将不经保温的酶活设为100%,计算相对酶活力。
pH稳定性测定。以1%的接种量将菌株接种于发酵培养基中,于30℃培养48 h后,以500×g离心10 min,收集上清粗酶液,用稀盐酸或氢氧化钠将粗酶液的pH值分别调至5、6、7、8、9、10,在室温下放置1 h后,测定残余酶的活力,以离心后收集的上清粗酶液的酶活力为100%,计算相对酶活力。
2 结果与分析
2.1 淀粉酶水解圈测定
采用碘液染色法对菌落及其周围进行染色。如图1所示,菌落周围都出现了明显的水解圈,分别对水解圈直径及菌落直径进行测量,重复3次,通过水解圈直径与菌落直径的比值,得出该菌株淀粉酶水解能力为(4.69±0.02)。
2.2 培养条件对菌株产酶能力的分析
2.2.1 培养温度对菌株产酶能力的影响
培养温度是影响菌株产酶能力最重要的因素之一。由图2可知,当培养温度为20~40℃时,菌株产生的淀粉酶活力随温度升高而上升,在40℃时,淀粉酶活力最高,之后随温度升高而快速降低。因此该菌株产淀粉酶的最适培养温度为40℃,且在20~40℃都有较高的产酶能力,培养温度高于40℃时,菌株产酶能力受到较强的抑制作用。
2.2.2 初始pH值对菌株产酶能力的影响
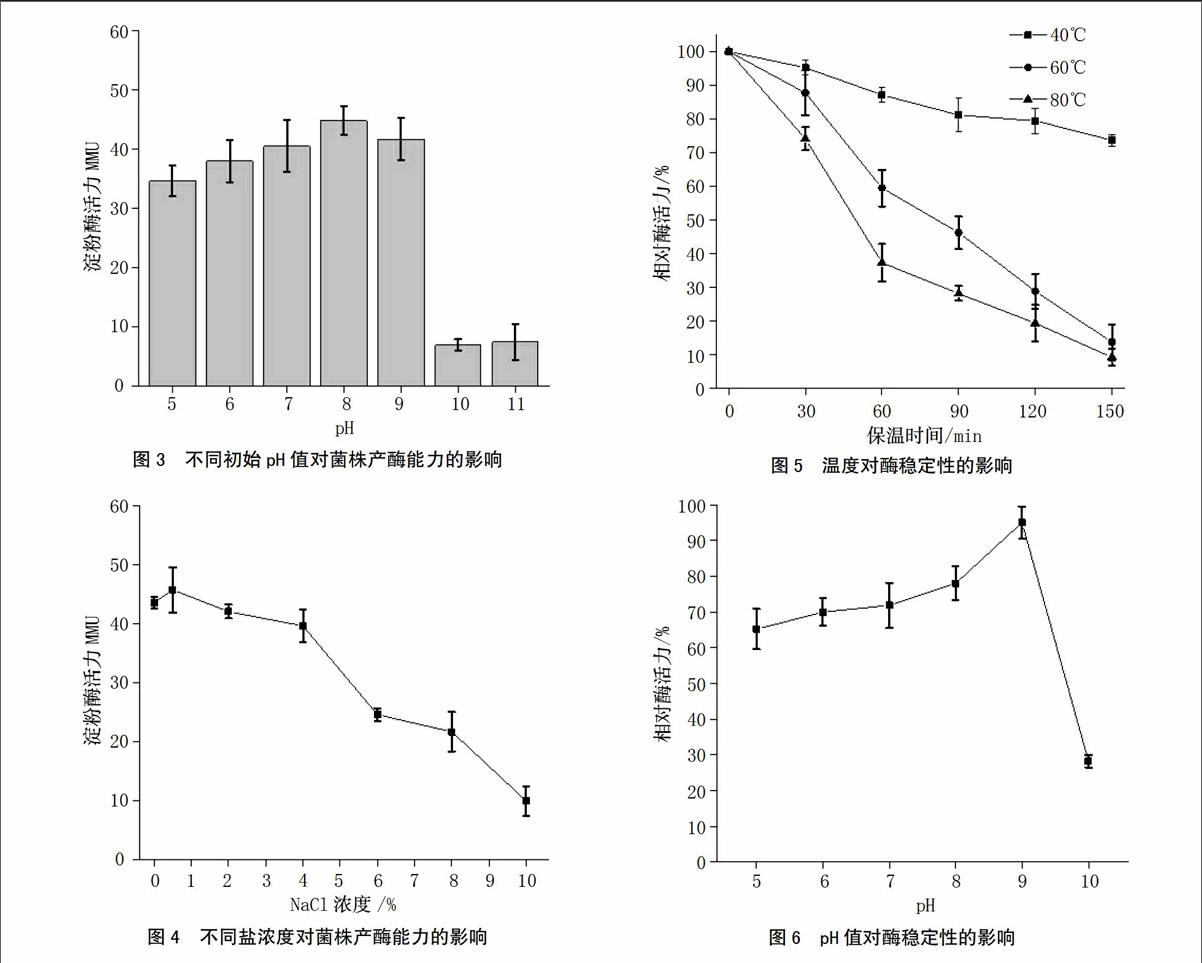
培养基的初始pH值对菌株的产酶能力具有一定程度的影响。由图3可知,当培养基初始pH在5~9时,菌株产生的淀粉酶活性都维持在30 MMU以上,其中pH为8时,所产生的酶活力达到40 MMU以上;当pH大于9时,酶活力明显降低至10 MMU以下。说明该菌株对pH值有一定的耐受范围,但较强的碱性环境不利于菌株产淀粉酶。
2.2.3 盐浓度对菌株产酶能力的影响
盐耐受能力直接影响到产酶芽孢杆菌产酶的稳定性,尤其是对于海水养殖业来说,菌株在盐浓度达到3.0%~3.5%时,仍然具有较强的产酶能力是将其应用于水产饲料添加剂的前提。从图4可知,盐浓度在0至4%的范围内,菌株所产的淀粉酶活力基本维持在40 MMU左右,下降平缓,有一定的耐受性;当盐浓度超过4%时,菌株所产的淀粉酶活力随着盐浓度的升高而快速下降;当盐浓度达到10%时,其所产淀粉酶的酶活力降低至10 MMU左右,但仍然具有一定程度的淀粉转化能力。endprint
2.3 酶学性质分析
2.3.1 酶的热稳定性分析
将粗酶液分别在40、60、80℃水浴锅中保温不同时间,以不经保温的酶活为100%,在60℃测定残余酶活。从图5可以看出,该淀粉酶在40℃时,随着保温时间的延长,酶活力变化幅度较小,保温150 min时仍有70%以上的相对酶活力,说明该酶在40℃环境下具有较高的热稳定性;在60、80℃分别保温150 h,酶活力下降迅速,残留酶活分别降低至13.7%和9.3%。说明该酶不适于高温下应用。
2.3.2 酶的pH值稳定性分析
由图6可知,该淀粉酶具有较广的pH耐受范围,在pH为5的环境下保存1 h后,相对酶活性仍然维持在60%以上;随着pH值的上升,相对酶活性也随之上升,在pH为9时,相对酶活性最高,达到90%以上;而当pH值大于9时,酶极容易失活,相对酶活性快速下降至30%左右。说明该淀粉酶主要耐受pH范围为5~9,不耐受pH值大于9的强碱性环境。
3 讨论
红树林介于陆地和海洋生态系统之间,由于常年受到周期性海水浸淹,红树林土壤高度盐责化、缺氧和高辐射的特性形成了独特而又丰富的微生物类群[10-11]。研究结果表明,细菌是红树林生态系统中最主要的类群,其中芽孢杆菌属分布比例较高,而真菌和放线菌在红树林土壤中分布相对较少[12]。目前,关于从红树林生态系统中获取的产淀粉酶微生物的研究主要集中于真菌和放线菌上[13-14],而关于产淀粉酶芽孢杆菌的研究还未见报道。
枯草芽孢杆菌是当今酶生产中应用最广泛的菌种之一,由于其具有产酶量高、种类多、安全性高等特点,在现代酶制剂生产中被广泛应用。大量研究表明,枯草芽孢杆菌能分泌植酸酶、蛋白酶、纤维素酶、淀粉酶、脂肪酶等十几种酶类[3],这些活性酶能降解饲料中的淀粉、多糖和蛋白质等营养物质,提高饲料的消化利用率,从而促进养殖动物的生长,提高生产性能[5]。目前,适用于海水养殖饲料添加剂的产酶菌株还相对少见,常见的都是从陆源土壤、养殖水、鱼体肠道等环境中分离的产酶微生物,这些菌株在偏碱性、盐度高的环境中产酶较不稳定,无法满足实际生产的需求。
本研究中所使用的菌株是从红树林根际土壤中筛选到的枯草芽孢杆菌(编号为JCHL0207),该菌株在pH为5~9的范围内,具有较为稳定的产酶能力,并且其产生的淀粉酶在该pH范围内具有较强的酶活性,说明该菌株具有较好的pH耐受范围,可适用于偏碱性的天然海水环境(pH值为7.9至8.4)。此外,研究还发现,该菌株在培养温度为20~40℃时,产酶能力随温度升高而增强,其最适产酶温度为40℃,并且该菌株所产生的淀粉酶在40℃的环境中也有较强的酶稳定性,保温150 min时,酶活性仅降低了30%左右。值得一提的是,该菌株具有较强的盐耐受能力,其在氯化钠浓度为0~4%的环境中仍然具有较为稳定的产酶能力,说明该菌株可适应热带地区海水养殖环境,其作为消化酶类饲料添加剂具有广阔的应用前景。
参考文献
[1] 刘 颖,洪 葵,庄 令,等. 红树林样品不经分离的微生物群体培养物生物活性研究[J]. 微生物学报,2007,47(1):110-114.
[2] 龙 寒,向 伟,庄铁城,等. 红树林区微生物资源[J]. 生态学杂志, 2005,24(6):696-702.
[3] 杨 峰,章亭洲. 枯草芽孢杆菌生物学特性的研究[J]. 饲料研究,2011,34(3):34-36.
[4] 沈文英,李卫芬,梁 权,等. 饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响[J]. 动物营养学报,2011,23(5):881-886.
[5] 王学东,呙于明,姚 娟,等. 芽孢杆菌在仔猪日粮中的应用效果初探[J]. 中国畜牧杂志,2008,44(21):46-48.
[6] 陈天游,董思国,田万红,等. 枯草芽孢杆菌活菌体外拮抗6种肠道致病菌的研究[J]. 微生物学杂志,2004,24(5):74-76.
[7] 赵 凯,许鹏举,谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含景的研究[J]. 食品科学,2008,29(8):534-536.
[8] 唐丽江,王振华,王 迪. 产淀粉酶芽孢杆菌高产菌株的筛选[J]. 安徽农业科学,2009,37(12):5 362-5 363,
5 371.
[9] 张应玖,朱学军,关 键,等. 一种新型淀粉酶的鉴定及其产酶菌株的筛选[J]. 微生物学通报,2002,29(5):38-41.
[10] 庄铁诚,林 鹏. 红树林凋落叶自然分解过程中土壤微生物的数量动态[J]. 厦门大学学报:自然科学版,1993,32(3):365-370.
[11] 张瑜斌,庄铁诚,杨志伟,等. 海南东寨港红树林土壤微生物初探[J]. 生态学杂志, 2001,20(1):63-64.
[12] 林 鹏,张瑜斌. 九龙江口红树林土壤微生物的类群及抗菌活性[J]. 海洋学报(中文版),2005,27(3):133-141.
[13] 周茂洪,赵肖为,周 林,等. 产淀粉酶的海洋曲霉菌的分离及酶学特性初步研究[J]. 海洋学研究,2007,25(3):59-65.
[14] 何 洁,张道锋,徐 盈,等. 印度洋红树林沉积物可培养海洋放线菌多样性及其活性[J]. 微生物学报,2012,52(10):1 195-1 202.endprint

