中考化学实验复习归类“四部曲”
朱娟英
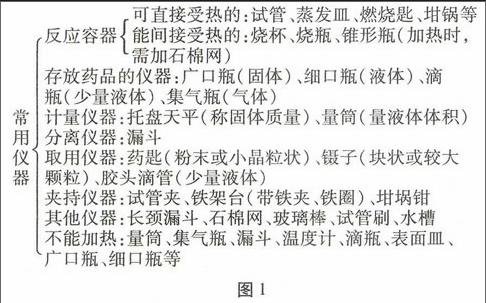

一、 一部曲——正确掌握常用实验仪器的名称和功能(如图1所示)
常用仪器
反应容器可直接受热的:试管、蒸发皿、燃烧匙、坩锅等
能间接受热的:烧杯、烧瓶、锥形瓶(加热时,
需加石棉网)
存放药品的仪器:广口瓶(固体)、细口瓶(液体)、滴
瓶(少量液体)、集气瓶(气体)
计量仪器:托盘天平(称固体质量)、量筒(量液体体积)
分离仪器:漏斗
取用仪器:药匙(粉末或小晶粒状)、镊子(块状或较大
颗粒)、胶头滴管(少量液体)
夹持仪器:试管夹、铁架台(带铁夹、铁圈)、坩埚钳
其他仪器:长颈漏斗、石棉网、玻璃棒、试管刷、水槽
不能加热:量筒、集气瓶、漏斗、温度计、滴瓶、表面皿、
广口瓶、细口瓶等
图1
二、二部曲——准确掌握常见实验基本操作
1.固体药品的取用
(1)块状固体或密度较大的金属颗粒用镊子夹取,并让其沿着容器壁缓缓滑到容器底部。
(2)粉末状或小颗粒状药品用药匙(或纸槽取用),量较少时用药匙的小端,较多时用大端。
(3)用过的药匙或镊子要立刻用干净的纸擦拭干净,以备下次再用。
2.液体药品的取用
(1)取用细口瓶里的液体药品时。先拿下瓶塞,倒放在桌上,标签朝向手心,防止残留的药液流下来腐蚀标签。
(2)取用一定体积液体药品可用量筒量取,读数时量筒必须放平,视线要跟量筒内液体的凹液面的最低处保持水平。
(3)使用滴管取用药品时要注意:取液后的滴管应保持橡胶头在上,不要平放或倒置,以防试液倒流,腐蚀橡胶头。滴管不能伸入试管或烧杯中,应把它悬空在上方,以免沾污滴管或造成试剂的污染。
3.托盘天平的使用
(1)称量前先把游码放在标尺的零刻度处,检查天平是否平衡。
(2)称量时把称量物放在左盘,砖码放在右盘(即左物右码)。
(3)称量完毕,应把砝码放回砝码盒中,把游码移回零处。
(4)干燥的药品放在洁净的纸上称量,易潮解的药品放在小烧杯等玻璃器皿中称量。
4.酒精灯的使用
(1)向酒精灯里添加酒精时,不能超过其容积的2/3。
(2)绝对禁止向燃着的酒精灯里添加酒精和用酒精灯引燃另一盏酒精灯,以免失火。
(3)用完酒精灯,必须用灯帽盖灭,不可用嘴去吹灭。
5.检查装置的气密性
把导气管的一端浸在水里,两手紧贴容器的外壁,如果导管口有气泡逸出,表明装置不漏气。
6.物质的加热
(1)要用酒精灯的外焰加热,因外焰温度最高。
(2)加热时,试管中液体不要超过试管容积的1/3,试管口不要对着自己和有人的方向。
(3)给固体物质加热,试管口应略向下倾斜。
7.仪器的洗涤
洗过的玻璃仪器内壁附着的水既不聚成水滴,也不成股流下时,表明仪器已洗干净。
三、三部曲——实验装置的安装、选择及操作
1.实验装置的安装顺序
实验装置的安装顺序如图2所示:
发生装置→
净化装置→
干燥装置→
收集装置→
吸收装置
图2
2.制取气体时各部分装置的选择依据
(1)发生装置:所用试剂的状态及反应条件。
(2)收集装置:气体的水溶性及相对空气的密度大小、是否与空气中的成分反应。
(3)净化装置:依据气体与杂质的性质不同,使杂质被吸收或转化成所需物质。
(4)尾气处理(吸收)装置:根据所制气体是否有毒或污染环境来确定是否要安装尾气处理装置。有毒物质可用溶液吸收或燃烧去除。
3.各装置总结
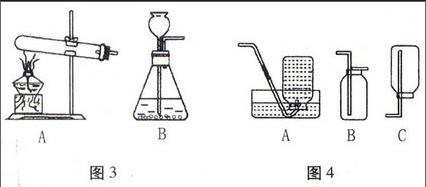
(1)气体发生装置(如图3所示)
A:固体+固体△气体
B:固体+液体气体(常温)
(2)收集装置(如图4所示)
A——排水法(气体不易或难溶于水)
B——向上排气法(气体密度比空气大)
C——向下排气法(气体密度比空气小)
图3图4
(3)气体的检验(如图5所示)
检验混合气体成分时,先检验水蒸气,后检验其他气体
甲——无水硫酸铜(白色→蓝色)——检验H2O
乙——铜(红色→黑色)——检验O2;(另:带火星木条复燃——O2)
丙——石灰水(澄清→浑浊)——检验CO2。(H2、CO可先转化,后检验)
(4)气体的除杂装置(如图5所示)
除去多种气体时,先除去其他气体,最后除去水蒸气
甲——无水硫酸铜——除去(吸收)H2O
甲——无水氯化钙——除去(吸收)H2O
甲——碱石灰(NaOH和CaO)——除去(吸收)H2O和CO2
乙——氧化铜——除去CO2中的CO;(转化)
乙——碳粉——除去CO中的CO2;(转化)
乙——铜——除去(吸收)氧气
丙——浓硫酸——除去(吸收)H2O
丙——氢氧化钠溶液——除去(吸收)CO2
丙——碳酸钠或碳酸氢钠溶液——除去CO2中的HCl(转化)
图5
四、四部曲——重要物质的制取、检验与收集
1.气体的制取与比较
氧气、氢气、二氧化碳的制取比较见表1。
表1
氧气氢气二氧化碳
药品氯酸钾和二氧化锰或高锰酸钾过氧化氢溶液与二氧化锰锌粒和稀硫酸(或稀盐酸)大理石(或石灰石)和稀盐酸
化学反应原理
反应物状态固体与固体混合固体与液体混合固体与液体混合固体与液体混合
反应条件加热不需加热不需加热不需加热
制得气体在水中的溶解性氧气不易溶于水氢气难溶于水二氧化碳能溶于水
制得气体的密度与空气的比较氧气密度比空气密度大氢气密度比空气密度小二氧化碳密度比空气密度大
收集方法排水法或向上排空气法排水法或向下排空气法向上排空气法
检验方法将带火星的木条插入集气瓶内,若复燃,说明是氧气。点燃该气体,检验其生成的产物。将气体通入澄清的石灰水,若其变浑浊,说明是二氧化碳
验满或验纯将带火星的木条靠近集气瓶口,若木条复燃,说明已收集满。用拇指堵住倒置已收集满氢气的试管,靠近火焰移开手指,若为“噗”的一声,说明已纯。将燃着的木条靠近集气瓶口,若木条熄灭,说明已收集满。
实验装置
2.实验用到的气体要求是比较纯净,除去常见杂质具体方法
(1)除水蒸气可用:浓流酸、CaCl2固体、碱石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)、生石灰等。
(2)除CO2可用:澄清石灰水(可检验出杂质中有无CO2)、NaOH溶液、KOH溶液、碱石灰等。
(3)除HCl气体可用:AgNO3溶液(可检验出杂质中有无HCl)、石灰水、NaOH溶液、KOH溶液。
除气体杂质的原则:用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或者生成新的杂质。
(收稿日期:2015-06-20)

