用“坐标系”突破高考酸碱反应问题
贾同全

酸碱反应是高中化学的重要知识点和核心考点,它在考查学生微粒观、定量观以及图表分析能力等方面有着不可替代的作用。在近几年的高考考题中,依托酸碱中和滴定结合坐标系考查的题目频频出现。
一、酸碱中和滴定的两种常见类型在坐标系中的变化曲线
1.强碱滴定弱酸型——用氢氧化钠溶液滴定醋酸
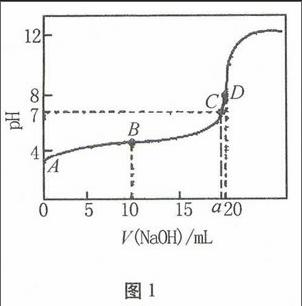
图1例1向20 mL 0.01 mol·L-1的醋酸溶液中逐滴加入0.01 mol·L-1的NaOH溶液,试分析滴定过程中溶液溶质的组成、溶液的酸碱性以及溶液中离子浓度大小的关系。
分析醋酸中滴加NaOH溶液,溶液中酸碱性的变化为酸性→中性→碱性,因此可建立如图1所示的NaOH溶液的加入变化量与溶液pH变化量之间坐标关系图。解题时应:
(1)把握准四个点:
A点:醋酸溶液点,溶质只有CH3COOH,pH<7,
c(H+)>c(CH3COO-)>c(OH-);
B点:n(CH3COOH)=n(CH3COONa)溶液点,pH<7,
c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
C点:溶液中性点,CH3COOH与CH3COONa的混合液,
pH=7,
c(CH3COO-)=c(Na+)>c(H+)=c(OH-);
D点:恰好完全反应点,溶质只有CH3COONa,pH>7
,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
(2)理清四段的变化:
在整个滴定过程中,溶液中只有四种离子,即Na+、CH3COO-、OH-、H+,且每种离子所带电荷数均为1,由电荷守恒关系c(Na+)+c(H+)=c(CH3COO-)+c(OH-),结合溶质的组成以及溶液的酸碱性就能确定每个阶段离子浓度大小的关系。
A-B段:溶质组成为CH3COOH和CH3COONa,n(CH3COOH)>n(CH3COONa),
pH<7,随NaOH溶液的加入,溶液中可能的离子浓度大小关系为:
c(H+)>c(CH3COO-)>c(OH-)>c(Na+) (加碱量很少);
c(H+)=c(CH3COO-)>c(OH-)=c(Na+);
c(CH3COO-)>c(H+)>c(Na+)>c(OH-);
c(CH3COO-)>c(H+)=c(Na+)>c(OH-);
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
B-C段:溶质组成为CH3COOH和CH3COONa,n(CH3COOH) pH<7,随NaOH溶液的加入,溶液中CH3COOH的电离程度仍然大于CH3COO-的水解程度,可能的离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。此阶段在达到溶液中性之前,持续时间较长。 C-D段:溶质组成为CH3COOH和CH3COONa,n(CH3COOH) pH>7,随NaOH溶液的加入,溶液中CH3COOH的电离程度小于CH3COO-的水解程度,可能的离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 此阶段在在恰好反应完全生成CH3COONa之前,仍然会持续一段时间。 D段以后:溶质组成为NaOH和CH3COONa,pH>7,随NaOH溶液的加入,溶液中可能的溶质组成为:n(NaOH) 溶液中CH3COO-的水解程度逐渐受到抑制,可能的离子浓度大小关系为: c(Na+)>c(CH3COO-)>c(OH-)>c(H+); c(Na+)>c(CH3COO-)=c(OH-)>c(H+); c(Na+)>c(OH-)>c(CH3COO-)>c(H+); c(Na+)=c(OH-)>c(CH3COO-)=c(H+); c(OH-)>c(Na+)>c(H+)>c(CH3COO-)(CH3COO-无限稀释)。 2.强酸滴定弱碱型——用盐酸溶液滴定氨水 例2向20 mL 0.01 mol·L-1的氨水溶液中逐滴加入0.01 mol·L-1的稀盐酸,试分析滴定过程中溶液溶质的组成、溶液的酸碱性以及溶液中离子浓度大小的关系。图2 分析氨水中滴加稀盐酸,溶液中酸碱性的变化为酸性→中性→碱性,因此可建立如图2所示的稀盐酸的加入变化量与溶液pH变化量之间坐标关系图。解题时应(1)把握准四个点: A点:氨水溶液点,溶质只有NH3·H2O,pH>7,c(OH-)>c(NH+4)>c(H+); B点:n(NH3·H2O)=n(NH4Cl)溶液点,pH>7, c(NH+4)>c(Cl-)>c(OH-)>c(H+); C点:溶液中性点,NH3·H2O与NH4Cl的混合液,pH=7, c(NH+4)= c(Cl-)>c(H+)=c(OH-);
D点:恰好完全反应点,溶质只有NH4Cl,pH<7,c(Cl-)>c(NH+4)>c(H+)>c(OH-)。
(2)理清四段的变化:
在整个滴定过程中,溶液中只有四种离子,即NH+4、Cl-、OH-、H+,且每种离子所带电荷数均为1,由电荷守恒关系c(NH+4)+c(H+)=c(Cl-)+c(OH-),结合溶质的组成以及溶液的酸碱性能确定每个阶段离子浓度大小的关系。
A-B段:溶质组成为NH3·H2O和NH4Cl,n(NH3·H2O)>n(NH4Cl),
pH>7,随盐酸的加入,溶液中可能的离子浓度大小关系为:
c(OH-)>c(NH+4)>c(H+)>c(Cl-) (加酸量很少)
c(OH-)=c(NH+4)>c(H+)=c(Cl-)
c(NH+4)>c(OH-)>c(Cl-)>c(H+)
c(NH+4)>c(OH-)=c(Cl-)>c(H+)
c(NH+4)>c(Cl-)>c(OH-)>c(H+)
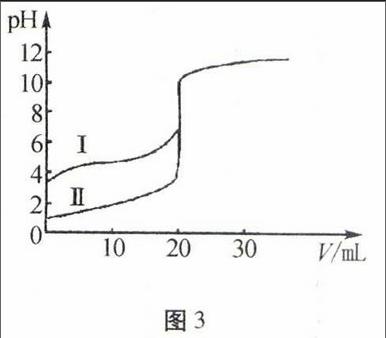
B-C段:溶质组成为NH3·H2O和NH4Cl,n(NH3·H2O) pH>7,随盐酸的加入,溶液中NH3·H2O的电离程度仍然大于NH+4的水解程度,可能的离子浓度大小关系为:c(NH+4)>c(Cl-)>c(OH-)>c(H+) 此阶段在达到溶液中性之前,持续时间较长。 C-D段:溶质组成为NH3·H2O和NH4Cl,n(NH3·H2O) pH<7,随盐酸的加入,溶液中NH3·H2O的电离程度小于NH+4的水解程度,可能的离子浓度大小关系为:c(Cl-)>c(NH+4)>c(H+)>c(OH-) 此阶段在在恰好反应完全生成NH4Cl之前,扔然会持续一段时间。 D段以后:溶质组成为HCl和NH4Cl,pH<7,随盐酸溶液的加入,溶液中可能的溶质组成为: n(HCl) 溶液中NH+4水解程度逐步受到抑制,可能的离子浓度大小关系为: c(Cl-)>c(NH+4)>c(OH-)>c(H+) c(Cl-)>c(NH+4)=c(H+)>c(OH-) c(Cl-)>c(H+)>c(NH+4)>c(OH-) c(Cl-)=c(H+)>c(NH+4)=c(OH-) c(H+)>c(Cl-)>c(OH-)>c(NH+4)(NH+4无限稀释) 二、依托坐标系酸碱反应考查的形式变换 1.强弱电解质对比型 图3例3(2014年海南高考)室温下,用0.100 mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图3所示。下列说法正确的是( )。 A.Ⅱ表示的是滴定醋酸的曲线 B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL C.V(NaOH)=20.00 mL时,两份溶液中 c(Cl-)=c(CH3COO-) D.V(NaOH)=10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(H+) 解析该题目将强弱电解质的滴定曲线在同一个坐标系中考查。A项相同浓度的盐酸和醋酸,由于盐酸是强酸,醋酸是弱酸,所以醋酸的pH大,盐酸的小,即Ⅰ是醋酸,Ⅱ是盐酸。B项因为盐酸与醋酸的浓度、体积相同,即物质的量相同,若都恰好中和,得到的NaCl是强酸强碱盐,溶液为中性,而醋酸是强碱弱酸盐,水解显碱性,若要使pH=7时,则滴加的体积就要比盐酸少,因此滴定醋酸消耗的V(NaOH)小于20 mL,正确;C项V(NaOH)=20.00 mL时,根据物料守恒,可得c(Cl-)=c(CH3COO-)-c(CH3COOH),错误;D项V(NaOH)=10.00 mL时,得到是醋酸和醋酸钠等浓度的混合溶液,由于酸的电离大于盐的水解,所以溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),错误。 答案: B 2.pOH-pH转化型图4 例4(2013年山东)某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图4所示,则( )。 A.M点所示溶液的导电能力强于Q点 B.N点所示溶液中c(CH3COO-)>c(Na+) C.M点和N点所示溶液中水的电离程度相同 D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 解析本题将酸碱反应的定量变化关系转化为pOH-pH的图像变化,Q点pOH=pH=a,则有c(H+)=c(H+),此时溶液呈中性,那么c(CH3COO-)=c(Na+),N点溶液呈碱性,c(OH-)>c(H+),那么c(CH3COO-)<c(Na+),B错。结合图像可知,M点溶液中含有CH3COOH和CH3COONa,在滴加NaOH溶液的过程中,溶液中离子浓度变大,则M点溶液的导电能力比Q点弱,A错。M点pOH=b,N点pH=b,说明M点c(H+)与N点c(H+)相等,对水的电离的抑制程度相同,因此M点和N点水的电离程度相同,C对。若消耗NaOH溶液与醋酸溶液的体积相等,二者恰好反应生成CH3COONa,溶液显碱性,而Q点溶液呈中性,显然醋酸溶液的体积大于消耗NaOH溶液的体积,D错。
答案:C
2.融合Ka、Kh考查型
图5
例5(高考变式题)25 ℃时,某一元弱酸HA的电离平衡常数为Ka,A-的水解平衡常数为Kh。该温度下向20 mL 0.1 mol·L-1HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图5所示(忽略反应导致的温度变化)。下列说法不正确的是( )。
A.滴定过程中总是存在:Ka>Kh
B.点②所示溶液中存在:c(Na+)=c(A-)
C.点③所示溶液中存在:c(Na+)=c(A-)+c(HA)
D.向点①所示溶液中加水:c(A-)c(OH-)·c(HA) 减小
解析A项,加入10 mL NaOH溶液时,溶液中含有等物质的量的HA和NaA,既存在A-的水解平衡,也存在HA的电离平衡,而此时溶液呈酸性,说明HA的电离程度大于A-的水解程度,即Ka>Kh,而电离平衡常数和水解平衡常数只与温度有关,因滴定过程中忽略温度变化,故滴定过程中始终有Ka>Kh,正确;B项,根据溶液中电荷守恒知,c(Na+)+c(H+)=c(OH-)+c(A-),点②表示的溶液pH=7,呈中性,c(OH-)=c(H+),则
c(Na+)=c(A-),正确;根据物料守恒知C项正确;D项,将c(OH-)=Kwc(H+)代入c(A-)c(OH-)·c(HA)中,得c(A-)·c(H+)Kw·c(HA)=KaKw,Ka和Kw均只与温度有关,故点①溶液加水稀释时c(A-)c(OH-)·c(HA)不变,D项错误。
答案:D
三、坐标系考查方式在酸碱反应中的思考
酸碱反应涉及弱电解质的电离平衡、盐的水解反应、溶液pH的计算、离子浓度大小比较、电荷守恒等问题,是一类综合性较强的问题。
一些高考题中还利用坐标系关系变式考查了酸碱反应关系。
图6例6(2014年浙江高考)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)Cl2(aq)K1=10-1.2
Cl2(aq)+H2OHClO+H++Cl-
K2=10-3.4
HClOH++ClO-Ka=?
其中Cl2(aq)、HClO和ClO-三者所占分数(α)随pH变化的关系如图6所示。下列表述正确的是( )。
A.Cl2(g)+H2O2H++ClO-+Cl-
K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
解析本题以酸碱反应为载体,考查平衡的移动。
A.取图像上两曲线的一个交点(pH=7.5),此时c(ClO-)=c(HClO),Ka=10-7.5,
可得Cl2(g)+H2O2H++ClO-+Cl-。K=K1·K2·Ka=10-1.2×10-3.4×10-7.5=10-12.1,所以A项错误。
B项中,由质子守恒关系得:
c(H+)=c(ClO-)+c(Cl-)+c(OH-),则c(H+)-c(OH-)=c(ClO-)+c(Cl-)。又因为c(Cl-)>c(HClO),所以B项中c(HClO)+c(ClO-)<c(H+)-c(OH-),该项错误。
C项中,pH=6.5时c(HClO)>c(ClO-),杀菌效果比pH=7.5时要好,该项正确。
D项中,夏季温度高,氯气在水中的溶解度比冬季要小,c(HClO)和c(ClO-)的浓度比冬季要小,杀菌效果比冬季差,该项错误。
答案: C
总之,坐标系为酸碱反应提供了比较直观的变化关系,由坐标系中的重要的点以及变化曲线让学生更加清晰的认识了酸碱反应的历程,为认识物质变化与定量反应关系、培养实验技能找到了很好的载体。
(收稿日期:2015-06-20)

