静态法和动态法测量乙醇饱和蒸气压的比较*
蒋风雷蔡雨萌 邓立志 邓媛 龚楚清 刘义
(武汉大学化学与分子科学学院 湖北武汉 430072)
静态法和动态法测量乙醇饱和蒸气压的比较*
蒋风雷**蔡雨萌 邓立志 邓媛 龚楚清 刘义
(武汉大学化学与分子科学学院 湖北武汉 430072)
物质的蒸气压是化学、化工、冶金、医药等领域的重要基础数据。测量饱和蒸气压是大学物理化学实验教学中的一个基础实验,测量方法主要有静态法和动态法,但两种方法的比较尚未见报道。本文通过比较,得出了两种方法的优缺点以及注意事项。
静态法 动态法 乙醇 饱和蒸气压 摩尔蒸发焓
在一定温度下,在密闭容器中,纯液体与其所对应的气体达到两相平衡,液体上方的蒸气压为此物质的饱和蒸气压(简称蒸气压)。液体的蒸气压随温度而变化,温度升高,则蒸气压增大;温度降低,则蒸气压降低。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点。外压不同时,液体沸点将相应改变。当外压为1.013×105Pa时,液体的沸点称为该液体的正常沸点。液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙(Clausius-Clapeyron)方程表示:
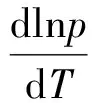
(1)
纯物质的饱和蒸气压是物质的重要物性参数,是化学、化工、冶金、医药等领域的重要基础数据。目前,测量液体饱和蒸气压是一般本科院校普遍开设的一个基础物理化学实验,对于学生加深对气-液平衡和克劳修斯-克拉贝龙方程等概念的理解具有重要作用。采用的方法主要有静态法和动态法两种[1-4],但目前关于这两种方法的比较尚未见报道。本文采用两种方法测量乙醇的饱和蒸气压,计算乙醇的摩尔蒸发焓,并比较两种方法的区别,为进一步更好开设此实验起到支撑作用。在武汉大学化学与分子科学学院实验中心编写的《物理化学实验》以及文献中对静态法、动态法测量饱和蒸气压的原理、装置、操作步骤等已经有了较为详细的阐述[1-4],本文为简便起见,不再赘述。
1 用安托宁公式计算饱和蒸气压和摩尔蒸发焓
乙醇的饱和蒸气压理论值可通过安托宁公式计算得到。
根据安托宁(Antoine)公式:
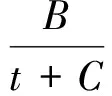
(2)
其中,p为t温度时的饱和蒸气压,A、B、C为常数[5]。
在20.0~78.3℃区间,通过安托宁公式可计算得到不同温度下的饱和蒸气压(表1)。
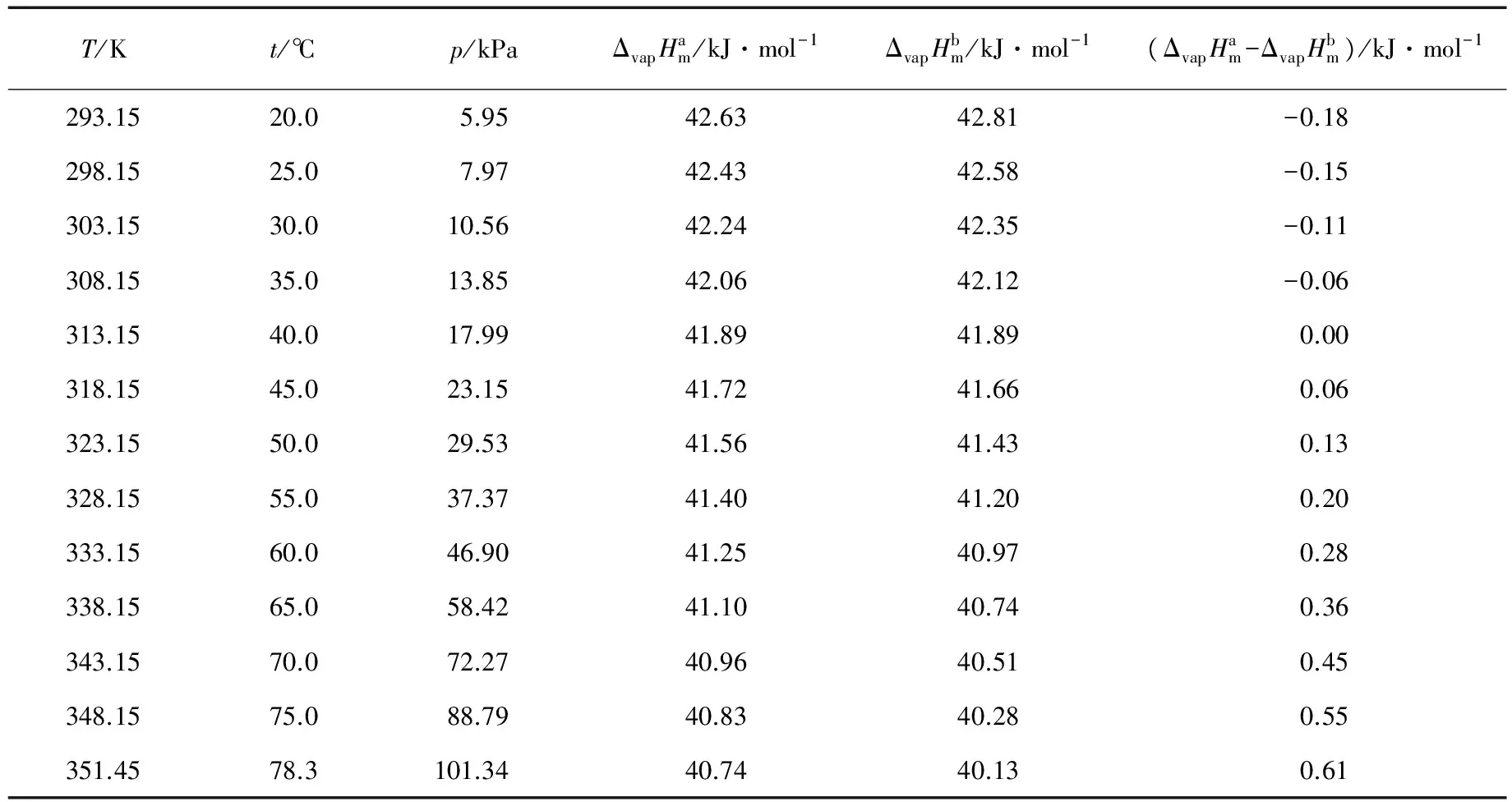
表1 不同温度下的乙醇饱和蒸气压和摩尔相变焓
注:a:利用安托宁公式与克劳修斯-克拉贝龙方程联立得到;b:利用摩尔热熔计算得到。
摩尔蒸发焓理论值可通过下面介绍的3种方法计算得到。
1.1 作图法
假设在该温度区间,摩尔蒸发焓变化不大,可视为常数,利用克劳修斯-克拉贝龙方程的不定积分式:
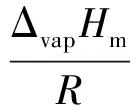
(3)
以lnp对1/T作图,结果见图1。
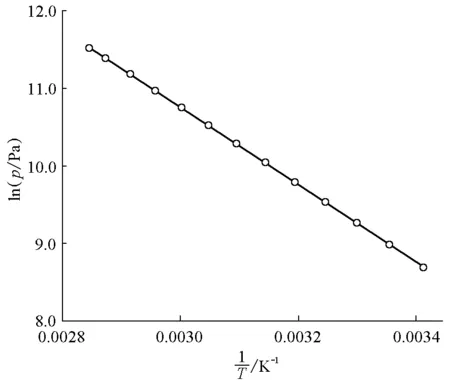
图1 lnp对作图
由图1可得线性关系为:
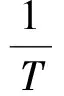
因此,ΔvapHm=5007.26×8.314=41.6kJ·mol-1。
1.2 安托宁公式与克劳修斯-克拉贝龙方程联立计算摩尔蒸发焓
将安托宁公式进行转换,得:
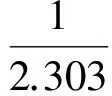
(4)
式中p的单位为Pa,T为热力学温度。
对式(4)进行变换后求导,得:
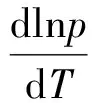
(5)
将式(5)与克劳修斯-克拉贝龙方程联立,得:
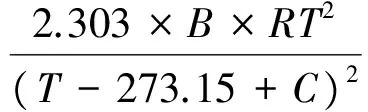
(6)
1.3 利用摩尔热容计算摩尔蒸发焓

(7)
可以看出,在20.0~78.3℃的温度区间,ΔvapHm=42.8~40.1kJ·mol-1,平均值为41.5kJ·mol-1。
以上3种方法计算得到的摩尔蒸发焓结果基本一致,在实验温度区间,平均值为41.5~41.6kJ·mol-1。
同时从式(6)和式(7)也可以看出,摩尔蒸发焓随温度变化而有少量的变化,在20.0~78.3℃的温度区间,变化值约为2kJ·mol-1,变化率约为2.5%,在不要求结果太精确的前提下,可将其视为常数。
2 静态法测乙醇的饱和蒸气压
静态法是比较常用的测量液体饱和蒸气压的方法,一般适用于蒸气压较大的物质,其基本原理是获得某物质的饱和蒸气,并直接测定其压强的大小。通过测量20~75℃乙醇的饱和蒸气压(每个温度至少得到3个平行数据),得到的实验数据见表2。
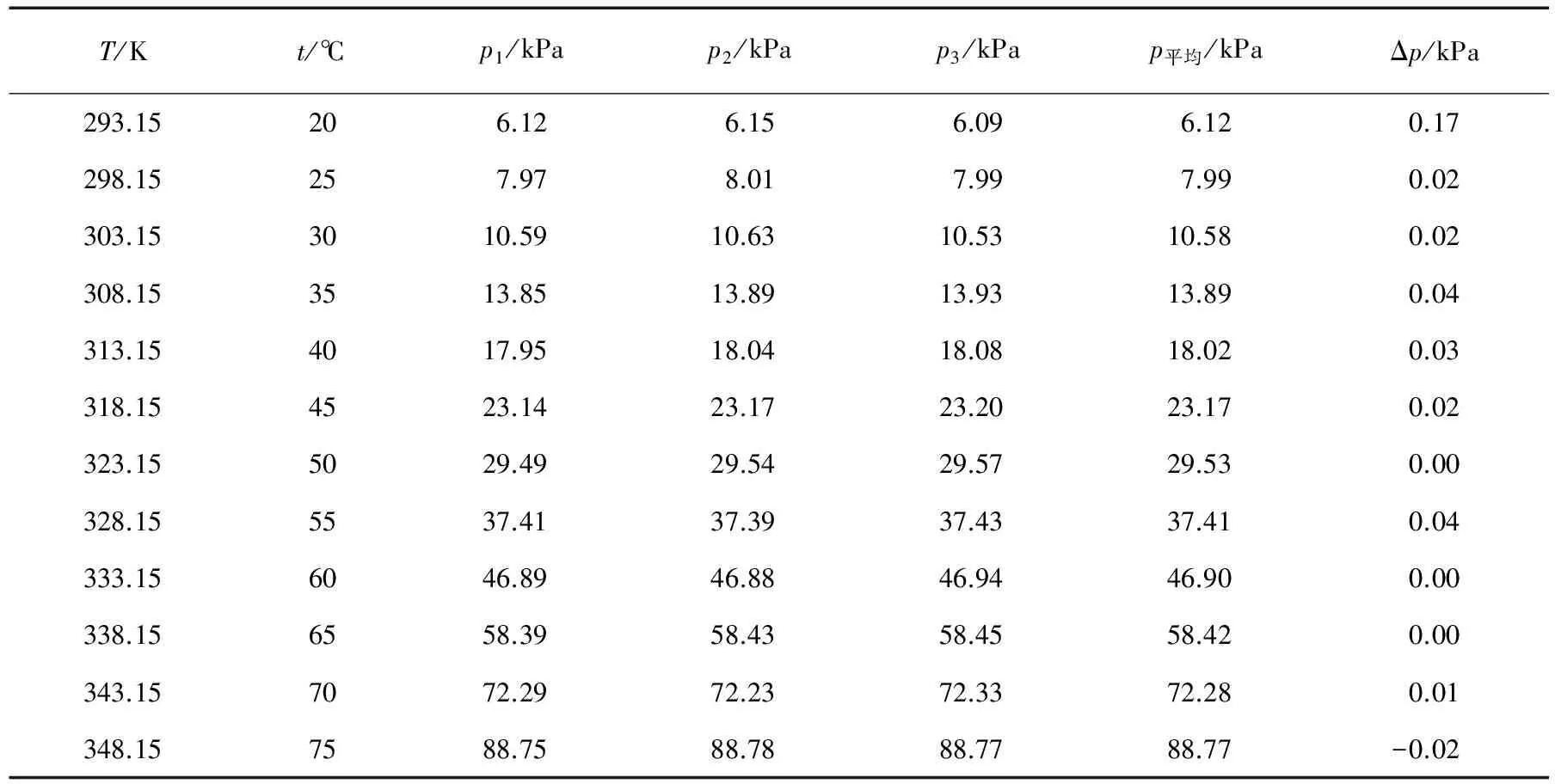
表2 利用静态法测得的乙醇饱和蒸气压
注:Δp为实验所得数据与安托宁公式计算所得数据的差值。
从表2可看出,利用静态法所得到的数据与通过安托宁公式计算得到的数据很接近(差值小于0.1kPa),这说明静态法测量乙醇饱和蒸气压很准确。以lnp对1/T作图,所得结果见图2。
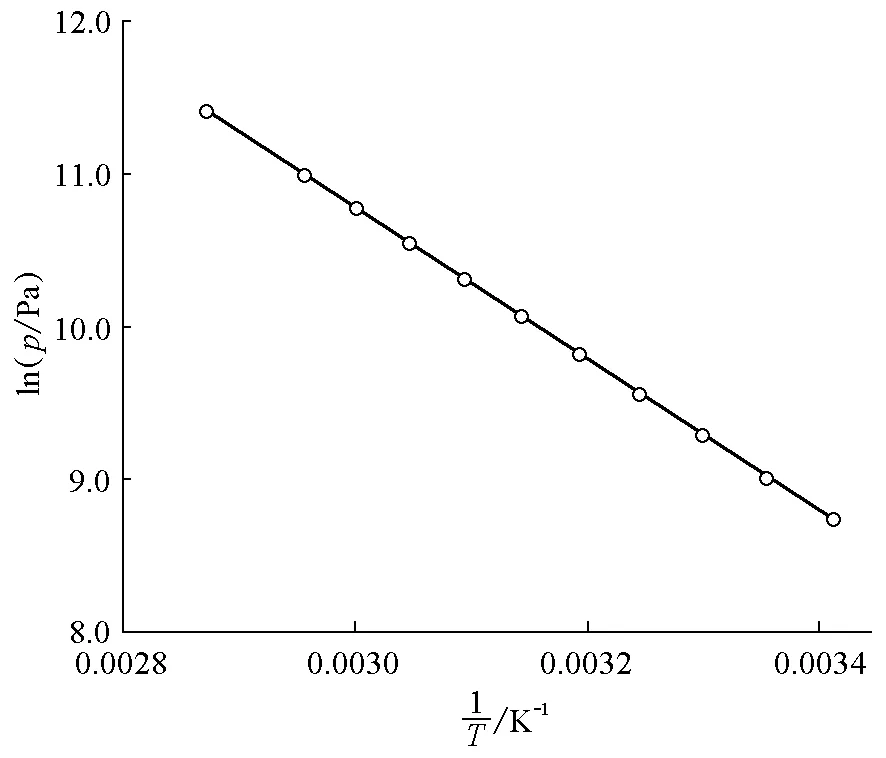
图2 静态法测量乙醇饱和蒸气压得到的lnp-关系
由图2可得线性关系为:
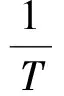
因此,ΔvapHm=4987.22×8.314=41.5kJ·mol-1,误差<1%。
3 动态法测乙醇饱和蒸气压
动态法测乙醇饱和蒸气压是将物质加热至沸点,利用沸腾时饱和蒸气压与外压相等的特点,来测得饱和蒸气压。测量装置和实验操作均较为简单。因为所使用温度计的最小刻度为50℃,因而所得沸点从高于50℃开始。此外,由于动态法实验原理的限制,每组只有一个实验数据,但可以通过增加实验数据点来降低误差(12个数据点,压力间隔约为5 kPa)。实验数据见表3。
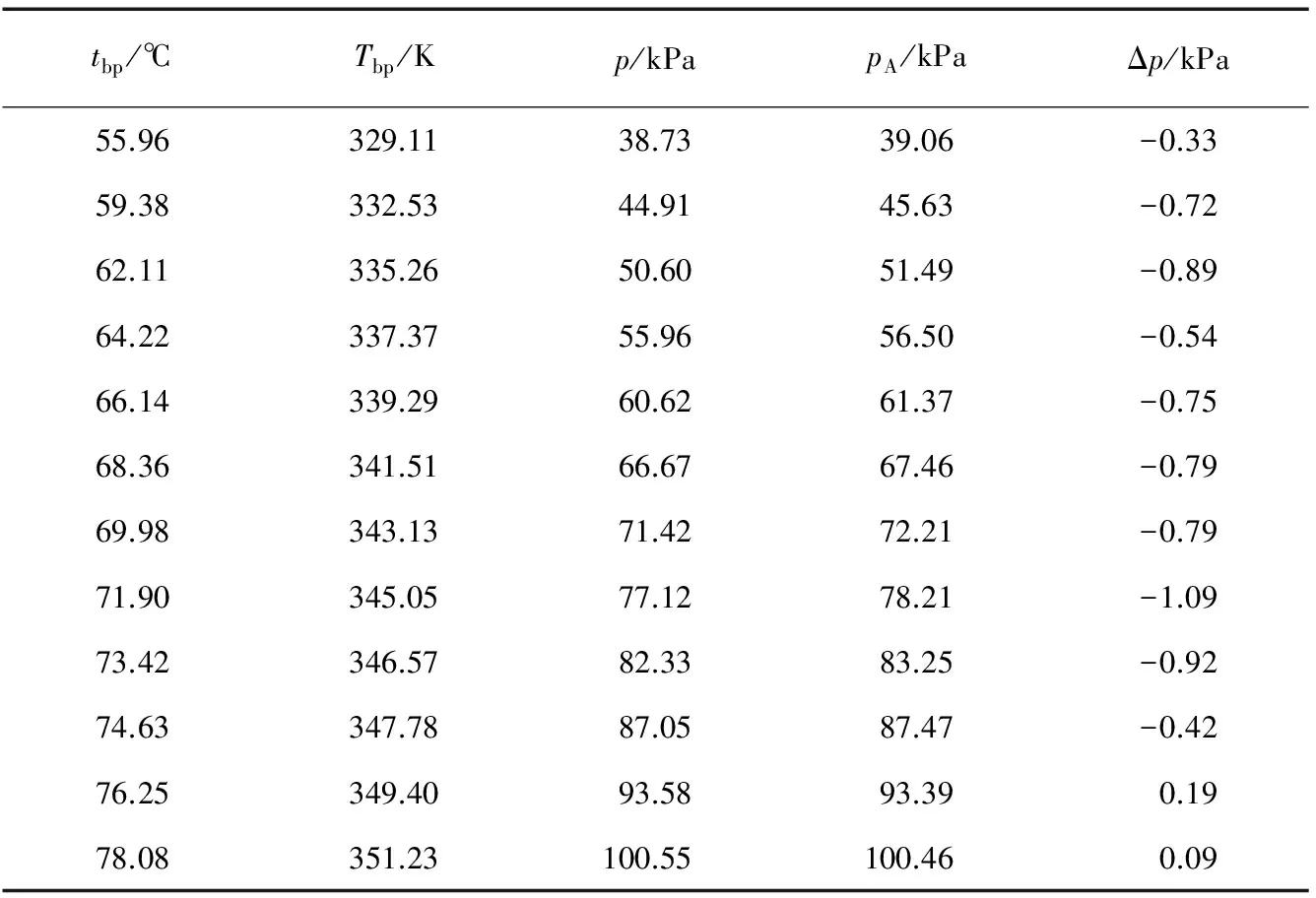
表3 利用动态法测得的乙醇饱和蒸气压
注:pA为通过安托宁公式计算得到的不同温度下的蒸气压数据。Δp为实验数据与通过安托宁公式计算得到的数据之间的差值。
从表3可看出,相较于静态法,动态法所得数据与安托宁公式计算得到的数据有较大的偏差(-1.1~0.1kPa),但相对误差一般小于1%。以lnp对1/T作图,所得结果见图3。
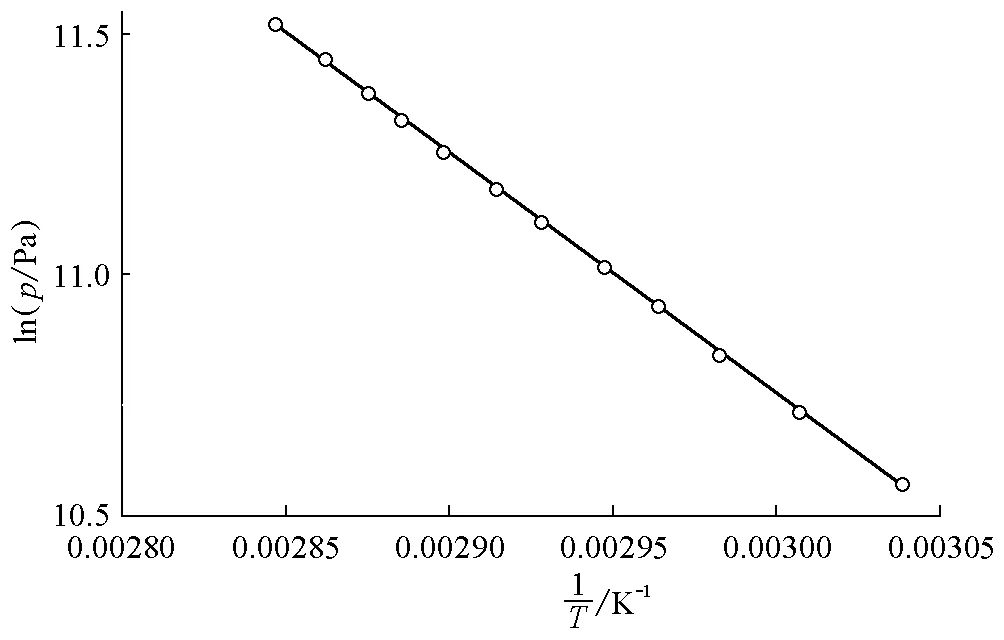
图3 动态法测量乙醇饱和蒸气压得到的lnp-关系
由图3可得线性关系为:
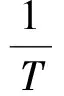
因此,ΔvapHm=4998.75×8.314=41.6kJ·mol-1,误差<1%。综合静态法与动态法,两者所得的摩尔蒸发焓约为41.5~41.6kJ·mol-1,与通过安托宁公式计算得到的数值很吻合。
4 静态法与动态法测量乙醇饱和蒸气压的比较
综合上述实验数据,结合测量原理与仪器,将静态法与动态法进行对比,见表4。

表4 静态法与动态法测量饱和蒸气压的比较
5 两种方法测量的注意事项
5.1 静态法注意事项
① 测量温度控制在35~55℃为宜。温度较低则气-液两相平衡时间较长,而且低温下因饱和蒸气压较低而易导致测量误差较大(如20℃时,见表2)。温度高则平衡时间短;但温度过高则控温装置的精密性对压力测量会有较大影响(±0.1℃即可导致压力改变0.1~0.3kPa)。如65℃的饱和蒸气压比55℃高约20kPa,75℃的饱和蒸气压比65℃高约30kPa;而温度较低时,45℃的饱和蒸气压比35℃只高约10kPa,55℃的饱和蒸气压比45℃只高约15kPa。在高温情况下,很小的温度波动即可造成平衡管的U形管中液柱大幅上升或下降,不易平衡液柱高度,因而不易准确读取数据。
② 静态法测量时,要想获得纯的乙醇饱和蒸气,需要先抽真空将平衡管中的空气排净。此步骤可在冰浴下进行,使液态乙醇不易暴沸,以避免出现平衡管内所需的液态乙醇大幅减少的情况。此过程完成后,再将装置置于恒温水槽中,调节到测量温度。
5.2 动态法注意事项
因为测量原理的限制,一般可通过增加数据点来降低误差。
6 总结及展望
综上所述,静态法测得的饱和蒸气压较为准确,但通过两种方法得到的摩尔蒸发焓的数值吻合得很好,约为41.5~41.6kJ·mol-1。然而,两种测量装置均有待改进。如对于静态法测量装置,可在进气口设置一个缓冲瓶,使其压力介于体系压力和环境压力之间,且更接近于体系压力,这样便可达到精细调节U型管内液柱高度的目的。对于动态法测量装置,可使体系与两个较大的缓冲瓶1、2相连,采取两步法调节体系压力,即体系与缓冲瓶1相连,而通过与环境联通的缓冲瓶2调节体系压力(缓冲瓶2的压力介于体系压力和环境压力之间)。缓冲瓶2使体系压力易于调节至期望值,而缓冲瓶1可减少体系沸腾时对设定压力的影响。长远来看,这两种装置可朝着精密和小型化的方向发展,使之更易操作,并使结果的准确性和重复性更好。
一般而言,动态法操作简单,对于真空技术和设备装置要求较低,具有一些优势,但测量饱和蒸气压的结果不够准确。文献中关于静态法报道较多,且大多数高校采用静态法,这主要是因为静态法在化工生产中更常用,测量结果更准确;但静态法对学生操作技能的要求、对真空技术和设备装置精密性的要求更高。建议在有条件的情况下,可将两种方法都提供给学生尝试和比较。如果条件有限,建议采用静态法,以便更好地锻炼学生的操作能力。此外,因为装置有很大的改进空间,可以鼓励学生动脑动手改进实验装置,以提升综合能力和加强创新意识。
[1] 武汉大学化学与分子科学学院实验中心.物理化学实验.第2版.武汉:武汉大学出版社,2012
[2] 李德忠,王宏伟,陈泽宪,等.大学化学,2003,18(2):47
[3] 傅丽,李爱昌,吴昊,等.廊坊师范学院学报(自然科学版),2012,12(4):60
[4] 李惠云,郭金福,栗鸿斌,等.大学化学,1998,13(5):42
[5] Dean J A.兰氏化学手册.第2版.北京:科学出版社,2003
[6] 傅献彩,沈文霞,姚天扬,等.物理化学.第5版.北京:高等教育出版社,2005
TheMeasurementoftheSaturatedVaporPressureofEthanol:aComparisonoftheStaticandtheDynamicMethods*
Jiang Fenglei* *Cai Yumeng Deng Lizhi Deng Yuan Gong Chuqing Liu Yi
(CollegeofChemistryandMolecularSciences,WuhanUniversity,Wuhan430072,Hubei,China)
In this paper, the saturated vapor pressure of ethanol is measured by both the static and the dynamic methods. A comparison of these two methods is provided for the understanding and further improvement of this experiment.
Static method; Dynamic method; Ethanol; Saturated vapor pressure; Molar vapor enthalpy
10.3866/pku.DXHX20150447
国家自然科学基金(No.21303126)
**通讯联系人,E-mail:fljiang@whu.edu.cn
O6;G64

