Cu/Ni助催化剂对TiO2光催化制取苯酚性能的影响
魏圆 康诗钊 李向清 秦利霞 穆劲
(上海应用技术学院化学与环境工程学院,上海201418)
Cu/Ni助催化剂对TiO2光催化制取苯酚性能的影响
魏圆 康诗钊*李向清 秦利霞 穆劲
(上海应用技术学院化学与环境工程学院,上海201418)
以TiO2纳米粒子为主催化剂,采用“浸渍-还原法”构筑了铜、镍共负载的二氧化钛基光催化系统。以苯为起始原料,H2O2为氧化剂,研究了Cu/Ni助催化剂对TiO2可见光催化制取苯酚性能的影响并对Cu/Ni助催化剂的作用机制进行了探讨。结果表明,在可见光照射下,纯TiO2纳米粒子对苯氧化制取苯酚反应没有催化活性。铜、镍的引入可以明显地增强TiO2可见光催化制取苯酚的活性。当使用负载有铜、镍的TiO2作为催化剂时,苯酚的产率可达到18%。结果还表明Cu、Ni之间存在着很强的协同作用。在该协同作用下,Cu、Ni共负载的TiO2纳米粒子表现出了较单一金属负载的TiO2纳米粒子高得多的光催化活性。
苯;苯酚;二氧化钛;铜、镍助催化剂;光催化
苯酚是一种重要的化学中间体,被广泛应用于染料、树脂、纤维、医药等诸多领域。目前,苯酚的工业制备方法主要是“异丙苯法”,该法虽被广泛应用,但存在着制备周期长、产率低、副产物多等缺点[1]。为此,研究人员进行了大量的研究来寻找由苯制取苯酚的新路线。通过这些研究,人们取得了一些有意义的研究成果,并筛选出3条有前途的新路线,即N2O氧化法[2]、O2氧化法[3]和H2O2氧化法[4]。但是,从应用的角度来看,上述方法还需要进一步改进,如气态N2O有毒,其生产、储存和运输都很不方便[5];当以氧气作为氧化剂时,反应所需要活化温度较高,苯酚产率较低[6];双氧水法在常温下苯酚产率仍不能令人满意[7]。由此可见,建立一条绿色、低成本、可在常温下进行反应的,由苯制取苯酚的新路线具有重要意义。
光催化氧化苯制取苯酚是一条环保、节能的反应路线,并且所需设备简单,操作简便,可在常温下进行。因而,受到了众多研究者的青睐。人们对此进行了大量的研究并取得了许多令人感兴趣的成果。例如,Park等[8]以450 W氙灯为紫外光源,以POM (PW12O403-)修饰的TiO2纳米粒子(P25)为光催化剂,对光催化氧化苯制取苯酚进行了初步探讨。他们发现在POM修饰的TiO2纳米粒子光催化作用下,苯酚收率达到了11%。Devaraji等[9]使用Au负载的Ti0.98V0.02O2纳米颗粒为光催化剂,在紫外光照射下,研究了其对氧化苯制取苯酚的光催化活性。其研究结果表明,苯酚产率最高可为16%。但这些反应体系大都是在紫外光照射下进行。而紫外光在太阳光中只占3%~4%。这导致它们很难在实际生产中得到应用。因此,开发一种高性能可见光光催化剂是十分必要的。现已成为广大科研工作者所关注的研究焦点之一。
最近,Hayato等[10]使用铂负载的二氧化钛作为光催化剂,在可见光光照射下,成功地由苯制取了苯酚。其研究结果表明,苯酚产率最高可为2%。Ide等[11]研究了金纳米颗粒修饰的层状钛酸盐对氧化苯制取苯酚的光催化活性,发现在可见光照射下,苯酚产率可达62%。但该反应必须在过量苯酚存在时才能进行。如初始反应体系中不含苯酚,则没有苯酚产生[9,11]。Zheng等[12]研究了贵金属(Au、Pt、Ag)修饰的TiO2对氧化苯制取苯酚的可见光催化活性,表明负载有2wt%Au的TiO2微球的可见光催化活性最高,在其作用下苯酚产率可达63%。这些研究结果表明,使用贵金属对TiO2进行修饰可以使二氧化钛对苯氧化反应的可见光催化活性得到显著提高。但贵金属助催化剂的负载工艺较为复杂,且使用成本较高,因而很难实现大规模的应用。由此可见,开发一种廉价、制备工艺简单的助催化剂来代替上述贵金属助催化剂是很有必要的。最近,有研究显示,使用铜、镍来修饰二氧化钛可以显著地提高其对污染物光降解的催化活性。如Riaz等[13]将Cu、Ni负载在TiO2纳米粒子表面,并研究了Cu、Ni负载的TiO2纳米粒子对酸性橙II光降解的催化活性。Gao等[14]使用Cu、Ni共负载的TiO2纳米粒子为光催化剂,研究了其对硝酸盐分解的光催化活性。他们的研究结果都显示,与Cu、Ni单独负载的TiO2纳米粒子相比,Cu、Ni共负载的TiO2纳米粒子可表现出高得多的光催化活性。此外,我们也利用Cu、Ni共负载的TiO2纳米粒子作为光催化剂,探讨了其在光催化制氢方面的应用[15]。我们发现,Cu、Ni共负载的TiO2纳米粒子是一个高效的光催化制氢催化剂。受这些研究的启发,我们推测Cu、Ni共负载的TiO2纳米粒子对于光催化苯氧化制取苯酚可能也具有很高的活性。就我们所知,目前尚未见相关报道。
在本工作中,我们以TiO2纳米粒子作为主催化剂,采用“浸渍-还原法”制备了铜、镍共负载的二氧化钛基光催化剂。在此基础上,与H2O2氧化法相结合,探讨了其在可见光催化苯氧化制取苯酚中的应用。最后,对光催化反应机理进行了初步探讨。
1实验部分
1.1药品和仪器
分析纯六水氯化镍、二水氯化铜、氢氧化钠、乙二醇、水合肼(85%)、双氧水(30%)、苯、乙腈、氯仿、氯苯购自国药化学试剂有限公司。TiO2纳米粒子(P25)购自德国Degussa公司。实验所用水均为去离子水。
使用PANalytical公司生产的X′pert Pro MRD型X射线衍射仪(荷兰)对样品的物相进行分析。扫描速度4°·min-1,扫描范围10°~80°,工作电压40 kV,工作电流40 mA,Cu Kα射线(λ=0.154 18 nm),Ni滤光片,所用的探测器为由158个正比计数探测器组成的超能探测器,入射光发散狭缝为1°和2°,衍射光路防反射狭缝为6.6°。通过JEOL公司生产的JEM-2100F型透射电子显微镜(日本)获得样品的透射电子显微镜(TEM)和高分辨率透射电子显微镜(HRTEM)照片。加速电压为200 kV,分辨率为0.14 nm。利用Hitachi公司生产的S3400N型能量色散X射线光谱仪(日本)对样品的元素含量进行分析。加速电压为20.8 kV。固体紫外-可见漫反射光谱用带有积分球的UV 3900型紫外-可见分光光度计(Hitachi,Japan)测定。标准样品为BaSO4。样品的比表面积是利用Micromeritics公司生产的ASAP 2020型低温氮气吸-脱附曲线仪(美国)测得的。利用Thermofishe公司生产的Wscalab型X射线光电子能谱仪(英国)对样品的元素价态进行分析。Al Kα射线,500 μm束斑,能量分析器固定透过能为150 eV。
1.2 铜、镍修饰的TiO2纳米粒子的制备(TiO2-Cu/ Ni)
称取1 g NaOH,将其溶解到12.5 mL 85%的水合肼中,记作溶液A。将NiCl2(12 mg)和CuCl2(8.5 mg)溶解在30 mL的乙二醇溶液中,记作溶液B。搅拌下,将0.8 g P25加入到盛有70 mL乙二醇的三口烧瓶中,形成均匀的悬浮液。随后,向该TiO2悬浮液中缓慢加入溶液B。搅拌3 h后,氮气保护下,使用油浴将上述混合物加热到110℃。然后,逐滴加入溶液A。待溶液A全部加入后再持续搅拌45 min。最后,使反应体系自然冷却至室温。经过滤、洗涤过程后,所得固体在45℃下真空干燥。为了表达方便,将产品表示为TiO2-x%Cu/Ni(m∶n),其中x%为Cu/Ni的总负载量,m∶n为所负载的Cu和Ni的物质的量的比。
1.3 光催化实验
光催化实验是在光化学反应仪(XPA系列,南京胥江机电厂)中进行的。光源为带有冷凝水夹套的350 W氙灯。使用滤光片滤掉波长在420 nm以下的光。光源与反应器中心距离为10 cm。将25 mg光催化剂、0.1 mL苯(0.011 27 mol)、20 mL(0.2 mol)双氧水(30%)、2.6 mL乙腈和2.4 mL去离子水加入到石英反应器中。在暗处持续搅拌一段时间后,开始进行光催化实验。反应进行一段时间后,停止光照。将反应液转移至分液漏斗中,加入5 mL氯仿,震荡、摇匀,静置。待分层后,将下层有机相由下口放出。对水相进行3次萃取后,合并所得有机相,放入无水硫酸钠,静置15 min。最后,使用氯苯作为内标物,通过气相色谱对产物进行定量分析。所使用的色谱仪为上海精密科学仪器有限公司生产的GC-112A型气相色谱仪。色谱柱为0.32 mm×0.5 μm×50 m的OV-1701型毛细管柱(石英);进样器温度设为280℃;检测器为FID氢火焰检测器,温度设为280℃。采用程序升温方式对柱箱温度加以调制。初始柱箱温度设为100℃;保温5 min后开始升温,升温速率为10℃·min-1;终止温度设为220℃,到达后保持该温度20 min。载气为高纯氮气,流速为1 mL·min-1,分流比为1∶20。
2结果与讨论
2.1 X射线粉末衍射(XRD)
图1示出的是P25和TiO2-1.0mol%Cu/Ni(1∶1)的XRD图。由图1b可见,在2θ=25.28°、36.95°、37.80°、38.58°、48.05°、53.89°、55.06°、62.69°、70.31°及75.03°处,TiO2-1.0mol%Cu/Ni(1∶1)出现了衍射峰。这些衍射峰分别对应于锐钛矿型TiO2的(101)、(103)、(004)、(112)、(200)、(105)、(211)、(204)、(220)和(215)晶面(PDF No.21-1272)[16]。此外,我们还可以在2θ=27.45°、36.09°、41.23°、44.05°、54.32°、56.64°、62.74°、64.04°及69.01°处观察到衍射峰。它们分别对应于金红石型TiO2的(110)、(101)、(111)、(210)、(211)、(220)、(002)、(310)和(301)晶面(PDF No.21-1276)[16]。并且与P25的衍射峰位置相比较,TiO2-1.0mol%Cu/Ni(1∶1)的衍射峰的位置没有发生移动。这说明所引入的铜、镍并未进入到TiO2的晶格中,没有使TiO2的晶体结构发生变化[17]。然而,从TiO2-1.0mol%Cu/Ni(1∶1)XRD图没有观察到明显的归属于铜和镍的衍射峰。其可能原因是铜、镍的负载量较低,并且高度分散在TiO2表面上,因而晶粒尺寸较小,导致其没有表现出明显的衍射峰[18-19]。
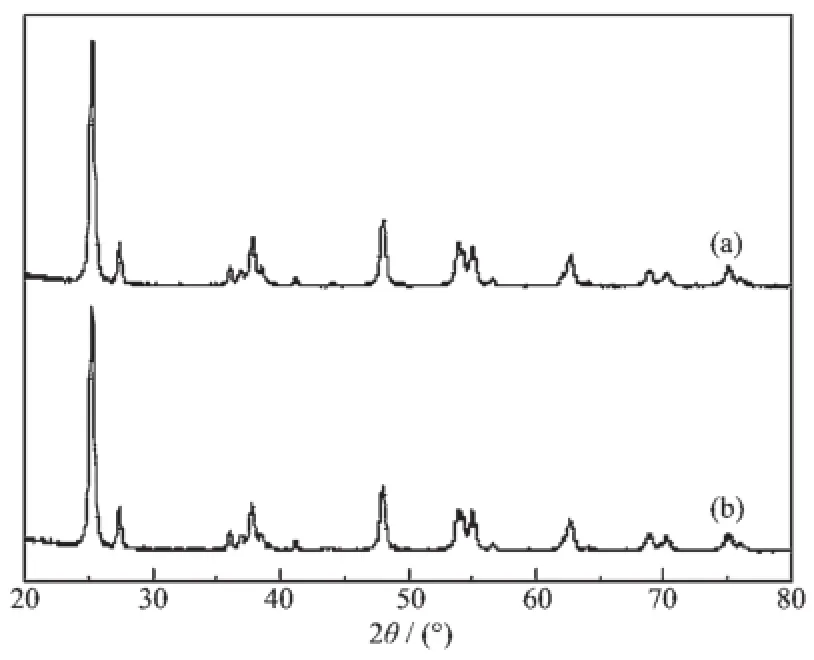
图1 P25(a)和TiO2-1.0mol%Cu/Ni(1∶1)(b)的XRD图Fig.1 XRD patterns of P25(a)and TiO2-1.0mol%Cu/Ni (1∶1)(b)
2.2 TEM
图2示出的是P25和TiO2-1.0mol%Cu/Ni(1∶1)的TEM照片。由图2b可见,所得到的TiO2-1.0mol% Cu/Ni(1∶1)为纳米颗粒,其直径约为(24±5)nm。与P25相比(图2a),粒子形貌及尺寸几乎没有差异。这表明铜、镍的负载对于TiO2纳米粒子的形貌没有影响。进一步,我们还可以看到TiO2-1.0mol%Cu/Ni(1∶1)表面上存在着一些明显的黑色区域。我们推测这些黑色的区域可能是铜、镍富集区。样品的HRTEM照片(图2c)表明上述黑色区域中存在一些晶格条纹。其晶面间距为0.18 nm。这与Cu3.8Ni的(200)晶面间距十分吻合(PDF No.09-0205)[15]。该结果表明我们已成功地将铜镍合金负载于TiO2表面。

图2 P25(a)的TEM照片和TiO2-1.0 mol%Cu/Ni(1∶1)的TEM(b)以及HRTEM(c)照片Fig.2 TEM images of P25(a)and TiO2-1.0mol%Cu/Ni(1∶1)(b)as well as HRTEM image of TiO2-1.0mol%Cu/Ni(1∶1)(c)
2.3 X射线光电子能谱(XPS)
图3示出的是TiO2-1.0mol%Cu/Ni(1∶1)的Cu2p (a)和Ni2p(b)的高分辨XPS谱。由图3a可以看到,在932.1 eV和951.7 eV处有2个XPS峰。它们应分别归属于金属铜的Cu2p3/2和Cu2p1/2峰[15,20]。这表明负载在TiO2上的铜物种为金属铜。同时,由图3b我们可以观察到,样品的Ni2p XPS谱中存在着4个XPS峰,分别位于855.3 eV、861.7 eV、873.0 eV和880.1 eV。其中,位于855.3 eV和873.0 eV的XPS峰应归属于Ni(OH)2的Ni2p3/2和Ni2p1/2峰[21],位于861.7 eV和880.1 eV处的XPS峰应归属为Ni(OH)2中Ni2p3/2和Ni2p1/2的卫星峰[22]。这个现象表明在TiO2表面所负载的Cu-Ni合金颗粒表面有一层Ni (OH)2。这可能是由于金属镍比较活泼,当其处于纳米态时易于发生氧化反应的缘故。
能量色散X射线光谱的测试结果表明,TiO2-1.0mol%Cu/Ni(1∶1)含有Ti、O、Cu、Ni 4种元素。并且在误差范围内,Cu和Ni的原子比大约为1∶1。综合TEM和XPS结果,我们推测Cu、Ni可能在TiO2表面形成了以富铜的Cu-Ni合金为核,以Ni(OH)2为壳的核壳结构。产生这种结构的原因可能是:由于Cu2+、Ni2+的反应活性不同,使得Cu、Ni在合金颗粒中分布并不均匀。在颗粒内部,为富铜的Cu-Ni合金,而在外部则为富镍的Cu-Ni合金。由于形成合金后,Ni的还原性被增强。因而,在空气气氛下,外部的镍会发生氧化,从而在颗粒表面形成了一层Ni (OH)2。因此,可以确认,我们已成功地将Cu-Ni合金负载于TiO2表面,获得了所设计的光催化剂。

图3 TiO2-1.0mol%Cu/Ni(1∶1)的Cu2p(a)和Ni2p(b)高分辨XPS谱Fig.3 High-resolution XPS spectra of Cu2p(a)and Ni2p(b)of TiO2-1.0 mol%Cu/Ni(1∶1)
2.4 紫外可见吸收光谱
图4示出了P25和TiO2-1.0mol%Cu/Ni(1∶1)的紫外-可见漫反射光谱。如图4a所示,P25在400 nm~800 nm的波长范围内几乎没有吸收。同时,TiO2-1.0mol%Cu/Ni(1∶1)的紫外-可见漫反射光谱显示,当负载了Cu/Ni合金以后,归属为TiO2的吸收带没有发生明显的移动。这表明Cu/Ni合金的负载对TiO2的能带结构没有很大的影响。然而,我们可以看到,TiO2-1.0mol%Cu/Ni(1∶1)在可见光范围内有一定的吸收。这说明TiO2和Cu/Ni合金之间存在着电子相互作用。由此,我们推测TiO2-1.0mol%Cu/Ni (1∶1)可能具有可见光催化活性。
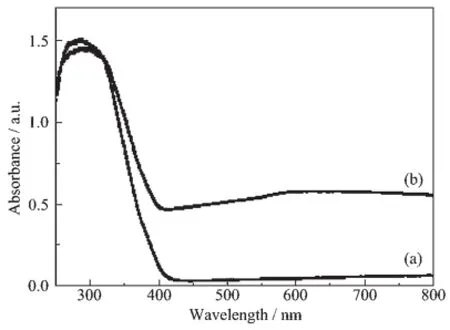
图4 (a)P25和(b)TiO2-1.0 mol%Cu/Ni(1∶1)的紫外-可见漫反射光谱Fig.4 Diffuse reflectance UV-Vis spectra of P25(a)and TiO2-1.0mol%Cu/Ni(1∶1)(b)
2.5 光催化实验
通过N2吸-脱附曲线测得TiO2-1.0mol%Cu/Ni (1∶1)的比表面积为49 m·g-1。这个结果表明我们有希望获得一个高效的光催化剂。为此,我们考察了其在光催化氧化苯制取苯酚中的应用。条件实验结果显示,当不加入TiO2-1.0mol%Cu/Ni(nCu/nNi=1)时,光照15 h后在反应体系中未检测到苯酚的生成。这表明苯比较稳定,需要在光催化剂的作用下才会发生氧化反应。图5示出了在可见光照射下,分别以TiO2-1.0mol%Cu/Ni(nCu/nNi=1)、TiO2-0.5mol%Cu、TiO2-0.5mol%Ni为催化剂时,苯氧化制取苯酚的动力学曲线。为了比较,我们还检测了在暗处TiO2-1.0mol%Cu/Ni(nCu/nNi=1)催化苯氧化制取苯酚的动力学曲线。如图5a所示,在可见光的照射下,TiO2-Cu/Ni对于苯氧化制取苯酚反应具有较高的光催化活性。光照7 h后,苯酚的产率可达18%。并且,从色谱图上我们这时没有观察到其它苯的衍生物生成。这些结果表明,对于苯氧化制取苯酚反应TiO2-Cu/ Ni是一个较为高效的可见光催化剂,在今后光催化合成苯酚中具有一定的应用前景。此外,我们由图5a还可以看到当光照时间大于7 h时,苯酚的产率随着光照时间的增加而逐渐降低。出现这种现象的原因可能是随着光照时间的延长,所生成的苯酚或者Cu-Ni合金发生了氧化。由图5b和图5c可知,TiO2-0.5mol%Cu对于苯氧化制取苯酚反应的光催化活性较低。光照7 h后,苯酚的产率仅为5%。而TiO2-0.5mol%Ni对于苯氧化制取苯酚反应没有光催化作用。这个现象表明Cu、Ni之间存在着很强的协同作用。在这里,起主要作用的可能是合金中的Cu组分。Ni组分的主要作用可能是通过调节肖特基能垒高度来使光生电子-空穴对的分离更为有效[15]。TiO2-Cu/Ni的较高的光催化活性可能就源于该协同作用。

图5 可见光照射下,使用(a)TiO2-1.0mol%Cu/Ni(nCu/ nNi=1)((Ⅱ)),(b)TiO2-0.5 mol%Cu(▲),(c)TiO2-0.5 mol%Ni(▼)为催化剂时的苯氧化制取苯酚的动力学曲线.以及在暗处(d)TiO2-1.0mol%Cu/Ni (nCu/nNi=1)(●)催化苯氧化制取苯酚的动力学曲线(苯:0.045 mol·L-1,H2O2:8.0 mol·L-1,乙腈:2.0 mol·L-1,催化剂:1.0 g·L-1)Fig.5 Time-courses of phenol production over TiO2-1.0mol%Cu/Ni(nCu/nNi=1)(a),TiO2-0.5mol% Cu(b)and TiO2-0.5mol%Ni(c)under visible-light as well as the time-course of phenol production over TiO2-1.0mol%Cu/Ni (nCu/nNi=1)(d)in dark at room temperature; (Benzene:0.045 mol·L-1,H2O2:8.0 mol·L-1, Acetonitrile:2.0 mol·L-1,Catalyst:1.0 g·L-1)
据此我们推测TiO2-Cu/Ni的光催化机理如下:由于Cu-Ni合金的负载以及水合肼的使用使得TiO2纳米粒子表面缺陷增多,导致TiO2禁带中的杂质能级增多,从而使TiO2纳米粒子对于可见光具有了一定的响应。在可见光的照射下,电子被激发到TiO2的导带上,形成空穴-电子对。TiO2上的空穴与双氧水反应生成了羟基自由基。在TiO2与Cu-Ni合金间的肖特基能垒的作用下,光生电子转移到Cu-Ni合金颗粒上,与O2反应生成O2-等氧活性物种,然后再转变为羟基自由基。最后,羟基自由基与苯反应生成苯酚。其中,Cu-Ni合金颗粒起着空穴-电子对分离中心和反应活性位的作用。在Cu-Ni合金颗粒的作用下,空穴-电子对的复合被有效抑制,从而使TiO2-Cu/Ni能表现出相当的光催化活性。我们的条件实验也证明了这一点。在相同条件下,使用纯TiO2纳米粒子作为光催化剂无法得到苯酚。此外,光在这个过程中起着促进双氧水分解生成羟基自由基的作用。图5d显示,在暗处TiO2-1.0mol%Cu/Ni(nCu/nNi= 1)对苯氧化制取苯酚反应具有一定的催化作用。反应7 h后,苯酚产率为13%。而在可见光的照射下,苯酚产率增加了近50%。这充分证明了光对苯氧化制取苯酚反应具有明显的促进作用。
由图5a和图5d,我们还可以看到在暗处反应时,苯酚产率随着反应时间的增加先上升然后急剧下降。当反应时间从7 h增加到15 h,苯酚产率从13%急剧下降至2%。与此相反,光照下,尽管苯酚产率随着反应时间的增加也呈现先上升然后下降的趋势,但下降速度缓慢得多。同样,当反应时间从7 h增加到15 h,苯酚产率只从18%下降至13%。一个可能的原因是,由于光照对双氧水分解的促进作用,导致在光照下大部分的双氧水在反应前期就分解了。这使得反应后期的双氧水浓度较低,不能有效地使苯酚发生进一步氧化。而在暗处,双氧水的分解较慢,使得在反应后期双氧水浓度的依然较高。在此环境中,苯酚很容易被氧化为苯二酚、苯醌[23],甚至被完全氧化为CO2和H2O[24]。因而导致了苯酚产率的急剧下降。这个结果进一步证明了光的作用主要是在催化剂的协助下加速双氧水的分解,进而促进苯氧化制取苯酚反应的进行。
图6示出了铜镍合金中铜镍物质的量的比对TiO2-Cu/Ni光催化活性的影响。如图6所示,镍负载的P25对苯氧化制取苯酚反应没有光催化活性。随着铜含量的增加,催化剂的催化活性显著增强。当nCu/nNi=1,TiO2-Cu/Ni的光催化活性达到最高。如继续增加铜的含量,TiO2-Cu/Ni的催化活性又开始逐渐减弱。我们推测可能的原因是:在铜镍合金中起主要作用的是铜。当铜镍物质的量的比较小时,随着铜含量的增加,助催化剂中活性组分及铜镍间协同作用也随之增加,从而铜含量的增加引起了TiO2-Cu/ Ni光催化活性的增强。当铜镍物质的量的比达到1∶1后,铜含量进一步的增加会使助催化剂的反应组分过多,诱发苯酚发生进一步的氧化反应,从而导致苯酚产率降低。此外,铜含量过大还会引起铜镍合金与TiO2间的肖特基能垒较小,不利于光生电子向铜镍合金颗粒转移,导致铜镍间协同作用减弱。这也许是苯酚产率降低的另一个原因。

图6 铜镍合金中铜镍物质的量之比对TiO2-1.0mol% Cu/Ni光催化活性的影响(苯:0.045 mol·L-1, H2O2:8.0 mol·L-1,乙腈:3.8 mol·L-1,催化剂: 1 g·L-1,反应时间:9 h,*代表无苯酚生成)Fig.6 Effect of the molar ratio of Cu to Ni on the photocatalytic activity of TiO2-1.0mol%Cu/Ni (Benzene:0.045 mol·L-1,H2O2:8.0 mol·L-1, Acetonitrile:3.8 mol·L-1,photocatalyst:1 g·L-1, Time:9 h,*:no phenol obtained)

图7 铜镍合金负载量对苯酚产率的影响(苯:0.045 mol·L-1,H2O2:8.0 mol·L-1,乙腈:3.8 mol·L-1,催化剂:1.0 g·L-1,nCu/nNi=1,反应时间:7 h,*代表无苯酚生成)Fig.7 Effect of the content of Cu/Ni alloy on the yield of phenol(Benzene:0.045 mol·L-1,H2O2:8.0 mol·L-1, Acetonitrile:3.8 mol·L-1,photocatalyst:1.0 g·L-1, nCu/nNi=1,Time:7 h,*no phenol obtained)
图7示出了铜镍合金的负载量对苯酚产率的影响。从图中可以看出,当负载量从0.1mol%增加到3.0mol%时,光照7 h后,苯酚的产率分别为:0、4%、9%、7%、3%。这表明开始时随着铜镍合金负载量的增加,苯酚的产率也随之显著增长。当铜镍合金的负载量超过1.0mol%后,负载量增加会导致光催化剂活性降低,即苯酚的产率下降。出现这种情况的原因可能是:当负载量不超过1.0mol%时,TiO2表面的活性位点随着铜镍合金负载量的增加而增加,这有利于光催化反应的进行。但当铜镍合金负载量过大时,负载的铜镍合金反而会成为光生电子-空穴的复合位点,增加了电子-空穴的复合几率,因此,过高的铜镍合金负载量不利于增强二氧化钛的可见光催化活性。
图8示出了光催化剂用量对苯酚产率的影响。从图中可以看出,在相同的反应条件下,不加催化剂时,未检测到苯酚的生成。加入催化剂后,苯酚的产率显著增加。当催化剂浓度由0.1 g·L-1增加到3.0 g·L-1时,苯酚的产率分别为6%、7%、9%、6%、5%。上述结果表明,催化剂浓度存在一个最佳值,催化剂浓度过高或过低均不利于光催化剂反应的进行。我们推测引起这种现象的原因可能为:开始时光催化反应的活性位点随着光催化剂用量的增加而增加,使得苯酚产率得以增高。但当光催化剂用量过大时,由于催化剂颗粒间的相互遮挡以及光散射的增加,使得TiO2对光的有效吸收下降,从而引起苯酚产率下降。此外,过多的光催化剂还可能引起H2O2的过快分解。这也许是导致光催化效果下降的另一个原因。

图8 TiO2-1.0mol%Cu/Ni(1∶1)用量对苯酚产率的影响(苯:0.045 mol·L-1,H2O2:8.0 mol·L-1,乙腈:3.8 mol·L-1,反应时间:7 h,*代表无苯酚生成)Fig.8 Effect of the dosage of TiO2-1.0mol%Cu/Ni(1∶1) on the yield of phenol(Benzen:0.045 mol·L-1, H2O2:8.0 mol·L-1,Acetonitrile:3.8 mol·L-1, Time:7 h,*:no phenol obtained)

表1 过氧化氢浓度、苯浓度以及乙腈浓度对苯酚产率的影响Table1 Effect of H2O2concentration,benzene concentration and acetonitrile concentration on the yield of phenol
表1列出了在可见光照射下,TiO2-1.0mol%Cu/ Ni(nCu/nNi=1)浓度为1 g·L-1时,过氧化氢浓度、苯的浓度以及乙腈浓度对苯酚产率的影响。从表1中可以看到,不加入双氧水的情况下,未检测到苯酚的生成。加入双氧水后,苯酚产率随着双氧水浓度的增加而增加,当双氧水浓度由1.0 mol·L-1增加到8.0 mol·L-1时,苯酚产率由6%增加到9%。我们推测可能原因是:在该反应体系中,双氧水作为氧化剂,为苯的羟基化反应提供所需的羟基自由基。随着双氧水浓度的增加,羟基自由基的浓度增加,有利于羟基化反应的进行。为了进一步确定双氧水在反应中的作用,我们在可见光照射下和暗处将双氧水与苯混合,考察了双氧水对苯的氧化行为。结果显示,当体系中不存在光催化剂时,无论是否光照,双氧水都无法将苯氧化为苯酚。这表明虽然双氧水在光催化反应中起着至关重要的作用,但只有在光和催化剂同时存在的时候,它才能有效地发生分解,生成羟基自由基。因此,光、催化剂、双氧水对于光催化苯氧化制取苯酚来说都非常重要,三者相辅相成,缺一不可。
当苯的浓度由0.03 mol·L-1增加到0.09 mol·L-1时,苯酚的产率由3%增加到9%。继续增加苯的浓度到0.45 mol·L-1,这时苯酚产率显著降低。这可能是因为,当苯的浓度过低时,在催化剂表面吸附的苯分子较少,光催化剂表面的活性位点未能得到充分利用,光催化效果较差。当苯浓度过高时,催化剂表面的活性位点达到饱和,多余的苯无法参与反应从而导致苯酚产率下降。当苯的浓度为0.045、0.09、0.225 mol·L-1时,光照9 h后,苯酚的产率分别为9%、9%、9%。虽然苯的浓度对苯酚产率基本无影响,但从节约成本考虑,本工作中我们选择苯的浓度为0.045 mol·L-1作为底物浓度。
在本工作中采用了由水和乙腈形成的两相体系作为反应介质,是因为乙腈有利于苯在水中的溶解,同时还有利于苯酚从催化剂表面脱附[25]。为了研究反应介质对光催化效果的影响,我们考察了乙腈浓度与苯酚产率的关系。从表1中可以看出,乙腈浓度是影响苯酚产率的一个重要因素。当乙腈浓度从0.5 mol·L-1增加到2.0 mol·L-1时,光催化反应效率逐渐提高,苯酚产率由12%提高到16%。随着溶剂的量继续增加,苯酚产率逐渐下降,当溶剂浓度为3.8 mol·L-1时,苯酚产率仅为9%。这是由于乙腈用量过多或过少时,都会使反应混合物难以形成均一的反应体系。
最后,从实际应用的角度出发,我们对TiO2-1.0mol%Cu/Ni(nCu/nNi=1)的循环使用性进行了评估。结果显示,在第一个循环中,苯酚产率为18%,而在第二个循环中,苯酚产率就急剧降到了3%。该结果表明催化体系的循环使用性不能令人满意,需要进一步提高。我们推测,这可能是由于在反应过程中Cu-Ni合金发生了氧化的缘故。为了证明这个推测,我们对使用过的TiO2-1.0mol%Cu/Ni(1∶1)进行了XPS检测。XPS结果显示,经过光催化反应,合金中的Cu没有被氧化,仍以金属铜的形式存在于TiO2上。但是,我们在用过的TiO2-1.0mol%Cu/Ni(nCu/nNi= 1)的XPS谱中没有观察到属于Ni的XPS峰。一个可能的原因是:在反应过程中,在大过量双氧水的作用下,镍被氧化变成了Ni2+。这些结果证明了我们的推测。TiO2-Cu/Ni光催化活性的下降主要应归因于Ni在光催化过程中的氧化。
3结论
综上所述,对于苯氧化制取苯酚反应TiO2-Cu/ Ni是一个较为高效的可见光催化剂,在今后光催化合成苯酚中具有一定的应用前景。并且铜镍合金是性能优良的助催化剂,可以明显增强TiO2在苯氧化制取苯酚过程中的光催化活性。在上述光催化过程中,铜镍合金间的协同作用起了非常重要的作用。今后利用该协同作用有可能得到更为高效的非铂光催化剂,相应的研究工作正在进行中。
[1]Yang H,Wu Q,Li J,et al.Appl.Catal.A,2013,457:21-25
[2]Koekkoek A J J,Kim W,Degirmenci V,et al.J.Catal., 2013,299:81-89
[3]Guo C,Du W D,Chen G,et al.Catal.Commun.,2013,37: 19-22
[4]Yuan C Y,Gao X H,Pan Z S,et al.Catal.Commun.,2015, 58:215-218
[5]Schmid R J.Appl.Catal.A,2005,280:89-103
[6]Hu L Y,Yue B,Chen X Y,et al.Catal.Commun.,2014,43: 179-183
[7]Xu D,Jia L H,Guo X F.Chinese J.Catal.,2013,34:341-350
[8]Park H,Choi W.Catal.Today,2005,101:291-297
[9]Devaraji P,Sathu N K,Gopinath C S.ACS Catal.,2014,4: 2844-2853
[10]Yuzawa H,Aoki M,Otake K,et al.J.Phys.Chem.C,2012, 116:25376-25387
[11]Ide Y,Matsuoka M,Ogawa M.J.Am.Chem.Soc.,2010, 132:16762-16764
[12]Zheng Z K,Huang B B,Qin X Y,et al.J.Mater.Chem., 2011,21:9079-9087
[13]Riaz N,Chong F K,Dutta B K,et al.Chem.Eng.J.,2012, 185-186:108-119
[14]Gao W L,Jin R C,Chen J X,et al.Catal.Today,2004,90: 331-336
[15]Tian H M,Kang S Z,Li X,et al.Sol.Energy Mater.Sol. Cells,2015,134:309-317
[16]Lu H Q,Zhao B B,Pan R L,et al.RSC Adv.,2014,4:1128 -1132
[17]WU Yu-Qi(吴玉琪),LÜ Gong-Xuan(吕功煊),LI Shu-Ben (李树本).Chinese J.Inorg.Chem.(无机化学学报),2010,26 (3):476-482
[18]YANG Li-Juan(杨立娟),LI Xiao-Wei(李晓伟),LIU Bin(刘斌),et al.Chinese J.Inorg.Chem.(无机化学学报),2007, 23(10):1717-1722
[19]Behnajady M A,Eskandarloo H.Chem.Eng.J.,2013,228: 1207-1213
[20]Li L Y,Xu Z Y,Liu F L,et al.J.Photochem.Photobiol.A, 2010,212:113-211
[21]Chen H,Zhou S X,Wu L M.ACS Appl.Mater.Interfaces, 2014,6:8621-8630
[22]Lee J W,Ahn T,Soundararajan D,et al.Chem.Commun., 2011,47:6305-6307
[23]Marino T,Molinari R,Garcia H.Catal.Today,2013,206:40-45
[24]Sonawane R S,Dongare M K.J.Mol.Catal.A,2006,243:68 -76
[25]Jiang W F,Wang W,Wang H L,et al.Catal.Lett.,2009, 130:463-469
Effect of Cu-Ni Cocatalyst on Visible Photocatalytic Activity of TiO2for Phenol Preparation
WEI Yuan KANG Shi-Zhao*LI Xiang-Qing QIN Li-Xia MU Jin
(School of Chemical and Environmental Engineering,Shanghai Institute of Technology,Shanghai 201418,China)
The Cu-Ni co-modified TiO2-based photocatalytic system was fabricated using TiO2nanoparticles as the main catalyst component by an impregnation process followed by a reduction procedure.The effect of Cu-Ni cocatalyst on the visible photocatalytic activity of TiO2for phenol preparation was studied using benzene as the starting material and hydrogen peroxide as the oxidant.The action mechanism of Cu-Ni cocatalyst for the photocatalytic activity of TiO2nanoparticles is discussed.The results show that the pure TiO2nanoparticles do not have photocatalytic activity for the phenol production from benzene under visible light irradiation.In contrast,the photocatalytic activity of TiO2nanoparticles can be enhanced obviously due to the introduction of Cu and Ni.The yield of phenol is 18%when the Cu-Ni co-modified TiO2nanoparticles are used as a photocatalyst.Moreover, there exists noticeable synergistic effect between Cu and Ni.The Cu-Ni co-modified TiO2nanoparticles exhibit much higher photocatalytic activity in comparison with that of the Cu or Ni alone modified ones due to the synergistic effect.These results imply that the cheap cocatalyst with outstanding performance than that of noble metals may be prepared by taking advantage of the synergistic effect between various metals.
benzene;phenol;TiO2;Cu/Ni cocatalyst;photocatalysis
O643
A
1001-4861(2015)08-1581-09
10.11862/CJIC.2015.198
2015-03-16。收修改稿日期:2015-05-19。
国家自然科学基金项目(No.21301118)和上海市教委科技创新重点项目(No.13ZZ135)资助。*

