蜜蜂气味结合蛋白的生化特性、系统进化、表达部位和生理功能的研究
赵红霞,曾鑫年,梁 勤,张学锋,黄文忠,陈华生,罗岳雄*
(1.广东省昆虫研究所,广东省野生动物保护与利用公共实验室,广东省农业害虫综合治理重点实验室,广州 510260;2.华南农业大学,广州 510642;3.福建农林大学,福州 350002)
蜜蜂作为一种社会性昆虫,依赖复杂丰富的嗅觉信息调整蜂群的各个方面,包括蜂群管理、任务分配、寻找蜜粉源、幼虫-成年蜂相互制约等(Dani,2005;Slessor,2005;LeConte,2008;Swanson,2009)。在蜜蜂的嗅觉系统中,多种蛋白参与了对气味分子的识别,在这些蛋白中,气味结合蛋白(odorant-binding proteins,OBPs)扮演了重要的角色,它主要存在于触角感受器的淋巴液中,作为运输疏水性气味分子到达受体的载体(王桂荣等,2002;赵慧婷等,2012)。近年来,国内外对昆虫感受气味物质化学模式的研究较多,但是对蜜蜂触角OBPs 的功能研究及其气味识别机制研究较少。本文综述了重要的模式昆虫-蜜蜂气味结合蛋白(OBPs)的研究情况,为深入了解其结构及其功能,科学饲养和管理蜂群,防治蜜蜂病害提供理论指导。
1 蜜蜂气味结合蛋白的生化特性
蜜蜂基因组(Honeybee Genome Sequencing Consortium)中包含21个编码气味结合蛋白的基因(Forêt and Maleszka,2006),而目前已知的其他昆虫 OBPs 家族数量均高于蜜蜂,果蝇Drosophila melanogaster 中发现了51个OBPs(Scafe et al.,2002),冈比亚按蚊Anopheles gambiae 有57个OBPs(Xu et al.,2003),疟 蚊Anopheles arabiensis OBPs 家族有32个成员(李正西等,2004),黄热蚊Aedes aegypti 基因组中发现66个OBPs(Zhou et al.,2008)。
蜜蜂气味结合蛋白(OBPs)是一类低分子量(一般约为15-18 kDa)的水溶性、酸性的球状蛋白,等电点4.4-5.2(Deyu,2000),与赤拟谷盗T.castaneum(Arathi et al.,2007)的OBPs 分子量大小相近,比果蝇(Scafe et al.,2002;Robertson,2003)和冈比亚按蚊(Hill,2002;Xu,2003)的OBPs 分子量小。
2 气味结合蛋白的结构与系统进化
蜜蜂气味结合蛋白的二级结构主要由α-螺旋和二硫键组成,结构相对保守(Picimbon,2001;Briand,2002;刘金香等,2005)。13个OBPs(1-13)属于传统的OBPs,典型的结构特征是具有保守的6个半胱氨酸,其排列顺序是CysⅠ-Cys Ⅲ,CysⅡ-CysⅤ,CysⅣ-CysⅥ;OBP14 的结构中具有5个半胱氨酸,缺少CysⅤ(Iovinella,2011);OBPs15-21 的序列中含有4个半胱氨酸,缺少CysⅡ和CysⅤ,他们之间的二硫键桥消失,这类OBPs 划为C-minus 端氨基酸;李红亮等通过对中华蜜蜂Apis cerana cerana 主要触角特异蛋白(触角特异蛋白antenna special protein,ASP)进行基因克隆和序列分析得出,Ac-ASP1 和Ac-ASP2 均具有6个保守的半胱氨酸,而Ac-ASP3 具有4个保守的半胱氨酸。通过多序列联配、系统发育树及序列相似性分析,中华蜜蜂AcASPs 除与西方蜜蜂Apis mellifera L.Am-ASP 亲缘关系较近(相似性达到80%以上)外,与其他膜翅目以及鞘翅目OBPs 及CSPs 也有一定的亲缘关系(相似性达到30%-60%),故而得出Ac-ASP1 和Ac-ASP2应属于气味结合蛋白OBPs 家族,Ac-ASP3 则属于化学感受蛋白家族CSPs(Li et al.,2007)。曹联飞等对中华蜜蜂气味结合蛋白OBP5 进行了序列分析,扩增了中华蜜蜂OBP5 的片段长度为528 bp,其中外显子序列有294 bp,编码98个氨基酸残基;同时,分别采用Kimura 双参数距离模型和氨基酸序列构建OBP5 邻接树,中华蜜蜂与西方蜜蜂为一个类群;选择压力检测显示中华蜜蜂OBP5 基因处于强烈的负选择压力下,一般负选择压力下的基因功能非常保守,对于维持中华蜜蜂的生长发育繁殖具有重要的作用。张小辉(2010)等对中华蜜蜂气味结合蛋白基因进行PCR 扩增和克隆,得到气味结合蛋白基因5、9、11、12 分别编码143、132、143、150个氨基酸残基;序列比对后同源性较低;并且序列内含有信号肽切割位点,位于22-24个氨基酸残基之间。
根据neighbor-joining 法建立蜜蜂OBPs 家族的系统进化无根树,蜜蜂气味结合蛋白的基因obps家族主要分布在9 号染色体和15 号染色体,以成簇形式排列在染色体上;其中基因obp2-8 成簇排列在9 号染色体上,而基因obp9 单独零散分布在9号染色体;基因obp13-21 成簇排列在15 号染色体。除此之外,基因obp1 位于2 号染色体,基因obp12 位于12 号染色体;基因obp10 和obp11 分别排列在第10 号染色体上头和尾位置,大概相距1 kb(图1)。传统OBPs 家族基因obp13 和具有4个半胱氨酸的C-minus obps(14-21)均位于15 号染色体,而且obp13 位于C-minus obps 群的树根部位;因此推测obp13 与C-minus obps 是由传统OBPs 家族的同一祖先进化而来,但基因obp13 中保留了6个半胱氨酸的特征,而C-minus obps 却只有4个半胱氨酸;C-minus obps 序列之间具有48%相对较高的序列相似性,而蜜蜂气味结合蛋白基因obps 家族序列间的相似性较低,序列相似性只有16%(Forêt and Maleszka,2006)。
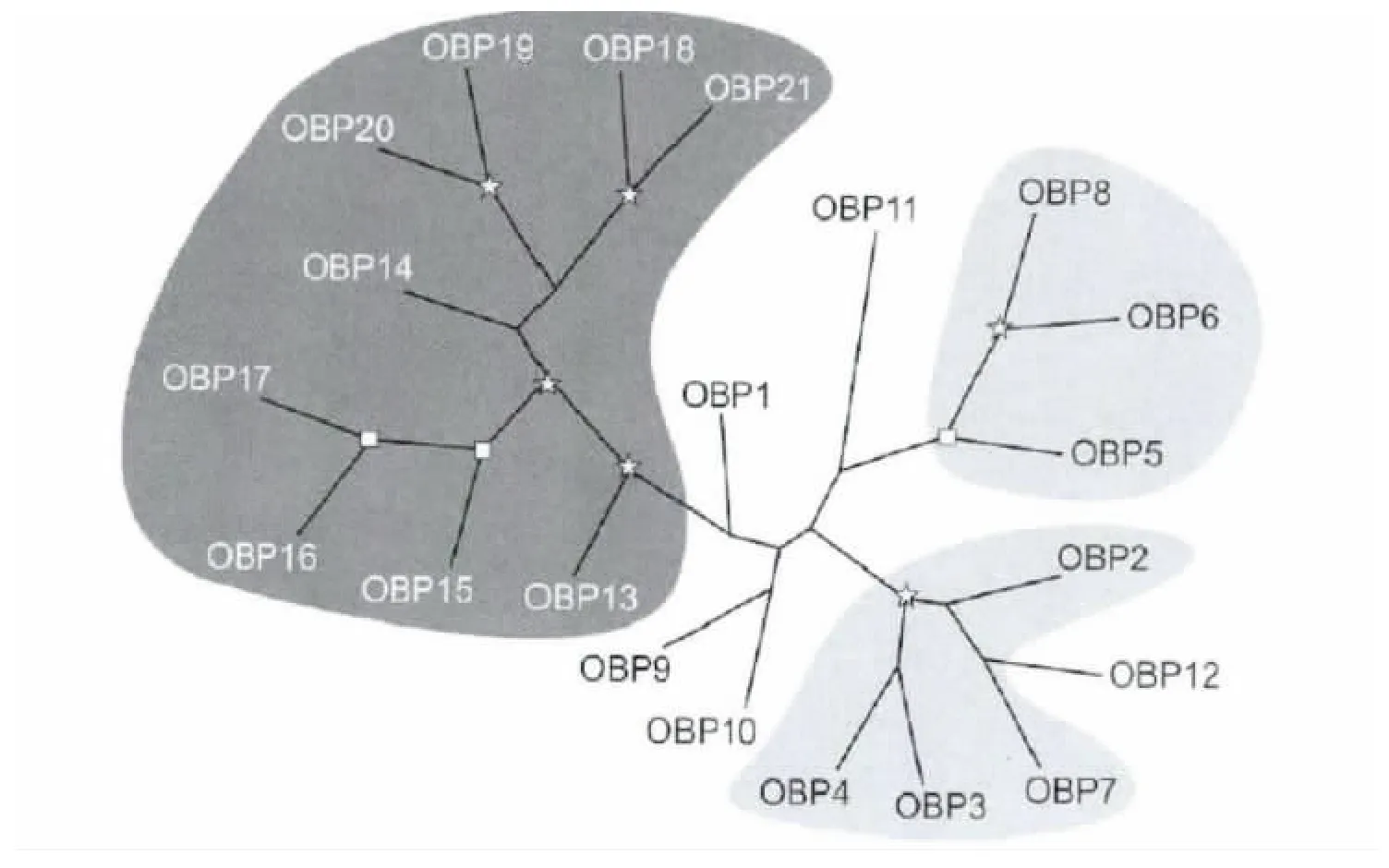
图1 蜜蜂气味结合蛋白家族OBPs 的系统进化树(Forêt and Maleszka,2006)Fig.1 Phylogeny of the OBP family in Apis mellifera
3 蜜蜂气味结合蛋白的表达部位
蜜蜂基因组中9个obps 基因(obp1,obp2,obp4,obp5,obp6,obp8,obp11,obp15,and obp12)主要表达在成年蜂触角中,足部和头部产生弱表达信号;其次,蜜蜂基因组中7个obps 基因(obp3,obp16,obp17,obp18,obp19,obp20 和obp21)在成年蜂身体的各个部位表达,可能与身体的各个部位存在化学感受器相关,诸如吻、咽和跗骨等部位。基因obp16-21 主要在成年蜂表达(部分在蜜蜂蛹后期),雄蜂上颚腺中也检测到基因obp18 和基因obp21(Iovinella,2011);除触角以外,基因obp3 在身体各个部位都有表达。某些基因obps 只在相对窄的发育阶段表达,如obp9 与母系遗传的表达模式一致,只在蜂王卵巢和早期胚胎中表达。虽然基因obp10 和obp11 相邻排列,却具有不同的时空表达:基因obp10 在蛹期和新出房的蜜蜂中表达量最高,随后表达量逐渐减弱;而基因obp11 在工蜂触角中表达。obp13 主要在幼虫和蛹中表达,基因obp14 和obp15 同样在幼虫和成蜂中表达。
中华蜜蜂化学感受蛋白(Ac-ASP1)的基因高丰度地表达于工蜂触角,而在其它器官(如头、胸、腹、翅及足)中呈低丰度表达;同时,该基因分别在幼虫、蛹期到6日龄以及21日龄前后具有两个表达高峰且表达丰度相当。Ac-ASP2 特异地表达于成年工蜂触角,在幼虫、蛹及其它器官中均不表达,在成年工蜂触角具有几个较高表达丰度的日龄,即1、9、15、27、30日龄;Ac-ASP3 除在触角中表达外在其它器官中也表达,但表达丰度不均一;其次,Ac-ASP3 具有两个表达高峰,第一个是蛹期到成年蜂6日龄期间具有高表达;第二个表达高峰位于成年蜂18日龄前后,其中前者的平均表达丰度约高于后者的两倍(李红亮,2007)。
气味结合蛋白OBPs 作为信息素的携带者,在蜂王和工蜂的上颚腺表达;同时,上颚腺中分泌大量化学信息素,只发现3个obps(13、14、21)基因的明显表达。依据级型和日龄,obp13 表达量以处女蜂王中最高,然后是刚出房的成年工蜂,表达量最低是执行巢内任务的成年工蜂,幼虫体内也可检测到该基因,但并未在雄蜂、交配后的蜂王和执行采集任务的工蜂中表达;同时,obp13不仅与日龄有关,而且出现在相应日龄的各个组织部位。油酸作为处女蜂王上颚腺分泌的主要物质,随着蜂王日龄的增加,上颚腺分泌的油酸浓度逐渐减弱。故而推测,该蛋白OBP13 可能具有溶解和释放油酸的功能。obp21 主要在老蜂上颚腺中表达,可以结合蜂王上颚腺释放的信息素物质:9-氧代-2-癸烯酸和羟苯甲酯,便于蜂王有效控制工蜂,维持蜂群的发展。法尼醇是由那氏腺体分泌物质,作为蜜蜂的一种追踪信息素;obp21编码的蛋白与法尼醇具有极高亲和性,通过气味结合蛋白OBP21 的介导,便于追踪信息素及时传递至蜜蜂中枢神经系统,产生相应的行为反应。obp14 主要在执行巢内任务的蜜蜂上颚腺中表达量最高,其次,幼虫中也具有丰富的表达;相反,老蜂和幼蜂中具有相对弱的表达,且未在采集蜂中检测到该基因(Iovinella et al.,2011)。
4 气味结合蛋白的生理功能
在许多陆生动物中,如哺乳动物和昆虫,水溶性物质围绕在化学感受神经元的周围,形成对挥发性、脂溶性分子的天然屏障;这些气味分子需要被气味结合蛋白识别、传递至相应嗅觉受体。气味结合蛋白识别气味分子介导至嗅觉感受神经元的观点,已被广泛接受。在气味识别过程中,OBPs 主要的生理功能如下:(1)OBPs 在气味识别中起到了外周滤器的作用,能够选择性识别和结合特异的气味分子;(2)OBPs 通过亲水性的淋巴液运输脂溶性气味分子;(3)OBPs 帮助气味分子通过特殊途径到达受体蛋白,促进了信号传导;(4)OBPs 可能清除外周感器中不需要或有毒物质;(5)OBPs 迅速使完成刺激的气味分子失活。在昆虫体内其他部位同样发现了气味结合蛋白的表达,它们也可能具有嗅觉识别以外的功能(Zhou,2008)。
根据气味结合蛋白的氨基酸序列同源性和生理功能的不同,一般将昆虫气味结合蛋白分为三类:(1)信息素结合蛋白(pheromone binding protein,PBP);(2)普通气味结合蛋白Ⅰ(general odorant binding proteinⅠ,GOBPⅠ);(3)普通气味结合蛋白Ⅱ(general odorant binding proteinⅡ,GOBPⅡ)。Danty 等(1997,1998)在西方蜜蜂中发现并确定了一类触角特异蛋白(antenna special proteins,ASPs),包括触角特异蛋白ASP1 和ASP2;这也是在膜翅目昆虫中首次发现的气味结合蛋白。原位杂交结果显示,基因ASP1 在工蜂和雄蜂的触角嗅觉器官中均大量表达(Danty,1999),主要与蜂王信息素物质结合;化学感受蛋白ASP2 是一种水溶性蛋白,因其高丰度地表达于工蜂触角,加之其结构上的特点,将化学感受蛋白ASP2 归为普通气味结合蛋白(Briand et al.,2002)。
文献报道OBPs 可能具有选择性结合的功能,但对于OBPs 具体的识别机制尚未明确。最初用同位素标记信息素或信息素类似物,将其与触角提取物混合后进行非变性电泳(PAGE)和转印后,利用放射性自显影观察结果,鉴定了第一个气味结合蛋白(Vandenberg,1987)。该方法不需要纯化蛋白,但是在非变性电泳中OBPs/配体复合物随时可能会解离导致结果不稳定,并且试验方法复杂、不安全且昂贵,所以未得到广泛应用(Vogt and Riddiford,1981)。随后,利用这些蛋白的共同特征,具有内源性的色氨酸在结合口袋内部能够和配体发生作用后使得荧光值明显发生改变,故而用于配体的检测试验。
通过荧光结合试验的方法,验证气味结合蛋白OBPs 能够选择性结合和区分不同的信息物质;编码气味结合蛋白OBPs 的基因通过体外异质系统(如在大肠杆菌表达系统中)表达,然后与不同的信息物质进行结合试验;其中OBPs 除了形成二硫键结构外,并没有其它的转录后修饰过程,同时已有试验证明体外异质表达的蛋白形成二硫键与体内气味结合蛋白的二硫键具有相同功能(Pelosi and Maida,1995;Lartigue,2002)。该实验利用荧光探针能与OBPs 疏水腔结合激发蛋白产生荧光的特性,加入待测试的气味分子与探针竞争OBPs 结合,观察荧光值的变化,气味分子与气味结合蛋白OBPs 结合能力越强,则将荧光探针从气味结合蛋白OBPs 的结合腔内取代的越多,探针激发的荧光值下降越快,可根据变化的荧光值计算解离常数;例如沙漠蝗Schistocerca gregaria 的化学感受蛋白与芳香族配体的结合(Ban et al.,2002)和甘蓝夜蛾Mamestra brassicae 与溴代衍生物的结合(Campanacci et al.,2003)。对于蜜蜂OBPs 的荧光结合试验也有相关的报道,蜜蜂气味结合蛋白OBP13 结合油酸及其结构相似的物质,气味结合蛋白OBP14 结合单萜类结构的物质,例如异戊基醋酸酯、2-庚酮(蜜蜂释放的一种报警激素)和丁香酚,与丁香酚结合效果最好。气味结合蛋白OBP21 结合9-氧代-2-癸烯酸、羟苯甲酯和法尼醇,该蛋白与法尼醇具有极高的亲和性,法尼醇是由那氏腺体分泌的一种蜜蜂追踪信息素物质;故而提出信息素腺体的OBPs 参与结合疏水性的化学信息素,并且协助释放或转移至适当的载体中。Danty et al.(1999)证实意蜂化学感受蛋白ASP1的三维结构与其它昆虫PBPs 类似,均具有6个螺旋构象(Danty et al.,1999);同时,在低pH 环境下,意蜂化学感受蛋白ASP1 与配体的结合能力较强,特别是能与蜂王信息素的主要活性成分特异结合(Lartigue,2004),相反,意蜂化学感受蛋白ASP2 不能与蜂王信息素的任何成分结合(Danty et al.,1997,1998);李红亮等(2008)通过体外克隆表达重组中华蜜蜂化学感受蛋白AcerCSP3,并利用荧光结合蛋白试验研究了基于N-苯基-1-萘胺(N-phenyl-1-naphthylamine,1-NPN)特异荧光配基,中华蜜蜂AcerCSP3 与花香气味的结合作用显著(Li,2007;李红亮等,2008);中华蜜蜂气味结合蛋白AcerASP2 与萜类物质β-紫罗兰酮具有较强的亲和力;同时与其他两种醛类物质(3,4-二甲基苯甲醛和苯甲醛)的结合力较强(李红亮等,2013)。
5 蜜蜂OBP 与嗅觉的关系
自然界中的气味物质有成千上万种,气味结合蛋白在气味物质的传递过程中起着重要作用,气味结合蛋白选择性识别结合一定类别的气味物质,在气味识别中起着外周滤器的作用。相对于冈比亚按蚊和果蝇,蜜蜂触角中气味结合蛋白的数量较少。因此,我们推测,相对于其他具有较多数量OBPs 的昆虫,可能蜜蜂的嗅觉区分能力相对较差;或者蜜蜂嗅觉系统借助于其他分子发挥嗅觉作用。针对蜜蜂气味结合蛋白OBPs 数量较少,提出以下三种假设,第一,化学感受蛋白家族具有嗅觉功能,可能具有携带气味物质的能力;膜翅目昆虫的化学感受蛋白CSPs 比OBPs 具有更多的嗅觉特异性(Ishida et al.,2002;Calvello et al.,2005),而蜜蜂化学感受蛋白CSPs 的数量与果蝇和冈比亚按蚊的CSPs 相近,同时,蜜蜂的部分CSPs 具有嗅觉功能(李红亮,2007)。第二,蜜蜂嗅觉受体数量是160-170个(Robertson et al.,2006),而果蝇嗅觉受体有62个(Robertson et al.,2003),按蚊有79个嗅觉受体(Hill et al.,2002);恰好与相对较少数量的气味结合蛋白互补;蜜蜂OBPs 作为媒介携带的气味分子,易于被较多数量的气味受体识别并传递给中枢神经系统。第三,研究发现蜜蜂具有大量触角叶,可能具有160-170个触角叶纤维球,触角叶中纤维球数量与蜜蜂嗅觉受体数量一致,触角叶内的化学信号整合气味分子的信息后传递至中枢神经系统,进而补偿了气味结合蛋白数量少的问题。
蜜蜂依赖气味结合蛋白完成了对外界成千上万气味物质识别过程的第一步,气味结合蛋白OBPs 参与识别转移疏水性的气味物质,进而产生相应的嗅觉行为反应。
6 展望
对于外界气味物质的嗅觉识别和传递过程,蜜蜂气味结合蛋白OBPs 作为媒介发挥了重要作用。目前蜜蜂气味结合蛋白OBPs 结构与功能的研究,虽不能完全阐明蜜蜂嗅觉感受机制,但已经明确了蜜蜂气味结合蛋白的生理生化特征和结合特性等,为将来进一步研究蜜蜂对化学信息的识别、接受、信号传递及其相应的行为反应等奠定了基础;便于掌握蜜蜂间的嗅觉感受机理,解释蜜蜂是如何感受和识别环境中的气味物质,及其相应的行为反应;更重要的是具有极高的生态和经济价值,且为其他昆虫或动物提供理论参考。
References)
Arathi HS,HO G,Spivak M.Inefficient task partitioning among nonhygienic honeybees,Apis mellifera L.,and implications for disease transmission[J].Animal Behaviour,2007,72:431-438.
Briand L,Swasdipan N,Nespoulous C,et al.Characterization of a chemosensory protein(ASP3c)from honeybee(Apis mellifera L.)as a brood pheromone carrier[J].European Journal of Biochemistry,2002,269(18):4586-4596.
Dani FR,Jones GR,Corsi S.Nestmate recognition cues in the honey bee:differential importance of cuticular alkanes and alkenes[J].Chemical Senses,2005,30:477-489.
Danty E,Arnold G,Huet JC.Separation characmon and sexual heterogeneity of multiple putative odorant-binding proteins in the honeybee Apis mellifera L.(Hymenoptera:Apidea)[J].Chemical Senses,1998,23(1):83-91.
Danty E,Briand L,Michard-Vanhee C.Cloning and expression of a queen pheromone-binding protein in the honeybee:An olfactoryspecific,developmentally regulated protein[J].Journal of Neuroscience,1999,19(17):7468-7475.
Danty E,Michard-Vanhee C,Huet JC.Biochemical characterization,molecular cloning and localization of a putative odorant-binding protein in the honey bee Apis mellifera L.(Hymenoptem,Apidea)[J].Febs Letters,1997,414(3):595-598.
Deyu Z,Leal W.Conformational isomers of insect odorant-binding proteins[J].Archives of Biochemistry and Biophysics,2000,397(1):99-105.
Forêt S,Maleszka R.Function and evolution of a gene family encoding odorant binding-like proteins in a social insect,the honey bee(Apis mellifera)[J].Genome Research,2006,16:1404-1413.
Hekmat-Scafe DS,Scafe CR,McKinney AJ.Genome wide analysis of the odorant-binding protein gene family in Drosophila melanogaster[J].Genome Research,2002,12:1357-1369.
Hekmat-Scafe DS,Scafe CR,McKinney AJ.Genomewide analysis of the odorant-binding protein gene family in Drosophila melanogaster[J].Genome Research,2002,12:1357-1369.
Hill CA,Fox AN,Pitts RJ,et al.G-protein-coupled receptors in Anopheles gambiae[J].Science,2002,298:176-178.
Iovinella I,Dani FR,Niccolini A.Differential expression of odorant-binding proteins in the mandibular glands of the honey bee according to caste and age[J].Journal of Proteome Research,2011,10(8):3439-3449.
Lartigue A,Gruez A,Briand L.Sulfur single-wavelength anomalous diffraction crystal structure of a pheromone-binding protein from the honeybee Apis mellifera L.[J].Journal of Biology Chemical,2004,279(6):4459-4464.
Lartigue K,Oldroyd B,Spivak M.Seven suggestive quantitative trait loci influence hygienic behavior of honeybees[J].Naturwissenschaften,2002,89:565-568.
LeConte Y,Hefetz A.Primer pheromones in social hymenoptera[J].Annual Review of Entomology,2008,53:523-542.
Li HL,Cheng JA,Gao QK.The chemosensory protein of Chinese honeybee,Apis cerana cerana:Molecular cloning of cDNA,immunocytochemical localization and expression[J].Chinese Science Bulletin,2007,52(10):1355-1364.
Li HL,Nie WM,Gao QK,et al.Cloning of cDNA encoding odorant binding protein ASP2 in working Bee's antenna of Apis cerana cerana and its prokaryotic expression[J].Scientia Agricultura Sinica,2008,41(3):933-938.[李红亮,聂文敏,高其康,等.中华蜜蜂气味结合蛋白ASP2 cDNA 的克隆及原核表达[J].中国农业科学,2008,41(3):933-938]
Li HL,Zhang LY,Zhuang SL,et al.Interpretation of odorant binding function and mode of general odorant binding protein ASP2 in Chinese honeybee(Apis cerana cerana)[J].Scientia Agricultura Sinica,2013,46(1):154-161.[李红亮,张林雅,庄树林,等.中华蜜蜂普通气味结合蛋白ASP2 的气味结合功能模式分析[J].中国农业科学,2013,46(1):154-161]
Li ZX,Shen ZR,Field L.Identify olfactory odorant binding protein and gene expression profiling of Anopheles gambiae and A.arabiensis[J].Science in China(Ser.C Life Sciences).2004,34(3):243-251.[李正西,沈佐锐,Field L.疟蚊Anopheles gambiae和A.arabiensis 嗅觉结合蛋白基因的鉴定和表达谱分型[J].中国科学(C 辑),2004,34(3):243-251]
Liu JX,Zhong GH,Xie JJ,et al.Recent advances in chemosensory proteins of insects[J].Acta Entomologica Sinica,2005,48(3):418-426.[刘金香,钟国华,谢建军,等.昆虫化学感受蛋白研究进展[J].昆虫学报,2005,48(3):418-426]
Pelosi P,Maida R.The physiological functions of odorant-binding proteins[J].Biophysics,1995,40(1):143-151.
Robertson H,Warr C,Carlson J.Molecular evolution of the insect chemoreceptor gene superfamily in Drosophila melanogaster[J].Proc.Natl.Acad.Sci.USA,2003,100:14537-14542.
Slessor KN,Winston ML,LeConte Y.Pheromone communication in the honeybee(Apis mellifera L.)[J].Journal Chemical Ecology,2005,31:2731-2745.
Swanson J,Torto B,Kells S.Volatile compounds from chalkbrood Ascosphaera apis infected larvae elict honeybee(Apis mellifera)hygienic behavior[J].Journal of Chemical Ecology,2009,35:1088-1116.
Vandenberg JD,Shimanuki H.Technique for rearing worker honeybees in the laboratory[J].Apiculture Research,1987,26:90-97.
Vogt RG,Riddiford LM.Pheromone binding and inactivation by moth antennae[J].Nature,1981,293(5828):161-163.
Wang GR,Guo YY,Wu KM.Progress in the studies of antenna odorant binding proteins of insects[J].Acta Entomologica Sinica,2002,45(1):131-137.[王桂荣,郭予元,吴孔明.昆虫触角气味结合蛋白的研究进展[J].昆虫学报,2002,45(1):131-l37]
Xu P,Zwiebel L,Smith D.Identification of a distinct family of genes encoding atypical odorant-binding proteins in the malaria vector mosquito,Anopheles gambiae[J].Insect Molecular Biology,2003,12:549-560.
Zhang XH,Zhu ZK,Qi YX.Obp 5,9,11,12 gene cloning and bioinformatics analysis of Apis cerana cerana[J].Heilongjiang Animal Science and Veterinary Medicine,2010,4(4):140-142.[张小辉,朱忠珂,祁艳霞.中华蜜蜂气味结合蛋白5,9,11,12 基因克隆及生物信息学分析[J].黑龙江畜牧兽医,2010,4(14):141-143]
Zhao HT,Gao PF,Zhang GX,et al.Advances in research on honeybee olfactory proteins[J].Chinese Journal of Applied Entomology,2012,49(5):1366-1371.[赵慧婷,高鹏飞,张桂贤,等.蜜蜂嗅觉相关蛋白的研究进展[J].应用昆虫学报,2012,49(5):1366-1371]
Zhou JJ,He XL,Pickett JA.Identification of odorant-binding proteins of the yellow fever mosquitoAedes aegypti:genome annotation and comparative analyses[J].Insect Molecular Biology,2008,17(2):147-163.

