超声引导下微波消融治疗甲状腺良性结节
曲 明,尹惠生,杨 强,沈英俊,齐秀艳,崔 蓬,史彦芬
临床上甲状腺结节十分常见,大多数为结节性甲状腺肿和腺瘤,少数为甲状腺癌,肉瘤罕见,甲状腺结节发病率为19%~67%[1]。但因压迫症状、影响美观、结节较大或多个结节导致正常甲状腺组织被侵蚀较多,甚至影响功能或结节生长较快、患者的癌变忧虑等原因,有些结节需要处理;外科手术切除是本病的主要治疗方法,但是存在手术创伤较大、术中腺体小结节易残存、累及正常甲状腺组织(尤其是位于腺体内不同部位的多发结节)、术后甲状腺功能低下、严重影响美观等问题。随着人们对形体美要求的提高,及最大限度减少术后甲状腺功能低下的发生,微创手术受到越来越多人的欢迎,尤其是女性患者。超声引导下射频和微波消融是近年来开展的治疗甲状腺良性结节新的微创方法,具有创伤小、见效快、治疗时间短、安全可靠、不影响美观等特点,已成为治疗甲状腺良性结节的主要治疗手段。目前,超声引导下微波消融治疗甲状腺良性结节方面的研究报告较少,笔者2011年07月—2013年12月共对1250例2173枚甲状腺良性结节实行超声引导下微波消融治疗,现报告如下。
1 资料与方法
1.1 研究对象 2011年07月—2013年12月,该院对1250例超声发现的甲状腺结节进行了治疗,入选条件如下:①甲状腺结节巨大,对周围组织、气管、食管、神经有明显压迫,有临床症状发生,影响正常生活和工作、学习;②患者对甲状腺结节忧虑,担心癌变,迫切希望尽快手术;③不愿意接受外科手术治疗;④合并心、脑、肺等多种脏器疾病,不能耐受外科手术治疗;⑤甲状腺部分或次全切除术后复发;排除合并亚急性甲状腺炎及甲亢的患者;男212 例,女 1038 例;年龄 21~78 岁,平均(47.4±11.6)岁;1250例患者甲状腺结节共2173枚,结节超声切面直径为 0.3~5.2 cm。 结节超声切面最大直径>3 cm者[3.1~5.2 cm,平均(3.78±0.29)cm]789 枚(36.3%),≤3 cm 者[0.3~3.0 cm,平均(1.45±0.73)cm]1384 枚(63.7%)。
1.2 仪器设备 超声仪为 Siemens Sequoia 512,探头频率7~14 MHz,具有CPS-Cadence造影软件平台;穿刺活检针为美国PRE Tru-Cut型,直径16 G,长度10 cm,切割槽长度2 cm。KY-2000型微波消融仪(南京康友微波能应用研究所,微波发射频率 2450 MHz,输出功率 5~100 W)及 ECO-100C微波治疗仪(南京亿高医疗设备有限公司,微波发射频率 2450 MHz±20 MHz,输出功率 0~150 W),发射形式为连续和脉冲。微波发生仪通过低损耗同轴电缆与16 G水冷Thy-ablation微波天线相连接。
1.3 手术方法 治疗前常规检查凝血酶原时间、血小板计数、甲状腺功能及相关甲状腺组织自身抗体、传染病等8项。常规甲状腺高频超声检查明确结节部位、数量、大小、有无钙化及囊性变、有无可疑淋巴结转移等特点。详细询问病史明确有无心脏支架或起搏器植入,有无甲状腺功能亢进、高血压、冠心病、支气管哮喘等;术前常规肌肉注射甲氧氯普铵预防恶心、止呕治疗,地塞米松5 mg静脉推注减轻组织水肿及不良应激反应;术中备用氨茶碱、乌拉地尔、硝酸甘油、肾上腺素、阿托品等急救药品;除颤仪、吸痰器备用。手术全程均在心电监护下进行。
1.3.1 麻醉方法和部位 超声引导下以1%利多卡因溶液分别麻醉皮肤穿刺点、穿刺路径、甲状腺包膜周围、颈动脉鞘与甲状腺体间隙;对位于腺体中、下极后方(气管、食管沟,喉返神经区)的甲状腺结节,尽量采用“低浓度低容量”麻醉法(内含0.5%的利多卡因溶液<5 ml),穿刺针头从甲状腺侧方进针,再进入甲状腺后方,边进针边注入少量麻药,使甲状腺腺体“上抬”,针头再进入甲状腺后内侧的真假包膜之间,注入麻药。而对于靠近气管的腺体中、上1/3交界以上的结节,也采用“低浓度低容量”麻醉法从气管前外侧方进针,进行麻醉;对于峡部的甲状腺结节,结节前方即靠近颈前肌群侧疼痛敏感区采用1%利多卡因溶液麻醉,结节后方即靠近气管侧采用“低浓度低容量”麻醉法。
1.3.2 “液体隔离带”形成方法 依甲状腺结节位置的不同在超声引导下对甲状腺前包膜与颈前肌之间、甲状腺外侧包膜与颈动脉之间、甲状腺内侧包膜与气管之间、甲状腺后包膜与喉返神经穿行区域以及与食管和甲状旁腺之间注射含0.5%利多卡因生理盐水溶液10~20 ml,如需追加液体,则再注入生理盐水即可,形成液体隔离带,使甲状腺与上述结构彼此分离,以保护颈前肌群、颈动脉、喉返神经、甲状旁腺、食管和气管。结节位置不同,方法也不同:①甲状腺结节位于腺体中下极时,通过腺体外侧下极准确地将针尖刺入气管与甲状腺真假包膜之间,同时避免刺穿气管,使含有结节的中、下极腺体上抬,向外、向上移动,将甲状腺结节与气管、食管、喉返神经等分隔开;②甲状腺结节位于腺体中上极及峡部靠近气管时,从气管前方穿越峡部最薄处,将隔离液注入甲状腺真假包膜之间,形成“月牙”状宽大隔离带,保护气管、食管及喉返神经免受热损伤。
1.3.3 穿刺活检 以针体轻便的美国 PRE Tru-Cut型弹射式切割针穿刺结节,获取组织学诊断标本。遇甲状腺结节钙化或甲状腺结节质地较硬时,需从不同平面或不同角度穿刺甲状腺结节,获取尽可能多的标本;如甲状腺结节靠近气管或颈动脉时,需后退穿刺针,不必强求取得满切槽标本,以免损伤气管和颈动脉。对彩色多普勒血流显像(CDFI)显示穿刺路径上血流信号丰富或者腺瘤滋养动脉丰富者,将微波消融针穿刺到相应的彩色信号处将其凝固以减轻切割式活检导致的出血[2]。
1.3.4 穿刺路径 根据甲状腺结节的位置及数量,小尖刀刀尖在相应颈侧方戳开1~2 mm小孔,作为穿刺点;多采用由颈外侧向内侧穿刺,此方法简单易行,超声显示器中能看到消融针的整个长度及针尖位置并以最小的热量接触“危险三角区”,其中包括喉返神经、气管及食管。消融针尽量穿过一定距离的甲状腺实质;对于多发结节,在超声引导下调整穿刺针的方向,或重新选择穿刺点,进行微波消融。
1.3.5 消融过程 消融治疗时,需在超声引导下把微波针的针尖准确穿刺入结节中,然后启动微波仪开始消融治疗。根据结节大小,微波输出功率一般为30~45 W,对结节直径≤6 mm者,功率设在20~25 W为宜;单区域消融时间20~60 s。整个过程必须全程在超声的连续监视下进行。可以看到随着微波能量的释放,微波针尖端“功能段”出现回声增强区并不断扩大;根据患者甲状腺结节的大小、位置、数目选用合适波段的微波消融针(3 mm或5 mm),结节超声切面最大直径≥1.5 cm且位置远离“危险三角区”者(即甲状腺腺体内侧缘与气管、喉返神经交界区域;见图1中三角所示),一般选用最大微波发射段长5 mm微波消融针;结节超声切面最大直径≤1.5 cm或结节最大直径>1.5 cm且靠近气管位置特殊者,可选用最大微波发射段长3 mm微波消融针;并根据个体情况选择单次或多次微波消融;若结节内伴有囊性变时,可先行囊液抽吸再进行消融治疗。之前血供丰富的区域在微波消融后血流信号消失作为微波消融成功的足够证据之一。消融后超声造影可精确反映消融区微循环灌注的毁损程度,增强术者判断的客观性[2]。>2 cm的甲状腺结节体积较大,避免消融不完全,消融结束时用活检针穿刺进行活检,来明确消融及炭化程度,如消融不完全,予以局部再次消融。微波消融针尖端完全包埋在甲状腺结节内部而不突出腺体外,是微波消融治疗甲状腺结节的安全前提(见图2)。

图1 “危险三角区”示意图

图2 甲状腺结节的微波消融
1.3.6 术后处理 术后局部压迫,适当对症治疗如止血、止痛、消肿等,抗生素应用1~2次或无须应用。对于年老体弱、合并心、肺、脑等多种疾病的老年高龄患者,予以心电监测、氧气吸入等处置。指导患者少食含碘食品、忌油腻及辛辣刺激性食物。
1.4 疗效评价 对结节较小(≤2.0 cm)术后随访1、3、6、12、18 个月,对结节较大(>2 cm)者随访时间可延长至24个月,最长随访36个月;超声随访观察甲状腺结节大小,计算体积及结节缩小率,监测结节血流信号消失程度。V=∏abc/6(其中V代表体积,a是最长的直径,b和c为另两个直径);结节缩小率:[(治疗前体积-随访时体积)/治疗前体积]×100%。观察消融后即刻穿刺活检标本,消融程度如何及炭化情况;病理科显微镜下观察组织细胞变性、凝固及坏死情况;观察超声造影消融区的充盈缺损是否完全;术后2周、1、3个月检测患者甲功包括FT3、FT4及TSH等,如甲状腺功能异常,可给予必要的服药治疗,随访时间也随之延长;记录相关并发症及其治疗、恢复情况。
1.5 统计学分析 所有数据采用 SPSS 13.0统计软件进行,计量资料采用(±s)表示,组间比较采用χ2检验,P<0.05 为差异具有统计学意义。
2 结 果
2.1 结节的消融及体积变化 对1250例2173枚甲状腺良性结节实行超声引导下微波消融治疗,225例3、5 mm微波消融针联合使用占18%(225/1250);1216例单次消融均取得理想效果;34例需要两次消融占 2.7%(34/1250),无一例需要 3次甚至多次消融。256例行消融后超声造影(20.5%,256/1250);>2 cm 884 枚甲状腺结节(40.7%)消融结束时用活检针穿刺进行活检,均取得理想的消融结果;甲状腺结节完全吸收最早为3个月,最晚为30个月;≤0.5 cm坏死病灶在术后3个月可自行消失;0.5~1.5 cm 坏死病灶在 3~12 个月消失;1.5~3.0 cm的坏死病灶在12~18个月消失;>3 cm坏死病灶消失时间在18个月以上;小结节快于大结节,囊性结节快于实性结节,炭化程度较轻的结节快于炭化严重的结节;术后随访:微波消融治疗后1、3、6、12、18、24个月,甲状腺结节体积均有不同程度缩小(图3a、3b),与治疗前比较差异均有统计学意义(P<0.05),见表 1。 术后 1、3、6、12、18、24 个月体积缩小率分别为 11.4%、28.6%、50.3%、79.1%、83.2%、94.2%,与文献报道相符[3]。 3 例患者在随访过程中超声发现原结节位置出现血流信号,消融区出现造影剂重新充填,考虑结节复发,予以第2次消融,复发率为 0.24%(3/1250);术后 2 周、1、3 个月检测患者甲功指标,FT3、FT4及TSH水平均位于正常值范围,与术前比较无明显统计学意义(P>0.05),见表 2。
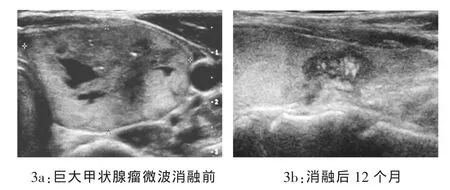
图3 巨大甲状腺瘤微消融前后比较

表1 微波消融前后甲状腺结节体积变化

表2 微波消融治疗前与治疗后甲状腺功能比较
2.2 并发症 所有患者在利多卡因局麻下均无明显的疼觉,本组病例中,有375例采用“低浓度低容量”麻醉法进行麻醉,术后均未出现声音改变;而结节位于甲状腺前方及侧方的875例采用1%的利多卡因溶液麻醉,其中352例术后出现声音改变,可自行缓解消失,持续时间1~2 h不等,与利多卡因局麻有关,利多卡因致声音改变的发生率为28.16%(352/1250);在开展初期有 6 例出现轻、中度声音嘶哑,3个月后声音恢复正常,无1例出现永久性声音改变,无食管烧伤、气管食管瘘等严重并发症,无甲状腺功能损害及甲状旁腺功能损害。1例右侧及峡部多个巨大结节患者,术后1周峡部出现局部红肿,大小约3 cm×2 cm波动感区,无皮肤坏死,给予及时切开引流,3周后完全愈合。
2.3 病理分析 对1250例均予以术中穿刺活检,活检成功率100%;所有患者均得到确切病理结果分析,14例出现少量乳头样结构,均未见恶性肿瘤细胞。对>2 cm甲状腺结节消融后即刻行穿刺活检,884枚甲状腺结节标本肉眼观可见颜色变白、灰白、浅褐色或淡黑色,光镜下见细胞变性,凝固、坏死、细胞核变小、固缩(图4a、4b);甲状腺结节细胞达完全灭活。

图4 消融即刻及消融后病理学检查比较
3 讨 论
3.1 甲状腺结节高发性及其微波消融 甲状腺结节的高发现率得益于人们健康查体意识的增强及高频超声的发展,随着人们对美容要求的提高,甲状腺结节的开放手术逐渐转向微创治疗;超声引导下经皮热消融治疗甲状腺良性结节自2001年问世以来,其具有创伤小、痛苦少、操作简单、疗效确切等优点,越来越受到世人瞩目;微波消融基本原理是,微波消融针传送的不是热量本身,而是具有传导能力的电磁波,引起甲状腺结节内部带电粒子的高速运动,通过粒子的摩擦产生60~110℃的热量,而且病灶组织越鲜活热量的生成和传播就越容易,最终甲状腺结节受到热力的破坏而发生凝固坏死,坏死的物质很快启动人体的免疫吞噬功能,将受到破坏的病灶组织溶解、吸收,最终消失殆尽。近年来,国内外少数学者利用射频消融技术治疗甲状腺肿瘤,而微波消融技术应用于甲状腺良性结节报道甚少;基于上述理论,本组对1250例2173枚甲状腺良性结节实行超声引导下微波消融治疗,术后1、3、6、12、18、24 个月随访体积缩小率分别为 11.4%、28.6%、50.3%、79.1%、83.2%、94.2%,取得非常理想的效果。
3.2 治疗术式的选择及与传统手术的对比 根据患者甲状腺结节的大小、位置、数目及反复多次实验得出的数据,通过调整功率及消融时间确保消融范围完全覆盖肿瘤且在保证穿刺精确的基础上,最大限度地避免周围正常腺体组织不必要的损伤。结节最大直径>1.5 cm且位置远离“危险三角区”者选用最大微波发射段长5 mm微波消融针;结节最大直径≤1.5 cm或结节最大直径>1.5 cm且靠近气管位置特殊者,可选用最大微波发射段长3 mm微波消融针;在保证充分热消融甲状腺结节的同时,避免热传递到邻近周围组织。甲状腺结节在腺体内空间位置的不同,如结节位于腺体后方、位于腺体内部靠近气管等位置,传统外科手术为了完整切除肿瘤,需要行甲状腺次全切除术或全切除术,对患者创伤极大,术后出现甲状腺功能低下,需要长期服用左甲状腺素片等;而微波消融只破坏肿瘤组织,最大限度地保留正常腺体,对甲状腺功能几乎没有影响,本组1250例术后2周、1个月、3个月常规检查甲状腺功能,包括FT3、FT3、TSH,与术前比较无明显统计学意义(P>0.05)。
3.3 对特殊情况的消融治疗策略 在临床手术当中会碰到以下情况:①肿瘤巨大;②腺体和结节界限不清,腺体密度低,与周围组织界限不清;③肥胖患者;④双侧均有巨大或多个肿瘤、消融时间长、局麻药剂量所限;⑤患有双侧巨大或多发结节的高龄、体质差患者同时合并高血压等心肺疾病者,不能长时间耐受手术;⑥消融过程中产生气体,短时间不能消散,影响视野,遮盖原有肿瘤的范围、界限和消融电极针尖的确切位置。在保证患者生命体征平稳的基础上,采用两次消融的办法 (1次/d或1次/隔日),尽量缩短手术时间、减少患者痛苦,保证消融效果;消融后彩色多普勒超声显示消融区的彩色血流信号完全丧失,而未受消融的正常甲状腺腺体区域血流信号不变;术后多次随访发现坏死组织周边实质细胞发生增生修复,坏死病灶由原位置向甲状腺体表、周边逐渐移动,在此过程中病灶逐渐缩小直至消失;超声影像未见残存甲状腺结节及在原肿瘤位置复发结节。超声造影检查显示消融区无造影剂充填,在随访过程中消融区也未再出现造影剂重新充填,提示没有新生血管形成。
3.4 微波消融的有效性及检测手段的选择 热能使甲状腺肿瘤细胞及其间质内血管发生蛋白质凝固坏死,脱水效应使组织变硬,坏死的组织通过机体免疫吞噬而逐渐萎缩至消失[2]。结节体积的大小、腺体本身的纤维化或钙化,甲状腺结节的炭化程度均影响到坏死组织的消失。对1250例患者进行术后随访24个月,2086个结节完全消失;在消融术后疗效观察中,超声、增强CT或MR检查是术后影像学随访的主要手段[5-7]。术后超声造影可精确反映消融区的毁损程度及日后是否复发,对以下类型要进行选择性超声造影,笔者的体会是:①多发且体积较小的甲状腺结节;②边界欠清,形态不规则的甲状腺结节;③腺体与结节密度接近,显示不清。通过超声造影,清晰地观察坏死病灶的消散情况及有无新生血管形成。对甲状腺结节消融后即刻行穿刺活检,微波消融通过迅速产生高温(60~110℃)使细胞变性坏死,标本肉眼观可见颜色变白、灰白、浅褐色或淡黑色,光镜下见细胞变性、凝固、坏死,细胞核变小和固缩。对甲状腺结节消融后即刻行组织穿刺特别是>2 cm的甲状腺结节,可以通过观察消融后穿刺标本结果调整消融功率及时间,既能保证完整消融,又不至于炭化,影响甲状腺坏死病灶缩小、消失时间,具有重要的临床意义。
3.5 并发症的预防及特殊区域应用 “低浓度低容量”麻醉法的重要意义
3.5.1 声音改变的原因 声音改变是热消融手术的严重并发症。声音改变的原因如下:①喉返神经直接损伤;②传导性喉返神经热损伤;③出血也可能导致声音变化;④声音改变另一个可能原因是微波消融术中喉返神经走行的变化;左喉返神经勾绕主动脉弓上升,位置较深且距正中平面较近,行程也长,多在气管食管沟内垂直上升,神经也多位于动脉后方;而右喉返神经勾绕锁骨下动脉斜行向上,距正中平面较远,位置也较表浅,多斜行于动脉前方[4];损伤右侧喉返神经的机会远比左侧多;⑤喉不返神经的出现;⑥再次或多次开刀手术后瘢痕粘连等。解剖位置的不同,处理甲状腺靠近气管的结节时,尤其仔细、小心、全神贯注,并让患者发音,借以了解是否有喉返神经损伤。甲状腺腺体中、上1/3后外侧缘有一结节状突出部分与气管关系紧密,1902年,由奥地利解剖学家Zuckerkandl最先提出并命名了Zuckerkandl结节,宽度在1~10 mm不等,在人群中普遍存在;喉返神经出胸廓后沿气管食管沟上行,于环甲肌下方入喉;当Zuckerkandl结节非常小或稍有增大时,喉返神经位于Zuckerkandl结节的前方,更常见的是喉返神经位于Zuckerkandl结节的后方,Zuckerkandl结节像桥一样跨越喉返神经之上;此处的甲状腺结节与喉返神经关系尤其紧密,尽量避免微波消融治疗,应在直视下开刀手术切除或摘除甲状腺,此点是我们最先提出。
3.5.2 “低浓度低容量”麻醉法的意义 甲状腺由颈中和颈下交感神经节的纤维支配,属于自主神经系统,甲状腺组织对疼痛并不敏感;对于气管旁间隙、甲状腺后方及内侧对疼痛敏感度低的区域,采用低浓度(0.5%利多卡因溶液)低容量(<5 ml)麻醉法,既能将甲状腺结节与周围气管、食管、神经等组织结构分离开,又能起到局部麻醉作用,同时不至于完全阻滞喉返神经,喉返神经仍可支配喉部肌肉收缩功能,不会引起声带麻痹和明显声音改变。支配甲状腺的神经属于自主神经神经系统,对疼痛敏感度低,而局麻药对神经、肌肉有一定的麻醉顺序:痛、温觉纤维>触压觉纤维>中枢神经元>自主神经>运动神经>胃肠平滑肌>骨骼肌;内含0.5%的低容量利多卡因溶液首先阻滞的是痛觉,然后是自主神经,经过大量的临床实践证明,“低浓度低容量”麻醉法在有效阻断痛觉的基础上,使喉返神经不被完全阻滞,以便于术者及时和准确发现是否有喉返神经损伤,在此危险区域治疗时,术者要经常让患者发音,当略有声音改变时,应立即停止消融,以免引起进一步器质性损伤;或应用低功率消融。对于峡部、甲状腺前方、侧方的甲状腺结节靠近颈前肌群,采用1%利多卡因溶液局部浸润麻醉,既能有效解除疼痛,又不会阻滞喉返神经。
3.6 “液体隔离带”的应用策略及意义 对于气管旁间隙、“危险三角区”、甲状腺后方及内侧对疼痛敏感度低的区域,在“低浓度低容量”麻醉法的基础上,应用生理盐水作为隔离液;而在峡部后方靠近气管区域以及腺体外侧缘靠近颈动静脉者,应用0.5%利多卡因溶液作为隔离液,既能将结节与气管,动、静脉隔离,又有范围较广的止痛作用,避免热损伤血管内膜,形成血栓。甲状腺结节位于腺体中下极时,可以通过腺体外侧下极将针尖刺入气管与甲状腺真假包膜之间,将腺体中、下极“上抬”,向外、向上移动,将甲状腺结节与气管、食管、喉返神经等分隔开;而结节位于腺体中上极时,由于甲状腺上动、静脉粗大及甲状腺悬韧带的存在,通过气管前方的皮肤、皮下组织,将针尖刺入气管与甲状腺真假包膜之间,使之分离,效果较好。本研究中很好地运用“液体隔离带”法来保护食管、气管、喉返神经以及皮肤、肌肉等组织。本组病例中,8例术后出现轻、中度声音嘶哑,主要发生在开展工作初期,发生率为 0.48%(6/1250),均于术后 2~3 个月完全恢复,原因可能为轻微热传导损伤喉返神经及术后早期粘连、水肿有关,无1例出现永久性声音改变,无食管烧伤、气管食管瘘等严重并发症发生,充分证明了“液体隔离带”的重要性。
总之,超声引导下微波消融治疗甲状腺良性结节具有创伤小、不影响美容(局部穿刺小孔一般于术后3 d可愈合,不留任何瘢痕)、准确度高、疗效确切、安全、可控性强、并发症少等优点,可替代传统开放手术,也是今后治疗的必然趋势。作为新生事物,目前仍存在一些问题尚待规范:比如其适应证、禁忌证、术前准备、穿刺路径、麻醉部位和方式以及并发症、处理原则等,需要广大临床工作者深入研究,不断改进操作方法,优化操作规程。笔者认为,超声引导下微波消融开启了甲状腺结节微创治疗的新时代。
[1]陈孝平,汪建平.外科学[M].第8版.北京:人民卫生出版社,2013:246.
[2]章建全,马 娜,徐 斌,等.超声引导监测下经皮射频消融甲状腺腺瘤的方法学研究[J].中华超声影像学杂志,2010,19(8):861-865.
[3] Kim YS,Rhim H,Tae K.Radiofrequency ablation of benign cold thyroid nodules:initial clinical experience[J].Thyroid,2006,16(3):361-367.
[4] 曹献廷.手术解剖学[M].北京:人民卫生出版社,1996:298.
[5] Smith S,Gillams A.Imaging appearances following thermalablation[J].Clin Radiol,2008,63(1):1-11.
[6] Okuma T,Okamura T,Matsuoke T,et al.Fluorine-18-fluorodeoxyglucose positron emission tomography for assessment of patients with unresectable recurrent or metastatic lung cancers after CT-guided radiofrequency ablation: preliminary results[J].Ann Nucl Med,2006,20(2):115-121.
[7] Svatek RS,Sims R,Anderson JK,et al.Magnetic resonance imaging characteristics of renal tumors after radiofrequency ablation[J].Urology,2006,67(3):508-512.

