缺氧缺血性脑损伤新生大鼠脑组织MMP-9、TIMP-1表达变化及意义
梅梅,李慧玲,李春玉,聂磊
(佳木斯大学附属第一医院,黑龙江佳木斯154002)
缺氧缺血性脑损伤(HIBD)以脑组织水肿、软化、坏死和出血为主要病变,其中脑水肿包括早期细胞毒性水肿和血脑屏障(BBB)损伤引起的血管源性脑水肿(VBE)[1~3]。基质金属蛋白酶(MMPs)是一组 Zn2+依赖的金属蛋白内切酶家族[4],其中MMP-9的活性受其金属蛋白酶组织抑制因子1(TIMP-1)的特异性抑制,二者在成年缺血再灌注脑损伤大鼠VBE的形成中发挥重要作用[5~7],但二者是否也参与了HIBD新生大鼠VBE的形成,目前国内报道较少。2013年5月~2014年12月,我们建立了新生大鼠HIBD模型,观察其脑组织MMP-9、TIMP-1表达变化,并探讨其与HIBD过程中VBE发病的关系。
1 材料与方法
1.1 材料 健康7日龄新生Wistar大鼠72只,雌雄各半,体质量雌性230~250 g、雄性310~340 g,购于佳木斯大学实验动物中心。MMP-9、TIMP-1兔多克隆纯化亲和抗体均购于北京博奥森生物技术有限公司,免疫组化试剂盒购于武汉博士德生物制品有限公司。TK-C721EC彩色摄像机购于北京杰伟世视频设备有限公司,BI-2000病理图像分析系统购于成都泰盟科技有限公司。
1.2 分组与造模 将72只大鼠随机分为观察组和对照组各36只。观察组吸入乙醚麻醉,仰卧位胶布固定于手术板上,常规乙醇消毒颈部皮肤;颈正中1 cm左右纵形切口,钝性分离皮下组织和肌肉。游离并暴露左侧颈总动脉,以5-0号丝线双线结扎后剪断,缝合皮肤,碘伏局部消毒。新生鼠返回母鼠身边恢复2 h后,置于自制37℃恒温水浴缺氧舱内;以1~2 L/min持续输入含8%氧气、92%氮气的混合气体,保持氧浓度为8.0% ±0.5%;2 h后将鼠取出,返回母鼠身边继续喂哺。对照组手术分离左侧颈总动脉后不结扎,缝合手术切口后返回母鼠身边喂哺,不予低氧处理。
1.3 标本处理 两组分别于造模后6 h(T0)、12 h(T1)、24 h(T2)、72 h(T3)、5 d(T4)、7 d(T5)各处死6只,断头取脑;以视交叉为切点,冠状位向后取一片厚约3 mm的组织;经常规甲醛固定、PBS冲洗、梯度乙醇脱水及二甲苯透明后,石蜡包埋切片。剩余脑组织保存待用。
1.4 脑组织病理观察 取两组造模后72 h的脑组织切片,常规HE染色,光镜下观察病理情况。
1.5 脑组织MMP-9、TIMP-1检测 采用免疫组化SP法。标本切片常规脱蜡至水,经过氧化氢室温孵育、蒸馏水冲洗后浸入枸橼酸盐缓冲液中,分别滴加稀释的一抗、二抗,PBS洗涤,DAB显色。以PBS代替一抗作为对照,MMP-9、TIMP-1阳性为细胞质染成浅黄色、棕黄色或棕褐色。每张切片400倍下随机选取不重复的6个视野,计算MMP-9、TIMP-1阳性细胞百分率。
1.6 脑组织含水量检测 取出剩余脑组织,于电子分析天平称其湿重;标本置于100℃烤箱中烘干24 h至恒重,再称其干重。脑组织含水量=(湿重-干重)/湿重 ×100。
1.7 统计学方法 采用SPSS13.0统计软件。计量资料以±s表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组脑组织病理情况比较 观察组大脑皮质水肿明显,细胞变性、坏死,层次混乱;神经元细胞数目减少,细胞外间隙增宽;炎性细胞增多,间质水肿明显。对照组脑组织细胞形态结构清晰完整,细胞核居中、核仁清楚,神经细胞胞体有突起伸出,间质内未见出血、坏死及水肿。
2.2 两组各时点脑组织MMP-9、TIMP-1表达及含水量比较 观察组脑组织MMP-9、TIMP-1表达及含水量均先升高后降低,对照组无明显变化。观察组T0~T5时点脑组织MMP-9、TIMP-1表达及含水量均高于对照组,P均<0.05。见表1。
表1 两组各时点脑组织MMP-9、TIMP-1表达及含水量比较(n=36, ± s)
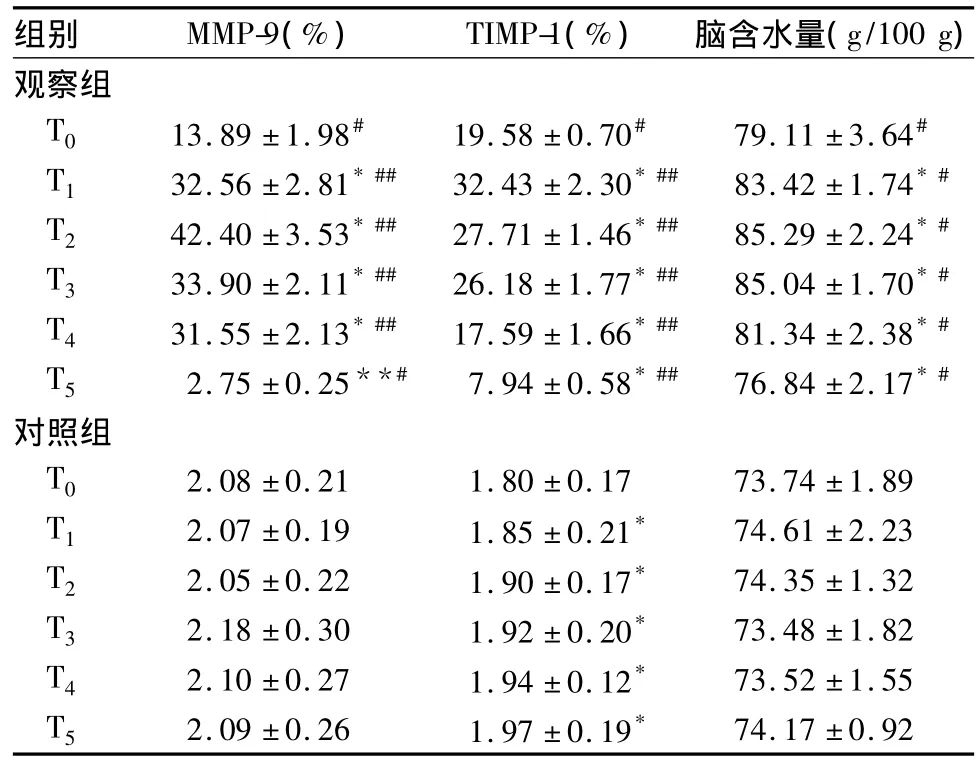
表1 两组各时点脑组织MMP-9、TIMP-1表达及含水量比较(n=36, ± s)
注:与同组T0时点比较,*P<0.05;与对照组同时点比较,#P<0.05,##P <0.01。
组别 MMP-9(%) TIMP-1(%) 脑含水量(g/100 g)74.17 ±0.92观察组T0 13.89 ±1.98# 19.58 ±0.70# 79.11 ±3.64#T1 32.56 ±2.81*## 32.43 ±2.30*## 83.42 ±1.74*#T2 42.40 ±3.53*## 27.71 ±1.46*## 85.29 ±2.24*#T3 33.90 ±2.11*## 26.18 ±1.77*## 85.04 ±1.70*#T4 31.55 ±2.13*## 17.59 ±1.66*## 81.34 ±2.38*#T5 2.75 ±0.25**# 7.94 ±0.58*## 76.84 ±2.17*#对照组T0 2.08 ±0.21 1.80 ±0.17 73.74 ±1.89 T1 2.07 ±0.19 1.85 ±0.21* 74.61 ±2.23 T2 2.05 ±0.22 1.90 ±0.17* 74.35 ±1.32 T3 2.18 ±0.30 1.92 ±0.20* 73.48 ±1.82 T4 2.10 ±0.27 1.94 ±0.12* 73.52 ±1.55 T5 2.09 ±0.26 1.97 ±0.19*
3 讨论
MMPs在生理条件下主要以无活性的酶原形式存在,在脑缺血及炎症介质的刺激下可转化为活性成分[8]。其中,与 BBB破坏关系最为密切的是MMP-9[9,10],其对于毛细血管基膜的破坏可能是神经炎症反应所致BBB损伤的一条最终共同通路[11]。Rosenberg等[12]发现,MMP-9 通过降解毛细血管基底膜而破坏BBB,产生继发性组织损伤,且活性MMP-9的出现与BBB开放时间一致。Gasche、Fujimura 等[13,14]发现,早期活化的 MMP-9 是导致BBB破坏和VBE形成的主要原因。因此,MMP-9激活导致BBB通透性改变,是HIBD过程中VBE形成和继发性脑损伤的关键因素。
TIMP-1可由巨噬细胞、角质细胞、成纤维细胞、平滑肌细胞和内皮细胞合成,是MMPs的内源性组织抑制因子,主要从两个方面抑制MMPs活性。在酶原活化阶段,TIMP可与MMPs形成稳定复合物而阻碍MMP的酶原自我激活;在活化的MMPs阶段,可直接与活化的MMPs形成紧密的1∶1复合体而抑制其活性。TIMP-1可与MMP-9特异性结合,形成可溶性非共价复合物,从而在蛋白水平调节其活性。最近研究发现,TIMPs不仅是MMPs抑制剂,还可能在MMPs的激活级联过程中扮演重要角色。但是,国内对于二者是否参与了缺血性脑血管病后BBB损害和VBE形成,以及在此过程中的变化规律等方面的研究甚少,在新生儿HIBD领域也少有报道。
本研究发现,观察组大脑皮质水肿明显,细胞变性、坏死,神经元细胞数目减少,炎性细胞增多;而对照组脑组织细胞形态结构清晰完整,间质内未见出血、坏死及水肿。同时本研究中,观察组脑组织含水量呈先升高后降低趋势,各时点脑组织含水量均显著高于对照组,说明在HIBD过程中有明显的脑水肿形成。观察组脑组织MMP-9表达先升高后降低,且时相变化与BBB第二次双相开放模式的时间一致;说明MMP-9参与了BBB的破坏过程,是VBE形成的主要机制之一。本研究中,观察组脑组织TIMP-1表达也是先升高后降低,但是与MMP-9表达变化并不完全平行,其高峰时段存在差异,可能与HIBD过程中诱导MMP-9大量表达时TIMP-1的耗竭有关[15,16]。因此,HIBD 新生大鼠脑组织 MMP-9和TIMP-1表达升高,且呈时间依赖性,二者可能与HIBD过程中血管源性脑水肿的形成有关。
[1]Rosenberg GA,Navratil M,Barone F,et al.Proteolytic caseade enzymes increase in focal cerebral isehemia in rat[J].Cereb Blood Flow Metab,1996,16(1):360-366.
[2]Celotti E,Ferrarini R,Zironi R,et al.Resveratrol content of some wines obtained from dried Valpolicella grapes:recioto and amaron[J].J Chromatogr A,1996,730(1-2):47-52.
[3]Sun ZJ,Pan CE,LiuHS,et al.Anti-hepatoma activity of resveratrol in vitro[J].World J Gastroenterol,2002,8(1):79-81.
[4]Lee SR,Lo EH.Induction of caspase-mediated cell death by matrix metalloproteinases in cerebral endothelial cells after hypoxiareoxygenation[J].J Cereb Blood Flow Mletab,2004,24(7):720-727.
[5]Yand GY,Louis A.Reperfusion induced injury to the Blood Brain Barrier after middle cerebral artery occlusion in rats[J].Stroke,1994,25(11):1658-1665.
[6] Belaye L,Busto R,Zhao W,et al.Quantitative evluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats[J].Brain Bes,1996,739(432):88-96.
[7]Preston E,Sutherland G,Finsten A,et al.Three openings of the blood-brain barrier produced by forebrain ischemia in the rat[J].Neurosci Lett,1993,(149):75-78.
[8]张人锡.脑外伤脑水肿与脑缺血脑水肿[M].北京:北京医科大学出版社,1999:1073-1085.
[9]Romanic AM,White RF,Arthony AJ,et al.Matrix metalloproteinase expression increases after cerebralal focal ischemia in rats[J].Stroke,1998,29(11):1020-1030.
[10]Preston E,Foster DO.Evidence for pore-like opening of bloodbrain barrier following forebrain ischemia in rats[J].Brain Res,1997,761(23):4-10.
[11]陈兴洲,陆兵勋,石向群,等.大鼠大脑中动脉暂时性闭塞后脑毛细血管内皮细胞调亡[J].中风与神经疾病杂志,1998,15(4):195-197.
[12]Rosenberg GA,Dencoff JE,McGuine PG,et al.Injury induce 92KDs gelatinase and urokinase expression in rat brain[J].Lab Invest,1994,71(3):417-422.
[13]Gasche Y,FujimuraM,Morita-Fujimura Y,et al.Early appearance of activated matrix metalloproteinase-9 after focal cerebral ischemia in mice:a possible role in blood-brain barrier dysfunction[J].Cereb Blood Flow Metab,1999,19(9):1020-1028.
[14]Fujimura M,Gasche Y,Morita-Fujimura Y,et al.Early appearance of activated matrix metalloproteinase-9 and blood-brain barrier disruption in mice after focal cerebral ischemia and reperfusion[J].Brain Res,1999,842(1):92-100.
[15]Rosenberg GA,Navratil M.Metalloproteinase inhibition blocks edema in intracerebral hemorrhage in the rat[J].Neurology,1997,48(4):921-926.
[16]Kahari VM,Saarialho-Kere U.Matrix metalloproteinases and their Inhibitors in tumor growth and invasion[J].Ann Med,1999,31(4):34-45.

