重型颅脑损伤中远期并发垂体功能低下的高危临床因素分析
梁观钦,蔡厚洪,郭汝翠,李春雨,林绍仪,吴举,肖斌
重型颅脑损伤中远期并发垂体功能低下的高危临床因素分析
梁观钦,蔡厚洪,郭汝翠,李春雨,林绍仪,吴举,肖斌
目的:分析重型颅脑损伤(TBI)在中远期(伤后>6个月)发生垂体功能低下的类型特点及相关临床因素。方法:回访检测我院重型TBI患者117例在中远期的垂体激素水平、评估垂体功能并回顾性分析患者的临床因素,包括年龄、性别、损伤类型、格拉斯哥昏迷量表(GCS)评分、手术、脑疝、颅底骨折及外伤性蛛网膜下腔出血(tSAH)等。将以上因素与中远期并发垂体功能低下进行卡方检验及多因素Logistic回归分析。结果:117例重度TBI患者中有49例并发中远期垂体功能低下,垂体功能低下的发生与患者的年龄、性别、损伤类型、是否手术无关,而与患者的GCS评分≤5分、脑疝、tSAH及颅底骨折密切相关。结论:GCS≤5分、脑疝、tSAH及颅底骨折,是重型TBI中远期并发垂体功能低下的高危临床因素。
创伤性脑损伤;中远期;垂体激素;格拉斯哥昏迷量表
外伤性垂体功能低下是创伤性脑损伤(traumatic brain injury,TBI)常见的并发症之一,尤多见于重型颅脑损伤患者[1,2]。目前,国内对于重型TBI中远期并发垂体功能低下的类型特点及相关临床因素的研究甚少。本文即对此进行研究。
1 资料与方法
1.1 一般资料
选择2011年1月至2013年8月我科收治的确诊为重度TBI患者117例,男89例,女28例;年龄15~67岁,平均(41.3±13.5)岁;格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分≤8分。
1.2 方法
1.2.1 临床因素 患者的年龄、性别、损伤类型(开放或闭合)、GCS评分、是否手术、脑疝、颅底骨折及外伤性蛛网膜下腔出血(traumatic subarachnoid hemorrhage,tSAH)等入选为研究的临床因素。头颅CT影像:明确tSAH、脑挫裂伤、脑疝、颅骨骨折等情况。脑疝诊断依据:CT提示中线偏移≥1 cm、环池不显影、瞳孔散大。颅底骨折诊断:头CT结果结合临床表现,如脑脊液漏或颅神经损伤等。tSAH诊断依据:CT显示SAH或腰椎穿刺脑脊液检查为血性。
1.2.2 检测垂体激素 于伤后6个月,通过化学发光免疫法测定患者垂体激素,包括促黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone,FSH)、催乳素(prolactin,PRL)、生长激素(growth hormone,GH)、促甲状腺激素(thyroid stimulating hormone,TSH)、睾酮T、雌二醇、游离甲状腺素(free thyroxine,FT4)、皮质醇(cortisol,COR)。采用胰岛素低血糖试验检测GH、COR,其余激素(包括COR)采用检测基础水平(早晨8:00~9:00)。检验仪器:Backman生产的Access II化学发光免疫分析仪及配套试剂检测。结果为全自动微粒子化学发光免疫分析系统分析。
垂体功能低下诊断依据:GH缺乏:GH≤3μg/L。促肾上腺皮质激素(adreno-cortico-tropic-hormone,ACTH) 缺乏:皮质醇基础水平<100 nmol/L或胰岛素低血糖试验检测<500 nmol/L。TSH缺乏:FT4降低而无TSH升高。LH/FSH缺乏:男性,睾酮降低、无LH/FSH升高;绝经前女性,雌二醇降低、无FSH/FSH升高;围绝经期女性,LH/FSH降低。高泌乳素血症:基础泌乳素水平高于正常[8,14,17]。
1.3 统计学处理
2 结果
2.1 垂体功能低下的发生率及类型
本组117例中发生垂体功能低下49例(41.88%),纳入垂体低下组,其中单项垂体激素缺乏28例(23.93%),2项及以上缺乏21例(17.94%)。垂体激素类型:TSH缺乏28例(23.93%),高泌乳素23例(19.65%),ACTH缺乏11例(9.40%),GH缺乏21例(17.94%),LH/FSH缺乏14例(11.96%)。
2.2 单临床因素分析
本组垂体低下组49例,男39例,女10例;平均年龄(42.0±14.2)岁;平均损伤后时间为(276.0± 71.0)d;开放性损伤21例,闭合性损伤28例;GCS≤5分(特重度TBI)12例,5分<GCS≤8分(重度TBI)37例;手术治疗35例,非手术治疗14例;脑疝33例,未脑疝16例;颅底骨折34例,未颅底骨折15例;tSAH39例,无tSAH10例。
垂体正常组 68例,男50例,女18例;平均年龄(40.8±13.0)岁,平均损伤后时间为(297.0±143.0)d;开放性损伤39例,闭合性损伤29例;GCS≤5分5例,5分<GCS≤8分63例;手术治疗49例,非手术治疗 19例;出现脑疝22例,未出现脑疝46例;颅底骨折21例,未颅底骨折47例;tSAH 22例,无tSAH 46例。
2组年龄(t=0.484,P=0.629)及伤后时间(t=0.951,P=0.344)差异无统计学意义。与垂体功能低下发生相关的因素为:GCS评分 (χ2=6.734,P=0.009),脑疝(χ2=14.000,P<0.01),颅底骨折(χ2= 16.950,P<0.01),tSAH(χ2=25.458,P<0.01),而与性别、损伤类型及是否手术无关。不同临床因素对垂体功能低下导致的激素异常率有一定差异,见表1。
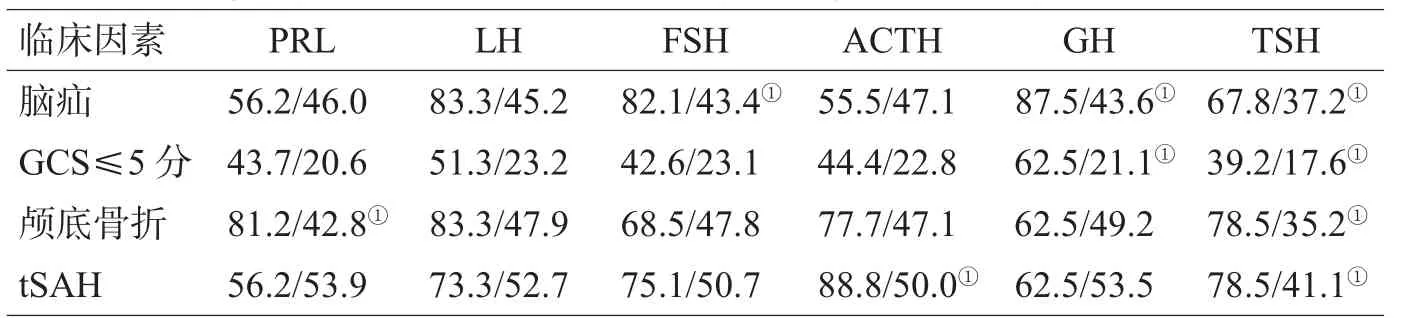
表1 不同临床因素对垂体功能低下导致的激素异常率的比较(垂体低下组/垂体正常组)
2.3 Logistic多因素分析
对脑疝、GCS、颅底骨折、tSAH等因素进行多因素Logistic回归分析结果显示:脑疝、颅底骨折、tSAH及GCS≤5分等临床因素均为重型TBI中远期并发垂体功能低下的高危因素,见表2。
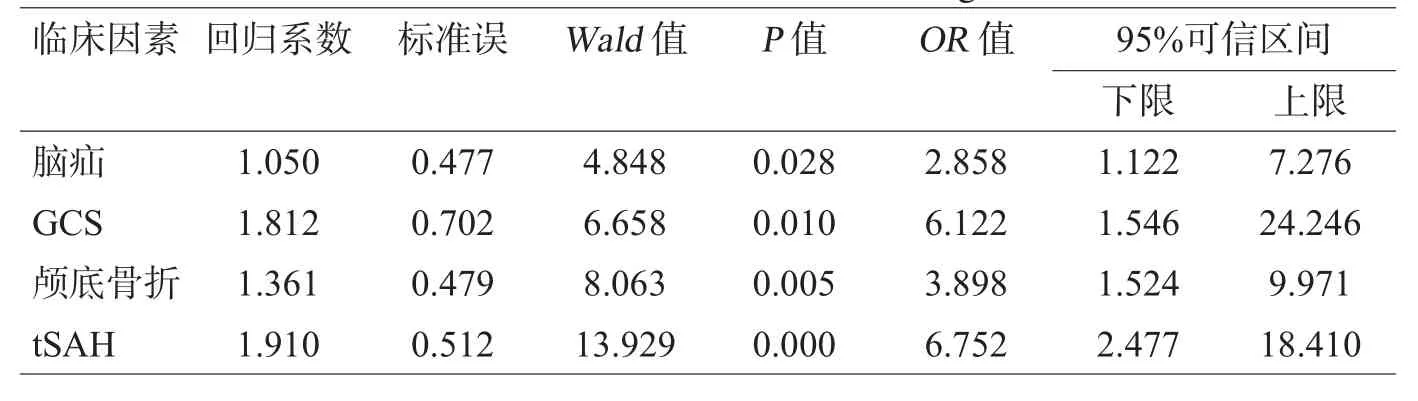
表2 重型TBI中远期后垂体功能低下的多因素Logistic回归分析结果
3 讨论
大量文献报道,TBI患者伤后出现垂体功能低下的发生率可高达40%以上,多见于重型颅脑损伤者[3,4,20]。垂体位置固定、供血较为单一,垂体前叶的血供70% ~90%来自长门静脉,损伤后复原困难,可引起垂体功能低下[5]。TBI后垂体功能低下导致的单项激素缺乏较多项缺乏发病率高,可能与后期垂体门脉血管重建修复有关[5,6]。TBI后垂体激素异常可分为功能性及分泌性[4]。功能性激素异常可随着病程的延续治疗而自愈[5];而分泌性可为急性期的延续,亦可后期新出现[8-10]。TBI 后6个月内,约50%的激素紊乱者可恢复正常,极少部分患者在伤后6个月内新发生垂体功能紊乱,可能与垂体及漏斗部结构萎缩有关[9,11,12]。所以,重型TBI患者在中远期进行垂体功能检测更具有临床诊治意义。
本研究结果显示,GCS评分≤5分、脑疝、颅底骨折及tSAH是重型TBI中远期并发垂体功能低下的高危临床因素,与Schneider等[2]报告的结果大致相同。可能与下列机制有关:①tSAH可改变脑脊液的粘稠度、比重、循环速度等,导致脑脊液循环障碍。血性脑脊液的血细胞、蛋白难以通过血脑屏障而堵塞蛛网膜颗粒、破坏血脑屏障,可引起脑积水,影响垂体局部血运障碍,间接刺激下丘脑垂体系统,影响其正常的激素分泌。血性脑脊液及其分解的产物引起的内皮质、炎症因子等强烈血管收缩因子可导致垂体供血血管痉挛,导致垂体出现其缺血缺氧[13,19]。②脑疝时颅内压高,中线结构移位,压迫垂体下丘脑组织及周围供血血管,使下丘脑垂体缺血、梗死甚至坏死[6,15]。③中颅窝骨折可对垂体及周围血管造成直接的机械性损伤,而由于蝶鞍骨性结构限制加重挫伤水肿的垂体受压、静脉回流受阻,进一步缺血、梗死。部分TBI后垂体功能低下患者后期的MR成空蝶鞍影像支持这一理论。但本次垂体低下组中有13例(38.2%)仅合并前颅窝骨折。颅底骨折导致的脑脊液漏导致脑脊液容量减少、循环路径发生变化,使垂体神经细胞的内环境改变,相关的神经核团发生功能障碍也是其原因之一[5,6,15];④GCS评分≤5分者较 5<GCS≤8分者发生率高,提示损伤程度越严重,TBI后垂体激素异常的发生率越高。由于特重型颅脑损伤者原发性脑损伤严重,弥漫性脑肿胀、伴有多发轴索、丘脑垂体轴损伤几率大。弥漫性损伤的旋转性外力可造成脑桥蓝斑核、中脑网状结构、下丘脑损伤,导致后期垂体功能低下[4,13]。颅脑损伤的严重程度及继发性的颅脑损伤是高危因素[15-18,20,21]。
本组病例显示,合并脑疝者趋向并发FSH、GH、TSH缺乏,合并颅底骨折趋向并发PRL、TSH缺乏,合并tSAH者趋向并发ACTH、TSH缺乏,而GCS评分≤5分者则趋向并发GH、TSH缺乏。目前,临床上仍缺乏足够随机对照双盲试验资料来解决关于脑外伤后激素缺乏的危险预测因素、界值、评估流程、替代治疗、临床随访等问题,需要进一步研究[22]。
多项研究显示,TBI后持续的垂体功能低下激素类型以GH、LH/FSH、TSH、ATCH缺乏为主[4,21]。由于选择研究内容和条件的差异,各家报告的激素类型及发病率存在差异。本组结果:垂体功能低下的激素类型发生率依次为TSH、PRL、GH、LH/FSH、ACTH。其原因可能与促甲状腺激素细胞、促性腺激素细胞、生长激素细胞位于长门静脉供血边缘的解剖位置,容易损伤有关。
TBI后垂体内分泌的变化及临床表现极其复杂。重型TBI患者相当一部分合并严重的神经后遗症,缺乏自知能力,难以区分垂体激素缺乏导致的神经症状。本组垂体低下组患者中,仅有4例TSH缺乏者出现头发稀疏、干燥易脱落、黏液性水肿肌软弱乏力、肌腱反射减弱等表现;3例女性PRL缺乏者出现溢乳、闭经或月经不调;3例女性、1例男性LH/FSH缺乏者出现闭经、月经不调、性欲或性功能减退。TBI后垂体功能低下导致的激素缺乏临床症状及预后的影响,还需大量的病例观察及随访研究。
尽管个例报道,激素替代治疗对神经康复的疗效良好[5],但是否常规给予相关激素替代治疗及疗效存在争议。本组9例垂体激素低下患者接受了相应的激素替代治疗,仅1例TSH缺乏和1例ACTH患者的精神淡漠、反应迟钝、嗜睡、记忆力下降等神经症状得到明显改善。Schneider 等[2]提出,尽管TBI后会并发垂体功能低下,但激素替代治疗需结合患者的个性化,对神经功能康复的疗效则不确切,需长期随访。
[1]张强,杨明飞.颅脑损伤后垂体功能减退的相关危险因素分析 [J].中华神经外科杂志, 2012,28:403-405.
[2]Schneider H J, Aimaretti G, Kreitschmann-Andermahr I,et al.Hypopituitarism [J].Lancet,2007,369:1461-1 470.
[3]Kokshoom NE,Wassenaar ME,Biermasz NR,et al.Hypopituitarism following traumatic brain injury:prevalence is affected by the yse of different dynamic tests and differentnormal values[J].Eur JEndoerinol,2010,162:11-18.
[4]BondanelliM,Ambrosio MR,ZatelliMC,et al.Hypopituitarism after traumatic brian injury [J].Eur JEndocrinol,2005,152:679-691.
[5]Amar A,Christopher J.Thompson.Anterior pituitary dusfunction follow ing traumatic brain injury(TBI)[J].Clin Endocrinol(oxf),2006,64: 481-488.
[6]Urban RJ,Harris P,Masel B.Anterior hypopituitarism following traumatic brain injury[J]. Brain Inj,2005,19:349-358.
[7]Kelestimur F.Grow th hormone deficiency after traumatic brain injury in adults:when to test and how to treat?[J].Pediatr Endocrinol Rev, 2009,6:534-539.
[8]Aimaretti G, Ghigo E. Traumatic brain in jury and hypopituitarism [J]. Scientific World Journal, 2005, 5: 777-781.
[9]Agha A,Phillips J,Thompson CJ.Hypopituitarism following traumatic brain in jury(TBI)[J]. Br JNeurosurg,2007,21:210-216.
[10]Rothman MS, Arciniegas DB, Filley CM, et al. The neuroendocrine effects of traumatic brain injury[J]. J Neuropsychiatry Clin Neurosci, 2007, 19: 363-372.
[11]Krahulik D, Zapletalova J, Frysak Z, et al. Dyfunction of hypothalamic-hypophysial axis after traumatic brain injury in adults [J]. J Neurosurg, 2010, 11: 581-584.
[12]Sanoussi S, Ali A, Laouali H, et al. Traumatic brain injury and anterior pituitary dysfunction. Regarding 33 cases: Evolution profile over a six-month period[J]. J Neurochirurgie, 2013, 59: 178-182.
[13]Kelly DF, Gonzalo IT, Cohan P, et a1. Hypopituitasm following traumatic brain injury and aneurysmal subaraehnoid hemorrhage: a preliminary report[J]. J Nemrosurg, 2000, 9: 745-752.
[14]Klose M, Juul A, Poulsgaard L, et a1. Prevalence and predictive factors of post-traumatic hypopituitarism[ J]. Clin Endocrinol (oxf), 2007, 67: 193-201.
[15]Krahulik D, Zapletalova J, Frysak Z, et a1. Dysfunction of hypothalamic-hypophysial axis after traumatic brain injury in adult [J]. J Neurosurg, 2010, 113: 581-584.
[16]Pavlovic D,Pekic S,Stojanvic M,et a1. Chronic cognitive sequelae after traumatic brain injury arenot relater to growth hormone deficiency in adults[J].Eur JNeurol,2010,17:696-702.
[17]Wachter D,Gundling K,Oertel MF,et a1. Pituitary insufficiency after traumatic brain injury [J].JClin Neurosei,2009,16:202-208.
[18]Benvenga S,Campenni A,Ryggeri RM,et al.Clinical review 113:hypopituitarism secondary to head trauma[J].J Clin Endocrinol Meta,2000,85:1353-1361.
[19]Kopczak A,Kilimann I,von Rosen F,et al. Screening for hypopituitarism in 509 patients with traumatic brain injury or subarachnoid hemorrhage[J].JNeurotrauma,2014,31:99-107.
[20]Ciancia S.Pituitary insufficiency after traumatic brain injury:consequences?Screening?[J]. Ann Fr Anesth Reanim,2012,31:e117-124.
[21]Kozlowski Moreau,Yollin E,Merlen E,et al.Lasting pituitary hormone deficiency after traumatic brain injury[J].JNeurotrauma,2012, 29:81-89.
[22]Sesm ilo G,Halperin I,Puig-Dom ingo M. Endocrine evaluation of patients after brain injury:what else is needed to define specific clinical recommendations?[J].Hormones(Athens), 2007,6:132-137.
(本文编辑:唐颖馨)
R741;R739.45
A DOI 10.3870/sjsscj.2015.06.032
广东省佛山市顺德区乐从医院神经外科 广东省创伤救治科研中心临床基地 广东佛山528315
2014年佛山市医学类科技攻关项目 (No.2014AB00187 3)
2015-03-19
蔡厚洪 tourer2011@126.com

