MRI与骨扫描诊断前列腺癌骨转移的比较
李倩倩 崔艳芬 储彩婷 王婷婷 李文华
MRI与骨扫描诊断前列腺癌骨转移的比较
李倩倩 崔艳芬 储彩婷 王婷婷 李文华
目的 通过比较MRI与核素骨扫描对前列腺癌骨转移的诊断,以选择最优的无创成像手段来明确前列腺癌的分期。材料与方法 回顾性分析2011年1月—2013年6月经病理证实为前列腺癌的病人252例。年龄57~88岁,平均年龄(73±7.98)岁,分别获取并比较MRI和骨扫描对前列腺癌骨转移诊断的敏感度、特异度、准确度、阳性预测值(PPV)、阴性预测值(NPV)。结果 54例病人诊断为骨转移(成骨性骨转移48例,混合性骨转移6例)。80%(41/54)的前列腺癌骨转移病人的前列腺特异性抗原(PSA)>50 ng/mL,而92%(182/198)的前列腺癌无骨转移病人的PSA<50 ng/mL。MRI诊断前列腺癌骨转移的敏感度、特异度、准确度、PPV、NPV分别为85.1%、100%、96.8%、100%、96.1%;全身骨扫描诊断前列腺癌骨转移的敏感度、特异度、准确度、PPV、NPV分别为92.5%、84.3%、86.1%、61.7%、97.6%。结论 MRI对前列腺癌骨转移的诊断特异度、准确度及PPV较高,骨扫描的敏感度较高。MRI与骨扫描可以实现优势互补,利于前列腺癌的准确临床分期。
前列腺癌;扩散加权成像;磁共振成像;骨扫描;骨转移
前列腺癌是老年男性好发的恶性肿瘤之一,随着我国人口老龄化的加剧,我国前列腺癌的发病率呈明显升高趋势。部分前列腺癌病人以骨痛为首发症状,先发现骨转移病灶,后确诊前列腺来源,国内外文献报道在初次确诊的前列腺癌病人中有45%~ 88.9%的人已发生了骨转移[1-4]。准确的临床分期有利于选择合理有效的治疗方式,提高病人的预后和生存率。目前临床上常用的评价方法有X线、CT、MRI、骨扫描、PET/CT、前列腺特异性抗原(prostate specific antigen,PSA)等,影像评价方法中MRI与骨扫描具有相对较高的分辨力,在临床中应用较多,本研究将重点比较MRI与骨扫描对前列腺癌骨转移的诊断能力,以选取最佳的无创成像方法准确判断前列腺癌的临床分期。
1 材料与方法
1.1 研究对象 回顾性分析上海交通大学医学院附属新华医院2011年1月—2013年6月经病理证实为前列腺癌的252例病人资料,排除合并非前列腺癌的癌症骨转移病人。全部病人均行MRI(常规MRI、DWI、增强MRI)和全身骨扫描检查,MRI与骨扫描间隔不超过2周。病人年龄57~88岁,平均(73± 7.98)岁。主要临床症状为排尿困难、血尿、尿潴留,部分病人首发症状为骨痛。PSA值为1.17~8491ng/mL,平均(367.5±122.1)ng/mL。Gleason评分5~10分,平均7分。
1.2 检查方法 采用GE Signa Twinspeed 1.5 T超导全身MR设备,相控阵体线圈。检查前嘱病人适度充盈膀胱,仰卧位,扫描层面位于耻骨联合上方。扫描序列包括横断面T1WI、脂肪抑制T2WI、非脂肪抑制T2WI、肝脏快速容积采集(LAVA)序列T1WI及DWI。横断面T1WI(TR 400~600 ms,TE 10~14 ms)、脂肪抑制T2WI(TR 4 000~6 000 ms,TE 100~120 ms)和非脂肪抑制T2WI(TR 3 000~6 000 ms,TE 100~ 110 ms)扫描参数:层厚6 mm,层间距1 mm,FOV 32~42 cm,矩阵256×256,NEX 2。LAVA增强扫描T1WI进行横断面、冠状面及矢状面成像,扫描参数为TR 3.9 ms,TE1.8 ms,层厚4 mm,层间距1 mm,FOV 32~42 cm,矩阵256×256,翻转角15°。DWI采用单次激发平面回波成像序列 (single shot echo plannar imaging,EPI),行横断面成像 (TR 8 000~ 10 000 ms,TE 70~100 ms),按各向同性施加扩散敏感梯度场,扩散敏感度b值分别选取0和1 000 s/mm2,层厚6 mm,层间距1 mm,FOV 32~42 cm,矩阵128× 128,NEX 2。对比剂采用钆喷葡胺(Gd-DTPA,北京北陆药业有限公司),剂量0.2 mmol/kg,流率2.5mL/s,高压注射器经肘静脉或手背静脉注射,随后用15 mL等渗生理盐水冲洗。
骨扫描采用 Philips SPECT/CT扫描设备和99Tcm-亚甲基二磷酸盐(99Tcm-MDP,上海原子科兴药业有限公司)检查。全部病人检查前3 h经肘静脉或手背静脉推注99Tcm-MDP 925 MBq,注射30 min后大量饮水(1 000~1 500 mL),检查前排空膀胱。采用低能通用型准直器,扫描速度160 mm/min,矩阵512×1 024,在注入显像剂后2~3 h同时获取不同灰度的前后位与后前位骨扫描图。
1.3 金标准 以骨转移病灶的临床诊断标准为金标准,符合下列任一骨转移病灶的临床诊断标准者,认为发生前列腺癌骨转移[5-6]:①有穿刺或手术病理学证据;②骨扫描可见多发、局灶的异常放射性浓聚灶,除用肿瘤骨转移解释外无其他合理解释;③有2种以上影像诊断认为是骨转移病灶;④有1个以上的可疑病灶在随访中有明显进展;⑤病灶在放化疗后有缩小;⑥若3种以上影像检查(CT、MRI、骨扫描、PET)均为阴性者则认为该处为非骨转移瘤病灶。
1.4 影像分析 2名资深放射科医生及2名核医学科医生在不知临床诊断结果的前提下分别对骨盆(双侧髂骨、髋臼、耻骨、坐骨、L4-5椎体及骶尾骨)的MRI和骨扫描影像进行盲法分析。分别计算MRI和骨扫描对前列腺癌骨转移诊断的敏感度、特异度、准确度、阳性预测值(PPV)、阴性预测值(NPV)。
2 结果
2.1 一般资料 54例病人诊断为临床骨转移,根据全身任一部位的CT扫描资料判定,成骨性骨转移48例,混合性骨转移6例。病人年龄65~88岁,平均年龄(75±6.35)岁。前列腺癌Gleason评分6~10分,平均8分,PSA水平为2.04~8 491 ng/mL。80%(41/54)的前列腺癌骨转移病人的PSA>50 ng/mL,而92%(182/198)的前列腺癌无骨转移病人的PSA< 50 ng/mL(表1)。

表1 前列腺癌病人PSA的分布
2.2 影像表现及骨转移部位分布 54例确诊骨转移的病人中,经MRI确诊的病人46例,8例为假阴性。46例病人骨转移灶T1WI表现为边界清楚低信号,T2WI表现为低信号,增强后呈结节样强化,DWI均表现为不同程度的斑片或结节样高信号,病灶在ADC图上均较正常骨组织信号高;8例假阴性病人中,6例为混合性骨转移,T1WI呈弥漫低信号,T2WI呈高低混杂信号,增强后不均匀强化,DWI和ADC图均表现为高低混杂信号;2例成骨性骨转移病人,T1WI表现为边界清楚低信号,T2WI表现为低信号,增强后可见强化,DWI和ADC图均表现为等低信号。经全身骨扫描诊断的前列腺癌骨转移病人共81例,其中31例为假阳性(图1);4例为假阴性(图2)。经骨扫描诊断假阳性的31例病人中,有23例增强后无强化且DWI表现为低信号,ADC图中病灶信号低于正常骨组织信号而诊断为阴性,与随访结果一致。
盆腔内前列腺癌骨转移好发部位依次为髂骨、骶骨、耻骨、坐骨、股骨、髋臼、腰椎。骨扫描诊断骨盆外骨转移39例,部位为颅骨、肋骨、脊柱、四肢骨,其中6例(6/54)未发生骨盆转移而直接发生骨盆外转移。
2.3 MRI和全身骨扫描对骨转移的诊断情况 以临床诊断标准为金标准,MRI和全身骨扫描诊断前列腺癌骨转移的敏感度、特异度、准确度、PPV、NPV分别为85.1%、100%、96.8%、100%、96.1%和92.5%、84.3%、86.1%、61.7%、97.6%(表2)。
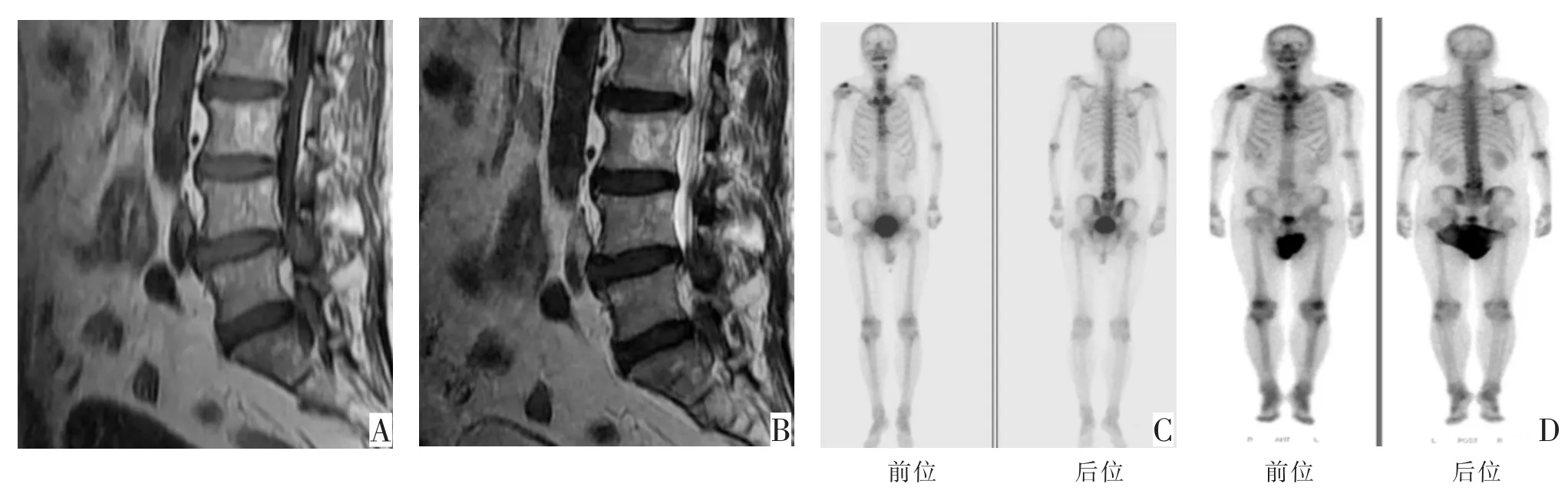
图1 男,72岁,前列腺癌病人(Gleason7),PSA 8.15 ng/mL。A T1WI示L3椎体内类圆形高信号影;B T2WI示L3椎体内类圆形高信号影,MRI考虑椎体血管瘤可能,非骨转移;C骨扫描示右侧肩峰、L3和L4浓聚灶,骨转移可能大;D 6个月后骨扫描随访病灶未发生明显变化。经随访最终临床诊断证实MRI诊断准确,未发生骨转移
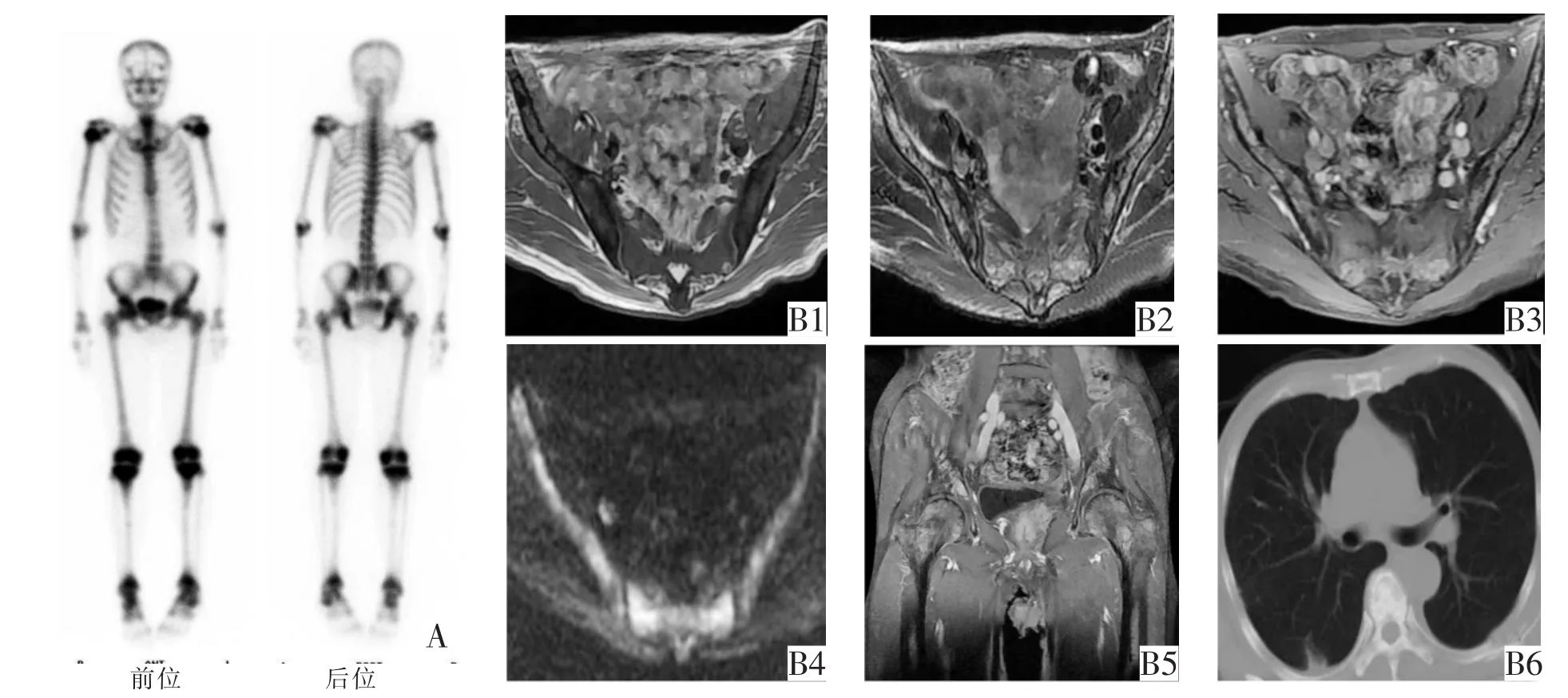
图2 男,66岁,前列腺癌病人(Gleason 9),PSA 822 ng/mL。A骨扫描示全身骨骼呈过度显影,结合病史考虑骨转移,代谢性骨病不除外。B1 T1WI示骨盆各骨弥漫性高低混杂信号;B2 T2WI示弥漫高低混杂信号;B3 T1WI增强示不均匀强化;B4 DWI示弥漫高低混杂信号;B5 MRI考虑骨盆广泛转移;B6胸部CT示广泛的椎体、肋骨高密度及类圆形透亮区,考虑混合型骨转移。最终临床诊断为前列腺癌混合型骨转移
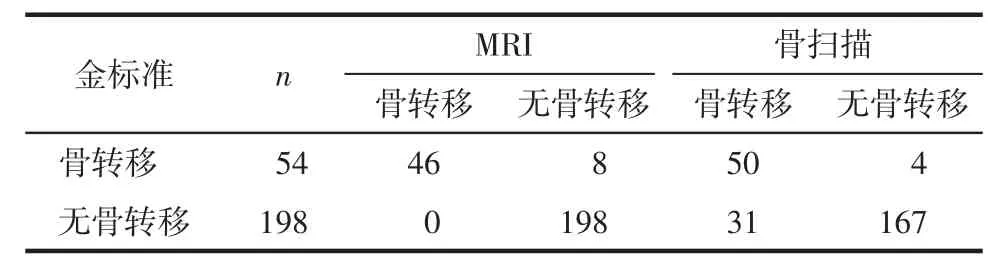
表2 两种检查方法诊断结果与金标准的比较 例
3 讨论
3.1 前列腺癌骨转移机制 前列腺癌容易发生骨转移的确切机制尚不明确,目前认为Paget的“种子和土壤”学说即前列腺癌与骨的相互作用是这一机制的核心。由于前列腺癌细胞与骨的特异性相互作用最终导致影像可见的骨转移,而其他器官的转移则相对较少[8]。前列腺癌骨转移以成骨性转移为主,混合性转移次之,单纯溶骨性转移少见[9],经全身任一部位的CT扫描(大多为胸部)证实本研究中临床诊断前列腺癌骨转移的54例病人中,48例诊断为成骨性骨转移,6例诊断为混合性骨转移。
3.2 PSA与骨转移 PSA是检测前列腺癌的有效指标,在前列腺癌术后随访中具有重要作用[10]。但单独依赖PSA难以对骨转移做出全面判断[11]。本研究发现80%的前列腺癌骨转移病人的PSA>50 ng/mL,而92%的前列腺癌无骨转移病人的PSA<50 ng/mL,且骨扫描诊断骨盆外骨转移的39例病人中未发生骨盆转移而发生骨盆外转移病人6例(6/54),因此对PSA<50 ng/mL的病人可先行盆腔MRI检查,若发现盆腔转移可再行骨扫描检查。
3.3 前列腺癌骨转移部位的分布 本研究发现前列腺癌骨转移盆腔内好发部位为髂骨、骶骨、耻骨、坐骨、股骨、髋臼、腰椎;骨盆外骨转移好发部位为颅骨、肋骨、脊柱、四肢骨。低位腰椎是骨转移的最常见部位,其次是高位椎体,这是由于在前列腺和低位腰椎之间存在一低压、高血流量的静脉丛,即Batson静脉丛。前列腺癌细胞途经此静脉丛可直接进入椎体和肋骨[8]。
3.4 前列腺癌MRI与骨扫描的比较 本研究中MRI诊断为前列腺癌骨转移病人中有8/46例为假阴性,这是由于受到盆腔扫描范围的限制。在诊断前列腺癌骨转移上,MRI的诊断特异度、准确度及PPV较骨扫描高,而骨扫描诊断的敏感度高,但是特异度及PPV不高。骨扫描诊断出现假阳性结果比较多的原因为:许多良性骨病如退行性病变、陈旧性骨折、骨慢性感染等也会出现放射性浓聚灶[12],因此骨扫描应与其他影像检查相结合排除骨良性病变导致浓聚可能。本研究中,骨扫描诊断转移的31例假阳性病人,经MRI诊断后,有23例判定为阴性,与随访结果一致,能有效降低诊断的假阳性率。Cascini等[13]将全身MRI与骨扫描对前列腺癌骨转移的诊断进行比较,认为全身MRI扫描具有优于骨扫描的较高的诊断特异性,而且避免了单纯盆腔MRI敏感性低的缺陷,具有很好的应用前景。
3.5 MRI在前列腺癌骨转移诊断中的价值 本研究中经骨扫描诊断为假阳性的31例病人中,有23例经增强MRI和盆腔DWI鉴别后排除诊断。DWI在前列腺癌骨转移诊断中的价值国内外有很多的研究报道,Lecouvet等[14]对100例可疑前列腺癌骨转移的病人进行研究,分别比较了全身MRI(包括常规MRI、DWI)与骨扫描、CT的诊断效能,得出全身MRI比骨扫描对检测骨转移具有更高的敏感度(分别为98%~100%和86%),特异度相仿(分别为98%~ 100%和98%)。Linton等[15]研究认为全身MRI完全可以取代骨扫描和CT对前列腺癌进行临床分期,但有些病人有MRI检查禁忌,且由于检查费用相对较高,建议用于高度怀疑前列腺癌骨转移的病人。
3.6 小结 综上所述,骨扫描诊断前列腺癌骨转移的敏感性较单纯盆腔MRI高,可以了解全身骨转移的情况,但是特异性不高;而MRI扫描尤其是增强MRI结合DWI对前列腺癌骨转移的诊断特异性及PPV高,但受到扫描范围的限制,因此两者结合可以实现优势互补。对于骨扫描诊断怀疑前列腺癌的病人,可进一步行MRI检查,进而能明确前列腺癌的临床分期。而全身DWI在评估前列腺癌全身骨及软组织转移的情况上有很大的应用前景,有待进一步的研究验证。
[1] 袁超,陶新全,刘恒超,等.前列腺癌骨转移全身骨显像特征[J].中华核医学杂志,2003,23(增刊):33.
[2]Begic A,Kucukalic-Selimovic E,Obralic N,et al.The relationship between the serum prostate specific antigen and whole body scintigraphy in prostate cancer patients after prostatectomy[J].Med Arh, 2006,60:54-55.
[3] 马宏青,葛京平,魏武,等.PSA、ECT骨显像诊断前列腺癌骨转移的临床价值[J].中华男科学,2002,8:289-291.
[4] 陈雅清,屈婉莹,朱明.核素骨显像对诊断前列腺癌骨转移的临床价值[J].中华核医学杂志,1994,14:175.
[5] Nakamoto Y,Cohade C,Tatsumi M,et al.CT appearance of bone metastases detected with FDG PET as part of the same PET/CT examination[J].Radiology,2005,237:627-634.
[6]TairaAV,HerfkensRJ,GambhirSS,etal.Detectionofbonemetastases: assessment of integrated FDG PET/CT imaging[J].Radiology,2007, 243:204-211.
[7] Shah N,Sattar A,Benanti M,et al.Magnetic resonance spectroscopy as an imaging tool for cancer:a review of the literature[J].J Am Osteopath Assoc,2006,106:23-27.
[8] 汤昊.前列腺癌骨转移研究进展[J].中华男科学杂志,2010,16: 364-367.
[9] García JR,Riera E,Valls E,et al.Metabolic and osteogenic pattern of prostate cancer bone metastases[J].Rev Esp Med Nucl Imagen Mol, 2013,32:33-36.
[10]陈昌毅,黄满华,王远梅,等.前列腺癌ADC值与PSA浓度的相关性研究[J].放射学实践,2013,28:71-73.
[11]Griebling TL.Re:significance of docetaxed-based chemotherapy as treatment for metastasis castration-resistant prostate cancer in Japanese men over 75years old[J].J Urol,2013,189:1324.
[12]Hochstenbag MM,Snoep G,Cobben NA,et al.Detection of bone marrow metastases in small cell lung cancer.Comparison of magnetic resonance imaging with standard methods[J].Eur J Cancer,1996,32 A:779-782.
[13]Cascini G,Falcone C,Greco C,et al.Whole-body magnetic resonance imaging for detecting bone metastases:comparison with bone scintigraphy[J].Radiol Med,2008,113:1157-1170.
[14]Lecouvet FE,El Mouedden J,Collette L,et al.Can whole-body magnetic resonance imaging with diffusion-weighted imaging replace Tc99mbone scanning and computed tomography for single-step detection of metastases in patients with high-risk prostate cancer[J]. Eur Urol,2012,62:68-75.
[15]Linton KD,Catto JWF.Whole-body magnetic resonance imaging and prostatecancer metastases:a new gold standard of detection,but does it help us and at what cost[J].Eur Urol,2012,62:76-77.
(收稿2014-04-08)
Comparison between MRI and bone scintigraphy in detecting bone metastasis of prostate cancer
LI Qianqian,CUI Yanfen,CHU Caiting,LI Wenhua.Department of Radiology of Xinhua Hospital Affiliated to Shanghai Jiao Tong University,Shanghai 200092,China
Objective To compare the value between MRI and bone scintigraphy in detecting bone metastasis of prostate cancer,then choose the best noninvasive way to make a accurate staging.Methods and Materials A retrospective study of 252 cases,pathology proved prostate cancer from 2011 January to 2013 June,age range 57-88 years,mean age 73± 7.98 years.The sensitivities,specifilities,accuracies,values of PPV and NPV of MRI and Bone Scintigraphy in detecting bone metastasis of prostate cancer were calculated.Results Fifty-four patients were diagnosed having bone metastasis(48 cases with osteoblastic bone metastasis,six cases with mixed metastasis),and 41 of 54 patients(80%)with bone metastasis of prostate cancer had PSA>50 ng/mL,while 182 of 198 patients(92%)without bone metastasis had PSA<50 ng/mL.The sensitivity, specifility,accuracy,PPV,and NPV of MRI in detecting bone metastasis of prostate cancer was 85.1%,100%,96.8%,100% and 96.1%,respectively;while for bone scintigraphy was 92.5%,84.3%,86.1%,61.7%and 97.6%,respectively.Conclusion MRI has higher specificity,accuracy,and PPV,while bone scintigraphy has higher sensitivity in detecting bone metastasis of prostatecancer.MRIandbonescintigraphycanprovidecomplementaryinformation andmayhelpinstagingprostatecanceraccurately.
Prostate cancer;Diffusion weight imaging;Magnetic resonance imaging;Bone scintigraphy;Bone metastasis
10.3874/j.issn.1674-1897.2015.01.L0102
200092上海,上海交通大学医学院附属新华医院放射科
李文华,E-mail:wenhualimyj@sohu.com

