哈维弧菌和鲍类疱疹病毒刺激对杂色鲍免疫相关因子的影响
赵曼曼 , 姜敬哲 何 健 孙永婵 , 王江勇
(1. 中国水产科学研究院南海水产研究所, 广东省渔业生态环境重点实验室, 农业部南海渔业资源开发利用重点实验室, 广东 广州 510300; 2. 上海海洋大学水产与生命学院, 上海 201306; 3. 广东海洋大学水产学院,广东 湛江 524025)
杂色鲍(Haliotis diversicolor)是我国南方贝类水产养殖中的主要品种之一, 具有很高的营养价值和药用价值。长期以来, 杂色鲍养殖业一直是我国南海区水产养殖的支柱产业。但近年来, 鲍病频发[1-2], 引起了从事贝类病害的专家与学者的广泛关注, 如在1999至2000 年, 福建、广东等地多个养殖场鲍鱼相继暴发病毒性疾病, 造成了重大的经济损失。此外,细菌性疾病也一直是影响鲍养殖业发展的重要因素,如已报道过的危害皱纹盘鲍(Haliotis discus hannai)养殖业的脓疱病[3]和杂色鲍肌肉萎缩症[4]等均为细菌性疾病。国内外的研究主要集中在鲍病的病原分离与鉴定方面, Otsu等[5]利用电镜观察到患病盘鲍神经干附近的细胞质中存在类病毒粒子。Nakatsug等[6]从患病盘鲍初级培养的血细胞中分离到与反转录病毒形状和大小类似的病毒粒子。李霞等[7]在患“裂壳病”的皱纹盘鲍中发现一种球状病毒, 王江勇等[8]报道了杂色鲍中有类似但个体较大的病毒。张晗等[9]研究了血蓝蛋白(Hemocyanin, Hc)在杂色鲍各组织中的分布, 而关于杂色鲍血蓝蛋白基因对病原刺激的响应方面、机体被病原刺激后免疫相关因子的变化以及刺激后的血淋巴抑菌性等方面的研究较少。本文主要研究哈维弧菌(Vibrio harveyi)、鲍类疱疹病毒(Abalone herpesvirus, AbHV)悬液注射杂色鲍后血浆中可溶性总蛋白浓度的变化, 免疫因子超氧化物歧化酶 (Superoxide dismutase, SOD)、酸性磷酸酶(Acid phosphatase, ACP)、碱性磷酸酶(Alkaline phosphatase, AKP)活性的变化, 杂色鲍外套膜、鳃、肝胰腺、腹足中血蓝蛋白基因Hc1、Hc2相对表达量的变化以及注射后对杂色鲍无细胞血浆的抑菌性的影响, 以期为杂色鲍病害的研究提供实验依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
采自深圳市东山某鲍鱼养殖场的健康杂色鲍,壳长4~6 cm, 壳宽为3~4 cm, 体质量为20~24 g。杂色鲍采回后, 置于实验室暂养1周后开始实验。
1.1.2 菌种和病毒
哈维弧菌、创伤弧菌、溶珊瑚弧菌菌种为本实验室保存, 鲍类疱疹病毒提取自实验室–80℃保存的病鲍病料。
1.1.3 试剂
ACP、AKP及SOD测定试剂盒购自南京建成生物工程研究所。
1.2 试验方法
1.2.1 AbHV病毒悬液的制备
AbHV病毒悬液的制备根据张涛等[10]病毒注射液制备的方法进行改进, 常规解剖病鲍, 取内脏软组织部分, 液氮研磨, 反复冻融 3次, 用预冷的 SB缓冲液以1∶10的比例, 制成匀浆液, 依次离心:1 000 r/min, 5 min, 取上清; 3 000 r/min, 5 min, 取上清; 5 000 r/min, 5 min, 取上清; 8 000 r/min, 5 min,取上清; 10 000 r/min, 5 min, 取上清; 12 000 r/min, 5 min,取上清; 12 000 r/min, 10 min, 取上清。以28%蔗糖垫为底, 小心加入上述离心后的上清液, 60 000 r/min,120 min; 离心结束, 用1×PBS溶液溶解沉淀, 然后用0.45 μm滤膜过滤, 滤液为病毒悬液, 取50 μL病毒悬液提取AbHV的DNA, 绝对荧光定量PCR检测AbHV含量为107copies/ng。
1.2.2 哈维弧菌菌悬液的制备
实验室–80℃保存的哈维弧菌菌种(分离自弧菌病的病鲍), 用 LB固体培养基平板(含 2%的 NaCl,下同)活化培养 18 h, 挑取单菌落接到 LB斜面上培养18 h, 用无菌1×PBS清洗, 经比浊法计数, 调整密度至5 ×107CFU/ mL, 此为菌悬液。
1.2.3 人工注射
健康杂色鲍共 120只, 分为 A、B、C三组, 每组40只, A组注射哈维弧菌菌悬液, B组注射AbHV病毒悬液, C组注射1×PBS(对照组), 以微量注射器注射腹足, 注射剂量为100 μL /只。3组鲍分别饲养于具循环过滤水装置的玻璃缸内, 昼夜不间断充气,水温控制在22℃。
1.2.4 无细胞血淋巴的制备与各组织总RNA提取
在注射之前随机选取共5只健康杂色鲍作为0 h空白组, 然后分别在注射后3, 6, 12, 24 , 48, 72 h, 每组取5只鲍, 用腹足创伤法分别收集血淋巴于1.5 mL无菌管中。血淋巴以5 000 r/min、4℃离心10 min, 去沉淀, 上层血清保存于–80℃冰箱中备用。注射后的各个时间点分别取杂色鲍的外套膜、鳃、肝胰脏以及腹足各约50 mg分别置于2 mL无菌Eppondorf管中, 用TRAzol法提取组织RNA, 测定RNA浓度及纯度, –80℃保存。
1.2.5 cDNA制备
以杂色鲍各组织总 RNA为模板, 按照 M-MLV Reverse Transcriptase(Promega)试剂说明书的步骤进行逆转录反应, 合成cDNA, –80℃保存备用。
1.2.6 qPCR引物设计及引物特异性检测
根据课题组克隆的杂色鲍血蓝蛋白 Hc1、Hc2全基因序列(数据未发表), 在 http: //www.ncbi.nlm.nih.gov/tools/primer-blast/ 网站上, 分别在线设计血蓝蛋白基因特异的引物各2对及内参基因核糖体L5蛋白基因引物(L5F366/L5R653: GTCGGGCTGACCA ACTAT/ GAGTCAAAGCCTGGGAAC), 引物由英潍捷基(上海)贸易有限公司合成。以腹足、鳃组织的cDNA为模板, 进行普通 PCR, 检测引物的特异性,琼脂糖凝胶电泳检测后, 选取Hc1F1/Hc1R1(Hc1F/R:ACCTTGGTGCGGACTTGATT/TTCAGGAGTCAAG CTGTCGG)和Hc2F1/Hc2R1(Hc2F/R: ACTGATAGC ACCAACCTTCCG/GCAGTCTCCCTGGTTGTCAG)对各组织cDNA 进行qPCR检测。选用核糖体L5 蛋白基因作为本实验的内参基因。
1.2.7 无细胞血淋巴免疫酶活性的测定
(1) 蛋白浓度的测定
参考 Bradford法, 改进蛋白测定试剂盒的测定方法, 以适用微量血淋巴和多样本的测定。该方法用96微孔板于620 nm 处测定产物的吸光度。
(2) 酶活性的测定
ACP 活性定义为: 100 mL 血清在 37℃条件下与基质作用30 min 产生1 mg 酚为1 个金氏单位;AKP活性定义为: 100 mL 血清在37℃条件下与基质作用15 min 产生1 mg 酚为1 个金氏单位。SOD 活性参照黄嘌呤氧化酶法测定, 定义为: 每毫升反应液中SOD 抑制率达50.0%时所对应的SOD量为1个SOD活力单位(U)。以上酶活力具体测定方法参照相应的试剂盒说明书进行。
1.2.8 抑菌性测定
采用液体培养基微量稀释评估法: 参照 du Toit等[11]方法, 进行稍微改进: 在1.5 mL 无菌Eppondorf管中, 加 650 μL LB液体培养基然后每管再加100 μL稀释好的菌悬液, 加入250 μL无细胞血浆后轻微振荡使之混匀, 空白组为LB液体培养基, 以不加入无细胞血浆为对照组, 在 28℃ 培养 12 h后, 每个样吸取200 μL加入无菌的96孔板中, 用酶标仪检测在600 nm 波长下的OD(Optical density, OD)值, 通过OD值的大小表示抑菌能力的强弱。抑菌率按照以下公式计算: R=[1-(As-A0)/(Az-A0)]×100%, 其中As为实验组OD值, Az为对照组OD值, A0为空白组OD值。
1.2.9 qPCR法检测基因表达差异
qPCR每组实验设置 3个重复。采用相对定量CT法(2–ΔΔCTmethod)分析数据, 本实验采用以注射PBS对照组的杂色鲍的相应各组织及各个时间点的血蓝蛋白基因的表达量作为 ΔCT校正样, 取 5只鲍相同组织2–ΔΔCT平均值作图。
1.3 数据处理
数据处理采用统计软件SPSS 19.0进行, 数据均以平均值±标准偏差表示, 组间差异采用Duncan’s法进行多重比较, 检验处理间的差异显著性(P<0.05),并用Excel 2010作出实验柱形图。
2 结果与分析
2.1 注射哈维弧菌和 AbHV后杂色鲍血淋巴中可溶性总蛋白浓度的变化
注射组及对照组的杂色鲍无细胞血浆的蛋白浓度变化见图1。哈维弧菌注射组在注射3 h与对照组相比稍有下降, 差异不显著(P>0.05), 在注射第6小时和第12小时均上升, 注射6 h时达到最大值17.75 g/L, 与对照组相比差异显著(P<0.05), 在第24小时之后开始下降, 在注射72 h时无细胞血浆蛋白浓度下降到最低值 2.5 g/L, 与对照组相比差异显著(P<0.05);AbHV注射组在注射6 h稍有下降, 与对照组相比差异不显著(P>0.05), 随后开始上升, 第12小时达到最大值14.84 g/L, 在注射第48小时时开始下降, 在第48小时蛋白浓度达到最低值3.07 g/L。对照组在各个时相均无明显变化(P>0.05)。对比哈维弧菌和AbHV注射组发现, 在病原注射的3、6、24 h的3个时间点, 杂色鲍无细胞血浆的蛋白浓度变化差异显著(P<0.05)。

图1 注射哈维弧菌和AbHV后杂色鲍血淋巴中可溶性总蛋白浓度的变化Fig.1 Changes of the total protein concentration in the hemolymph after injection of V. harveyi and abalone herpesvirus
2.2 杂色鲍血淋巴中酶活性的变化
2.2.1 杂色鲍血淋巴中ACP活性的变化
哈维弧菌注射组和AbHV注射组的ACP活性均呈现先升高后下降的趋势(图 2a), 哈维弧菌注射组的ACP活性在48 h达到最大值3.41金氏单位/100mL,在48 h之后开始下降到1.17金氏单位/100mL, 与对照组相比差异显著(P<0.05); AbHV注射组ACP活性在前48 h呈现上升趋势, 在12 h达到最大值4.86金氏单位/100mL, 与对照组差异显著(P<0.05), 48 h之后开始下降。对比哈维弧菌和AbHV注射组发现, 从注射的第 6小时开始, 随后注射的各个时相血淋巴中的ACP活性均差异显著(P<0.05)。
2.2.2 杂色鲍血淋巴中AKP活性的变化
哈维弧菌注射组的AKP活性在注射后第3小时稍有下降(图 2b), 与对照组差异不显著(P>0.05), 在第 6小时至第 48小时呈现上升趋势, 在第 48小时AKP的活性上升到最高值2.73金氏单位/100mL, 与对照组相比差异显著(P<0.05), 随后 AKP的活性开始下降, 在第72小时下降到0.51金氏单位/100mL。AbHV注射组的AKP活性在注射后的第3小时下降, 与对照组相比差异显著(P<0.05), 在第6小时和第12小时AKP活性均升高, 其中在第12小时AKP活性达到最高值 2.91金氏单位/100mL, 与对照组相比差异显著(P<0.05), 在第24小时之后开始下降, 在第72小时下降到0.50金氏单位/100mL。哈维弧菌和AbHV注射组在注射后的第3小时, 第12小时, 第48小时的AKP活性均差异显著(P<0.05)。
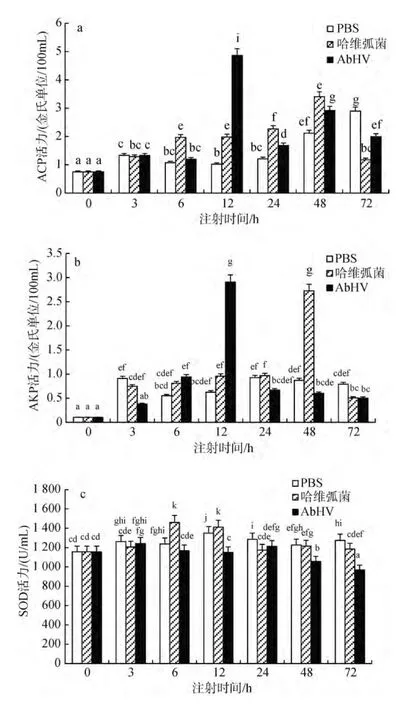
图2 注射哈维弧菌和AbHV后杂色鲍无细胞血淋巴中酶活性的变化Fig.2 Changes of ACP, AKP, and SOD activity in the hemolymph without cells after injection of V. harveyi and abalone herpesvirus
2.2.3 杂色鲍血淋巴中SOD活性的变化
哈维弧菌注射组的 SOD的活性在注射后的第3小时稍有下降(图2c), 与对照组相比差异不显著(P>0.05), 在第 6小时和第 12小时均上升, 其中在第 6小时达到最高值1 459.76 U/mL, 与对照组相比差异显著(P<0.05), 在第24小时之后开始下降。AbHV注射组的SOD活性与对照组相比在注射后的各个时相均呈下降趋势, 其中从注射后第 6小时起的各个时相的 SOD活性与对照组相比均差异显著(P<0.05)。对比哈维弧菌注射组和AbHV注射组的SOD活性变化发现, 在注射后的第6小时, 12小时, 48小时, 72小时均差异显著。
2.3 血蓝蛋白基因相对表达量的变化
2.3.1 注射哈维弧菌后杂色鲍各组织中血蓝蛋白基因相对表达量的变化
注射哈维弧菌后杂色鲍外套膜中血蓝蛋白基因Hc1、Hc2相对表达量变化见图3a, Hc1的相对表达量先升高后降低再升高, 第6小时升高1.43倍, 在9 h开始降低, 到第12小时降低到0.11倍, 在第72小时开始升高; Hc2的相对表达量先降低后升高, 在3 h降低到0.25倍, 随后在第6小时开始升高, 在第12小时升高7.83倍。在鳃中(图3b), Hc1的相对表达量先升高后降低, 在第3小时升高6.68倍, 在第12小时开始下降到0.27倍, 随后均表现出下降趋势; Hc2的表达量在第3小时降低到0.19倍, 第6小时升高4.21倍, 在12 h和72 h均升高, 其他时间点均表现为下降。在肝胰腺中(图3c), Hc1的相对表达量先降低后升高, 在第9小时降低到0.25倍, 随后开始升高, 至第72小时相对表达量升高17.36倍; Hc2的相对表达量在12 h略有下降, 其他时间点均上升, 在第24小时升高60.29倍。在腹足中(图3d), Hc1的相对表达量先上升后下降, 在第6小时升高8.79倍, 在第24小时和48 h开始下降到0.4倍, 在第72小时又升高到注射前水平; Hc2的相对表达量先降低后升高, 在第12小时、24小时和48小时升高, 其中第24小时升高31.89倍, 在第72小时开始降低到0.22倍。
2.3.2 注射AbHV后杂色鲍各组织中血蓝蛋白基因相对表达量的变化
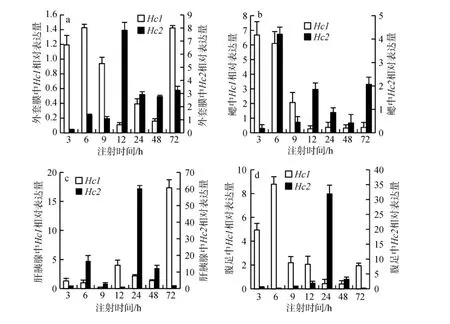
图3 注射哈维弧菌后杂色鲍各组织中血蓝蛋白基因相对表达量的变化Fig.3 The relative expression levels of hemocyanin gene in different tissues of H. diversicolor after injection of V. harveyi

图4 注射AbHV后杂色鲍各组织中血蓝蛋白基因相对表达量的变化Fig.4 The relative expression levels of hemocyanin gene in different tissues of H. diversicolor after injection of abalone herpesvirus
杂色鲍外套膜中血蓝蛋白基因Hc1、Hc2相对表达量变化见图4a, Hc1的相对表达量先降低后升高再降低, 第 24小时升高 2.26倍, 而在其他各时间点Hc1的相对表达量均降低; Hc2的相对表达量先升高后降低再升高, 在6 h升高6.49倍, 随后在第9小时开始降低, 在第48小时后开始升高, 在第72小时表达量与对照组相当。在鳃中(图4b), Hc1在第3小时降低, 在第6小时升高到与对照组表达水平相当, 至第9小时开始降低, 在12 h升高至与对照组表达水平相当, 随后开始降低; Hc2的相对表达量先升高后降低再升高, 在第6小时升高5.08倍, 随后开始降低,到第24小时开始升高。在肝胰腺中(图4c), Hc1的相对表达量先降低后升高, 在第 24小时开始升高, 至第72小时相对表达量升高9.03倍; Hc2的相对表达量先降低后升高再降低最后升高, 在第24小时升高6.4倍。在腹足中(图4d), Hc1的相对表达量先升高后降低, 在第6小时升高20.95倍, 在第48小时开始下降; Hc2的相对表达量先升高后降低, 在第3小时升高10.63倍, 在第72小时开始降低到0.74倍。
2.4 注射哈维弧菌和 AbHV后杂色鲍无细胞血淋巴的抑菌性
2.4.1 对哈维弧菌的抑菌性
注射哈维弧菌后的杂色鲍无细胞血浆的抑菌率与对照组抑菌率相比明显升高(图5a), 从注射后的6 h起, 血淋巴的抑菌率与对照组相比差异显著(P<0.05),并在48 h抑菌率达到了最大值20.20%, 随后抑菌率开始下降, 但仍比对照组的抑菌率高且差异显著(P<0.05)。注射AbHV后血淋巴对哈维弧菌的抑菌率与对照组相比同样升高, 从注射后的 12 h起, 抑菌率与对照组相比差异显著(P<0.05), 并在24 h抑菌率达到了最大值 19.57%, 随后抑菌率开始下降, 但仍比对照组的抑菌率高且差异显著(P<0.05)。
2.4.2 对创伤弧菌的抑菌性
注射哈维弧菌后血浆对创伤弧菌的抑菌率与对照组相比明显升高, 从注射后的第6小时起, 无细胞血淋巴的抑菌率与对照组相比差异显著(P<0.05), 并在48 h抑菌率达到了最大值41.43%, 随后抑菌率开始下降, 但仍高于对照组的抑菌率且差异显著(P<0.05)(图5b)。注射AbHV后血浆对创伤弧菌的抑菌率与对照组相比同样升高, 从注射后的第 3小时起, 抑菌率与对照组相比差异显著(P<0.05), 并在48 h抑菌率达到了最大值 43.84%, 随后开始下降,仍比对照组高但差异不显著(P>0.05)。
2.4.3 对溶珊瑚弧菌的抑菌性
哈维弧菌注射后血浆对溶珊瑚弧菌的抑菌率与对照组相比明显升高, 从注射后的3 h起, 抑菌率与对照组相比差异显著(P<0.05), 并在24 h抑菌率达到了最大值 48.93%, 随后开始下降, 但仍高于对照组的抑菌率且差异显著(P<0.05)(图 5c)。AbHV 注射后血浆对溶珊瑚弧菌的抑菌率明显高于对照组, 注射后的第3小时起, 抑菌率与对照组相比差异显著(P<0.05), 并在48 h抑菌率达到了最大值47.11%, 随后开始下降, 仍比对照组高且差异显著(P<0.05)。
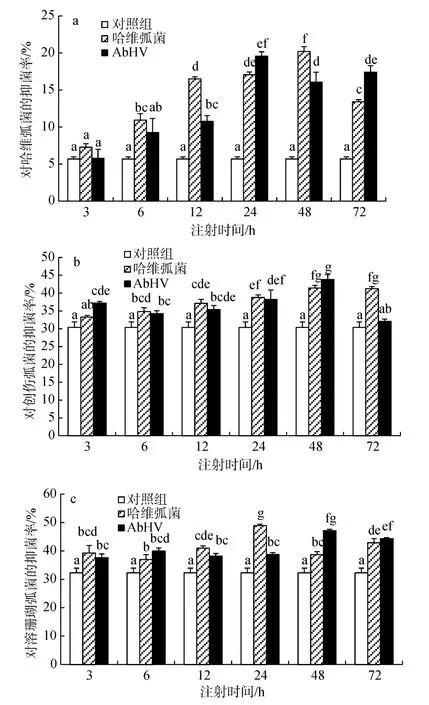
图5 哈维弧菌和AbHV注射后杂色鲍无细胞血淋巴对哈维弧菌、创伤弧菌和溶珊瑚弧菌的抑菌性Fig.5 The anti-bacterial ability of the hemolymph in abalone (H. diversicolor) against V. harveyi, V. vulnificus and V. coralliiluyitcus after injected with V.harveyi and abalone herpesvirus
综上所述, 注射哈维弧菌和 AbHV后杂色鲍免疫相关因子发生明显的变化, 其中血淋巴中可溶性总蛋白浓度升高; ACP和AKP活性均在病原注射后的不同时间点升高, 哈维弧菌注射组的SOD活性升高, 而AbHV注射组的SOD活性下降; 杂色鲍血蓝蛋白基因Hc1、Hc2相对表达量分别在注射后的不同时间点上升。
3 讨论
3.1 注射哈维弧菌和 AbHV后对杂色鲍血淋巴的影响
Yoganandhan等[12]在注射对虾白斑综合征病毒(White spot syndrome virus, WSSV)的印度明对虾(Fenneropenaeus indicus)中检测到血清蛋白浓度高于正常虾。黄旭雄等[13]研究了哈维弧菌急性注射和WSSV急性暴发后中国明对虾 (Fenneropenaeus chinensis)非特异性免疫水平的变化发现, 血清蛋白浓度极显著升高, 这与本实验的研究结果一致。在本实验中, 注射哈维弧菌和 AbHV后的杂色鲍的血淋巴中可溶性总蛋白浓度显著升高。
在缺乏特异性免疫球蛋白的软体动物体内, 吞噬作用成为其免疫防御的一种主要方式, ACP和AKP是吞噬溶酶体的重要组成部分, 在细胞进行吞噬和包囊反应中, 会伴随有ACP的释放[14]。在酸性环境下, ACP能够通过水解作用将表面带有磷酸酯的异物破坏掉, 从而达到预防注射的目的, 并可修饰或改变外来异物的表面分子组成, 从而增强血细胞对异物的识别, 起到调理的作用, 加快吞噬细胞对异物的吞噬和降解速度[15]。AKP存在于软体动物中的肝脏、血细胞和血清中, 同 ACP一样也作为软体动物溶酶体酶的重要组成部分, 在免疫反应中发挥作用[16]。牟海津等[16]用免疫多糖对栉孔扇贝(Chlamys farrei)进行注射后, 血清中的ACP 活性、AKP 活性显著提高, 王淑红[17]和王江勇[18]分别用弧菌和病毒悬液注射杂色鲍后, 其血淋巴的ACP 活性和AKP 活性均在不同的时间点显著升高。在本实验中, 哈维弧菌注射组和 AbHV注射组的杂色鲍血浆中的ACP和AKP活性在不同时间点均表现出升高现象。其中, 哈维弧菌注射组在注射后的第8小时血淋巴中的ACP活性达到最大值, AKP活性在第48小时达到最大值; 在 AbHV注射组中, 血浆中的 ACP和AKP活性均在第12小时达到最大值, 这说明哈维弧菌和AbHV 对ACP和AKP的活性都有一定程度的诱导作用, 激发了鲍的免疫反应。
SOD是广泛存在于生物体中的重要的抗氧化酶。SOD能作为活性氧清除剂参与清除体内自由基O2–和H2O2, 以消除O2–等的中间产物对细胞的毒害,能够增强吞噬细胞的防御能力和机体的免疫功能,在抗辐射损伤、防机体衰老和抗肿瘤等方面具有极为重要的作用[19]。丁秀云等[20]对皱纹盘鲍血淋巴中的SOD 活力进行检测, 发现皱纹盘鲍在注射细菌后,SOD 活力降低, 王淑红等[17]利用弧菌注射杂色鲍也发现SOD 活性显著降低。这与本实验中的AbHV注射组的SOD活性降低的结果一致。牟海津等[16]用免疫多糖对栉孔扇贝进行注射后, 其血清中的SOD 活性显著提高。王江勇等[18]用病毒悬液注射杂色鲍,在第8小时时SOD 活性最高。在本实验中, 哈维弧菌注射组的过氧化物歧化酶SOD的活性在注射后的第3小时稍有下降, 在第6小时和第12小时均上升,其中在第6小时达到最高值1 459.76 U/mL, 在第24小时之后开始下降。在正常情况下, SOD 清除活性氧自由基, 保护机体免受自由基伤害, 当注射细菌后, 在细菌的作用下产生大量的自由基, SOD 酶活性也在自由基的诱导下随之升高, 以清除过量的自由基, 因此在注射后出现了酶活性升高的现象[18]。
3.2 血蓝蛋白基因相对表达量的变化分析
血蓝蛋白是节肢、软体动物中的一种多功能蛋白, 具有氧气运输等多种功能。近年来的研究发现,血蓝蛋白还具有抗病毒和抗菌活性, 如有研究表明,在日本对虾(Penaeus japonicus)注射WSSV后, 血蓝蛋白基因被大量诱导表达, 参与对虾的抗病毒感染过程[21]。有学者应用亲和层析技术在斑节对虾(Penaeus monodon)血淋巴中纯化出两种血蓝蛋白亚基, 进一步的研究发现, 这两种血蓝蛋白的亚基能对多种病毒的复制产生一定的抑制作用[22]。在健康的凡纳滨对虾(Litopenaeus vannamei)和淡水鳌虾(Pacifastacus leniusculus)的血淋巴中, 纯化出不同的血蓝蛋白 C 末端降解出来的抗菌肽段, 这些肽段都对一些细菌产生了良好的抑制作用[23-24], 进一步的研究发现, 此抗菌肽的表达可被葡聚糖或脂多糖诱导[25], 这说明其可被细菌感染诱导表达。庄军等[26]预测了软体动物Haliotis tuberculata血蓝蛋白的抗菌肽。在本实验中, 注射哈维弧菌和AbHV后, 杂色鲍外套膜、鳃、肝胰腺以及腹足中血蓝蛋白两个基因的相对表达量均在注射后的不同时间点出现升高,说明有可能是注射病原诱导了杂色鲍血蓝蛋白的表达, 从而出现血蓝蛋白相对表达量升高的现象。
3.3 血淋巴的抑菌性分析
对一些节肢和软体动物的研究证实自然状态或经细菌注射后其血浆和血淋巴中都存在抑菌活性物质[27-29]。王雷[30], 李春猛[31], 雷质文[32]报道了中国明对虾血淋巴的抗菌能力。Alabi等报道凡纳滨对虾在注射细菌后血淋巴抑菌能力明显增强[33]。此外, 背角无齿蚌(Anodonta woodiana)血淋巴对嗜水气单胞菌(Aeromonas hydrophila)、副溶血性弧菌(Vibrio parahemolyticus)等12种细菌的生长具不同程度的抑制作用[34]。目前在生物体内发现的各种抗菌因子已经达到几百种, 许多研究证实抗菌因子的表达是可以诱导的[35], 本研究表明, 病原注射后的杂色鲍的血淋巴对3种贝类病原均表现出了不同程度的抑菌性(图 5), 且与对照组相比抑菌性明显增强, 推测注射哈维弧菌和 AbHV后诱导了杂色鲍体内储存的抗菌因子的释放或新的抗菌因子合成, 详细机制有待于深入研究。
贝类的体液免疫主要是依靠血清中的一些非特异性的酶或因子来进行的, 在受到外界刺激后, 作为免疫活性因子被释放到血清中, 代表着机体对抗入侵生物的一种体液防御机制。已有的研究表明, 在软体动物受到病原等异物刺激时, 体内与免疫活动相关的酶活性会在短时间内发生显著的变化, 包括溶菌酶(Lysozyme, LZM)、ACP、AKP等溶酶体酶。这些酶活性的升高主要是由于血细胞会在外源刺激下, 迅速合成这些酶类, 并将其释放到血清中, 参与免疫反应[15]。溶酶体酶可以诱导产生, 具有与脊椎动物获得性体液免疫相似的作用[36]。因此, 注射哈维弧菌和 AbHV后, 杂色鲍受到刺激, 血淋巴中的可溶性总蛋白浓度升高, ACP和AKP活性升高, 而哈维弧菌注射组的血淋巴的SOD活性升高, AbHV注射组的SOD活性却降低, 这可能是杂色鲍对细菌和病毒刺激的响应机制不同。具有抗菌和抗病毒活性[21-24]的血蓝蛋白在杂色鲍受到外界刺激时, 其相对表达量提高。血淋巴中免疫相关酶活性的增加使得血淋巴对创伤弧菌、溶珊瑚弧菌等病原菌的抑菌能力增强。
本文针对杂色鲍在细菌和病毒刺激后一些免疫因子的变化进行了初步研究, 为今后进一步研究杂色鲍的非特异性免疫以及在生产实践中应用免疫技术防治病害提供参考。然而, 目前我们对贝类自然防御体系的认识还是非常有限的, 对其抵御细菌和病毒感染的机制还有待进一步探究。
[1] 宋振荣, 纪荣兴, 颜素芬, 等. 引起九孔鲍大量死亡的一种球状病毒[J] . 水产学报, 2000, 24(5): 463-467.
[2] 张朝霞, 王军, 张蕉南, 等. 东山九孔鲍细菌性疾病研究[J]. 台湾海峡, 2001, 20(2): 193 - 201.
[3] 刘金屏, 聂丽苹, 李太武, 等. 皱纹盘鲍(Haliotis discus)脓疱病的研究[J]. 中国水产科学, 1995, 2(2):78-84.
[4] 王江勇, 孙秀秀, 王瑞旋, 等. 杂色鲍肌肉萎缩症病原菌的分离鉴定及系统发育分析[J]. 南方水产科学,2010, 6(5): 21-26.
[5] Otsu R, Sasaki K. Virus-like particles detected from juvenile abalones (Nordotis discus discus) reared with an epizootic fatal wasting disease [J]. J Invertebr Pathol,1997, 70 (2): 167-168.
[6] Nakatsugawa T, Nagai T, Hiya K, et al. A virus isolated from juvenile Japanese black abalone Nordotis discus discus affected with amyotrophia [J]. Dis Aquat Organ,1999, 36(2): 159-161.
[7] 李霞, 王斌, 刘淑范, 等. 皱纹盘鲍“裂壳病”的病原及组织病理的研究[J]. 水产学报, 1998, 22(1): 61 -66.
[8] 王江勇, 陈毕生, 冯娟, 等. 杂色鲍裂壳病球状病毒的初步观察[J]. 热带海洋, 2000, 19(4): 63-67.
[9] 张晗, 姜敬哲, 何健, 等. 血蓝蛋白在杂色鲍各组织中的分布研究[J]. 南方水产科学, 2014, 10(4): 34-38.
[10] 张涛, 黄建华, 温为庚, 等. WSSV+斑节对虾的血清免疫相关酶对人工感染 WSSV粗提液的反应[J]. 南方水产科学, 2013, 9(1): 35-42.
[11] Du Toit E A, Rautenbach M. Sensitive standardized micro-gel well diffusion assay for the determination of antimicrobial activity [J]. J Microbiol Methods, 2000,42(2): 159-165.
[12] Yoganandhan K, Thirupathi S, Hameed A S S.Biochemical, physiological and hematological changes in white spot syndrome virus infected shrimp, Penaeus indicus [J]. Aquaculture, 2003, 221(2): 1-11.
[13] 黄旭雄, 周洪琪, 宋理平. 急性感染对中国明对虾非特异免疫水平的影响[J]. 水生生物学报, 2007, 31(3):325-331.
[14] 翟玉梅, 丁秀云, 李光友.软体动物血细胞即体液免疫研究进展[J].海洋与湖沼, 1998, 29(5): 558-561.
[15] Cheng T C. The role of lysosmal hydrolases in molluscan cellar response to immunologic challenge[J].Comp Pathbiol, 1978, 4: 59-71.
[16] 牟海津, 江晓路, 刘树青, 等. 免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J]. 青岛海洋大学学报, 1999, 29(3): 463-468.
[17] 王淑红, 王艺磊, 张朝霞, 等. 弧菌和大肠杆菌注射对杂色鲍无细胞血淋巴中几种酶活力的影响[J]. 中国水产科学, 2004 , 11(1): 37-40 .
[18] 王江勇, 郭志勋, 冯娟, 等. 病毒感染后杂色鲍部分血清免疫因子的变化[J]. 中国水产科学, 2005, 12(3):344-347.
[19] 刘志鸿, 牟海津, 王清印. 软体动物免疫相关酶研究进展[J]. 海洋水产研究, 2003, 3(24): 86-90.
[20] 丁秀云, 李光友, 翟玉梅. 皱纹盘鲍经诱导后血淋巴中一些因子变化的研究[J]. 海洋与湖沼, 1996, 27(4):362-367.
[21] Lei K Y, Lia F, Zhang M C, et al. Difference between hemocyanin subunits from shrimp Penaeus japonicus in anti-WSSV defense [J]. Dev Comp Immunol, 2008,32(7): 808-813.
[22] Zhang X B, Huang C H, Qin Q W. Antiviral properties of hemocyanin isolated from shrimp Penaeus monodon[J]. Antiviral Res, 2004, 61(2): 93-99.
[23] Destoumieux-Garzon D, Saulnier D, Garnier J, et al.Crustacean immunity : Antifungal peptides are generated from the C terminus of shrimp hemocyanin in response to microbial challenge [J]. J Biol Chem,2001, 276(50): 47070-47077.
[24] Lee S Y, Lee B L, Soderhall K. Processing of an antibacterial peptide from hemocyanin of the freshwater crayfish Pacifastacus leniusculus [J]. J Biol Chem, 2003, 278(10): 7927-7933.
[25] 李义, 吴婷婷, 李红霞. 甲壳动物抗微生物肽研究进展[J]. 水生生物学报, 2006, 30(4) : 21-24.
[26] Zhuang Jun, Christopher J C, Zhu Hongtao, et al.Identification of candidate antimicrobial peptides derived from abalone hemocyanin [J]. Dev Comp Immunol, 2015, 49(1): 96-102.
[27] Haug T, Kjuul A K, Stensva K, et al. Antibacterial activity in four marine crustacean decapods [J]. Fish Shellfish Immunol, 2002, 12(5): 371-385.
[28] Schnapp D, Kemp G D, Smith V J. Purification and characterization of a proline-rich anti-bacterial peptide,with sequence similarity to bactenecin from the haemocytes of the shore crab, Carcinus maenas [J]. Eur J Biochem, 1996, 240(3): 532-539.
[29] Relf J M, Chisholm J R S, Kemp G D, et al.Purification and characterization of a cysteine-rich 11.5-kDa antibacterial protein from the granular haemocytes of the shore crab, Carcinus aenas [J]. Eur J Biochem, 1999, 264(2): 350-357.
[30] 王雷, 李光友, 毛远兴. 中国对虾血淋巴中的抗菌溶菌活力与酚氧化酶活力的测定及其特性研究[J]. 海洋与湖沼, 1995, 26(2): 179-185.
[31] 李春猛, 战文斌, 马甡, 等. 中国对虾血淋巴抗菌活力的测定[J]. 青岛海洋大学学报, 1999, 29(4): 599-603.
[32] 雷质文, 黄捷, 杨冰, 等. 96孔酶标板法测定中国对虾血淋巴上清液抗菌活力和酚氧化酶活性的初步研究[J]. 海洋湖沼通报, 2001, 4: 33-37.
[33] Alabi A O, Latchford J W, Jones D A. Demonstration of residual antibacterial activity in plasma of vaccinated Penaeus vannamei [J]. Aquaculture, 187(1-2): 15-34.
[34] 朱越雄, 宋慧春. 背角无齿蚌血清的抑菌活性[J]. 水利渔业, 2000, 20(6): 43-45.
[35] Hultmark D, Steiner H, Rasmuson T, et al. Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of Hyalophora cecropia [J]. Eur J Biochem, 1980, 106(1): 7-16.
[36] Cheng T C. Lysosomal and other enzymes in the hemolymph of Crassostrea virginica and Mercenaria mercenaria [J]. Comp Biochem Physiol B, 1975, 52(3):443-447.

