自体DC-CIK维持治疗对晚期非小细胞肺癌患者生活质量的影响*
邵 青,石 磊,黄丽斌,邢时云,徐继平,周 蕾,杨卫兵
(遵义医学院附属肿瘤医院,贵州遵义563003)
肺癌的发病率和死亡率居全球恶性肿瘤首位,其中80%~90%[1]为非小细胞肺癌(non-small-cell lung cancer,NSCLC),超过三分之二的患者确诊时已为晚期[2],五年生存率仅有 8%~16%[1],且生活质量(quality of life,QOL)极差。改善QOL逐渐成为晚期患者治疗的主要目的和观察终点[3-4]。近年来,对经过规范放化疗获益的患者提出了维持治疗(maintenance therapy)策略,以期延缓疾病进展及症状恶化,从而延长总生存期(overall survival,OS)[2]。DC-CIK作为一种肿瘤过继免疫治疗方式[5],已有许多基础及临床研究证实其对NSCLC治疗的有效性[6]。本研究设计在肿瘤处于低负荷状态下,应用自体DC-CIK治疗作为晚期NSCLC的维持治疗手段,通过对生活质量的影响研究,为自体DC-CIK疗效的评估提供参考依据。
1 资料与方法
1.1 临床资料
1.1.1 入组标准 选择经病理或细胞学证实、一线规范治疗(含铂类两药联合化疗4~6周期和/或联合肺部及纵膈三维适形放疗)结束后一个月以上,病情达到完全缓解(complete response,CR)、部分缓解(partial response,PR)或稳定(stable disease,SD)的Ⅲb/Ⅳ期NSCLC患者、卡氏行为状态评分(Karnofsky Performance Status,KPS)≥60分、预计生存期在3个月以上、无重要脏器功能不全及出血性疾病史,并经患者知情同意。
1.1.2 排除标准 排除预期在治疗期间将有生命危险,心脏、肝脏、肾脏功能不全,有出血性疾病或其它获得性、先天性免疫缺陷疾病,以及无法签署知情同意书,不能配合治疗及生活质量评估者。
1.1.3 病例资料分组 收集遵义医学院附院肿瘤医院胸部肿瘤科2010年9月至2013年2月符合上述标准的病例,共50例。按患者意愿分别进入DCCIK维持治疗组(A组)和对照组(B组),每组25例。见表1。
1.2 主要仪器和试剂
COM.TEC血细胞分离机购自德国费森尤斯(Fresenius)公司,注射用重组人粒细胞巨噬细胞刺激因子(GM-CSF)购自厦门特宝生物工程股份有限公司,重组人白细胞介素-4(rhIL-4)购自上海创未生物技术有限公司,注射用重组人干扰素-γ(IFN-γ)购自上海克隆生物高科技术有限公司,CD3单克隆抗体购自美国ebioscience公司,重组人白介素-2注射液(rhIL-2)购自北京四环生物制药有限公司,肿瘤坏死因子-α(TNF-α)购自上海唯科生物制药有限公司,Tanswell培养小室购自美国Invitrogen公司,AnnexinV-PI双染试剂盒购自北京碧云天生物技术研究所,CCK-8试剂盒购自日本DojinDo化学研究所,康艾注射液购自吉林长白山制药股份有限公司。

表1 两组患者主要临床特征
1.3 DC-CIK的采集与制备
DC-CIK的采集与制备由遵义医学院附属医院干细胞与再生医学中心与上海柯莱逊生物技术有限公司合作完成。
1.3.1 DC-CIK采集前准备 完善相关输血前检查,签署外周血单个核细胞采集知情同意书。
1.3.2 DC-CIK的采集、制备和质量控制 患者取仰卧位,无菌操作下使用COM.TEC血细胞分离机按单个核细胞(peripheral blood mononuclear cell,PBMC)采集程序采集PBMCs100ml,采集中密切观察患者生命体征变化,用淋巴细胞分离液梯度离心法进一步纯化PBMC,无血清培养液洗涤2次,获得纯度在90%以上的PBMC,采集PBMCs总数大于(1~2)×109个。DC、CIK 的分离、培养参照文献[7]进行。获得的PBMC用于制备CIK细胞,用无血清培养液调整细胞浓度至2×106/ml,置于细胞孵箱中孵育2小时,以使单核细胞贴壁;收集悬浮细胞,用无血清培养液调整细胞浓度至(1~2)×106/ml;首先在培养体系中加入rhIFN-γ,24小时后加入CD3单克隆抗体和rhIL-2、rhIL-1α以刺激CIK细胞的生长和增殖,每3d换液并补加rhIL-2,在培养的第7天即可收获CIK细胞。剩余的贴壁细胞,加入含rh-GM-CSF和rhIL-4的无血清培养液,细胞孵箱中培养,诱导单核细胞向DC细胞分化;每3d换液并补足细胞因子;在培养的第6d,加入rhTNF-α,诱导DC细胞成熟;在培养的第7d,收获DC细胞。收集以上所获得的DC细胞和CIK细胞,按1:10比例共培养,无血清培养液中添加rhIL-2;每3d换液并补加rhIL-2;在第7d收集细胞,细胞数量应达到1×1010个以上。细胞培养过程中通过倒置显微镜观察并计数DC及CIK增殖情况,有无污染,细胞收集前行细菌、真菌培养及内毒素检测。确保细胞制品的外源性因子,包括细菌、真菌、内毒素等皆为阴性,细胞存活率大于95%。
1.4 治疗方法
A组患者待细胞制备合格后开始行DC-CIK混合细胞回输,连续5天,每天1次。每次回输的DC大于1.7×107个,CIK大于1×109个。输注过程中注意观察患者有无发热、寒颤、过敏等不良反应发生。B组患者予康艾注射液 60ml溶于0.9%生理盐水250ml中,每天1次,共输注10天。
1.5 生活质量的评价方法
采用肺癌患者生命质量测定量表QLICP-LU(1.0),由研究者对50例患者进行面对面问卷调查。现场请患者自行回答问卷,视力不佳或对部分问题不能理解者由研究者提问或做适当解释,然后仍由患者自行回答,回答完毕后当场检查资料的完整性和真实性。
生活质量内容分为共性模块和特异模块两部分。其中共性模块又分为躯体功能、心理功能、社会功能、共性症状和副作用等4个领域。量表中每个条目有5个回答选项,计算总量表及各领域评分,分数越高说明生活质量越好。
1.6 观察指标
1.6.1 生活质量评价 两组患者入组时的KPS评分及生活质量量表评分,以入组后2月为观察终点,即记录患者治疗后到6周的KPS评分及生活质量量表评分。
1.6.2 安全性评价 A组患者在采血、细胞回输过程中及回输结束后的不良反应;两组患者在入组后1月复查血常规、肝肾功能、电解质、心电图等。
科技要发展,必须要加快科技成果的转化和产业化。旧金山湾区正是全球科技创新成果产业化的领导者。湾区南部的硅谷,从上世纪60年代开始的半导体技术、80年代的个人电脑、90年代的互联网到现在最炙手可热的人工智能,充当了引领革命性技术与新兴产业交替发展的领头羊。事实上硅谷最大的优势在于理解每一项技术对社会可能产生的颠覆性影响,通过孵化科技成果,将新技术、新发明产业化,实现其商业价值。产业化所带来的经济利润和社会效益又会反过来促使企业更加注重创新创造,硅谷也因此被誉为全球“创新工厂”。
1.7 统计学方法
采用SPSS17.0统计软件进行统计分析。生活质量比较采用两独立样本t检验。数据以均数(标准差(±s)表示,取 P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前生活质量比较
两组患者的生活质量总分及各领域评分等组间分布均衡,差异均无统计学意义(P>0.05),具有可比性。见表2。
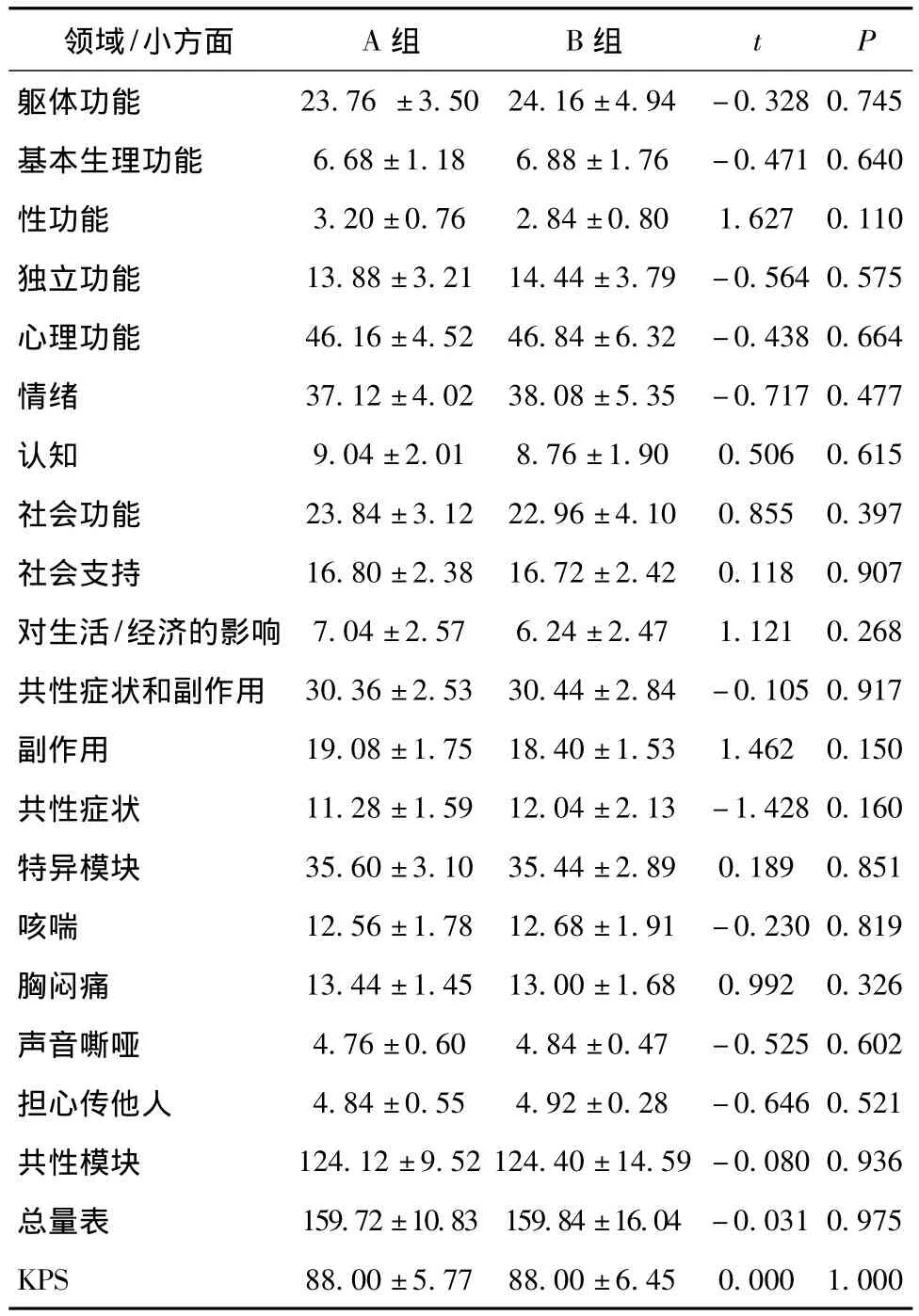
表2 两组患者生活质量评分平均值比较
2.2 A组治疗前后QOL的差异
A组患者治疗前、治疗后6周的QOL总分存在明显差异(P<0.05),主要表现为治疗后患者在躯体功能(基本生理功能、独立功能)、共性症状和副作用(共性症状)、咳喘以及KPS评分等领域的评分高于治疗前。见表3。
2.3 A组与B组治疗后QOL的差异
两组患者治疗后6周的QOL总分有明显差异(P<0.05),且A组高于B组。领域分析显示,差异主要表现为躯体功能(基本生理功能、独立功能)、共性症状及副作用(共性症状、副作用)、特异模块(咳喘、胸闷痛)、共性模块以及KPS评分等领域(P<0.05)。见表4。
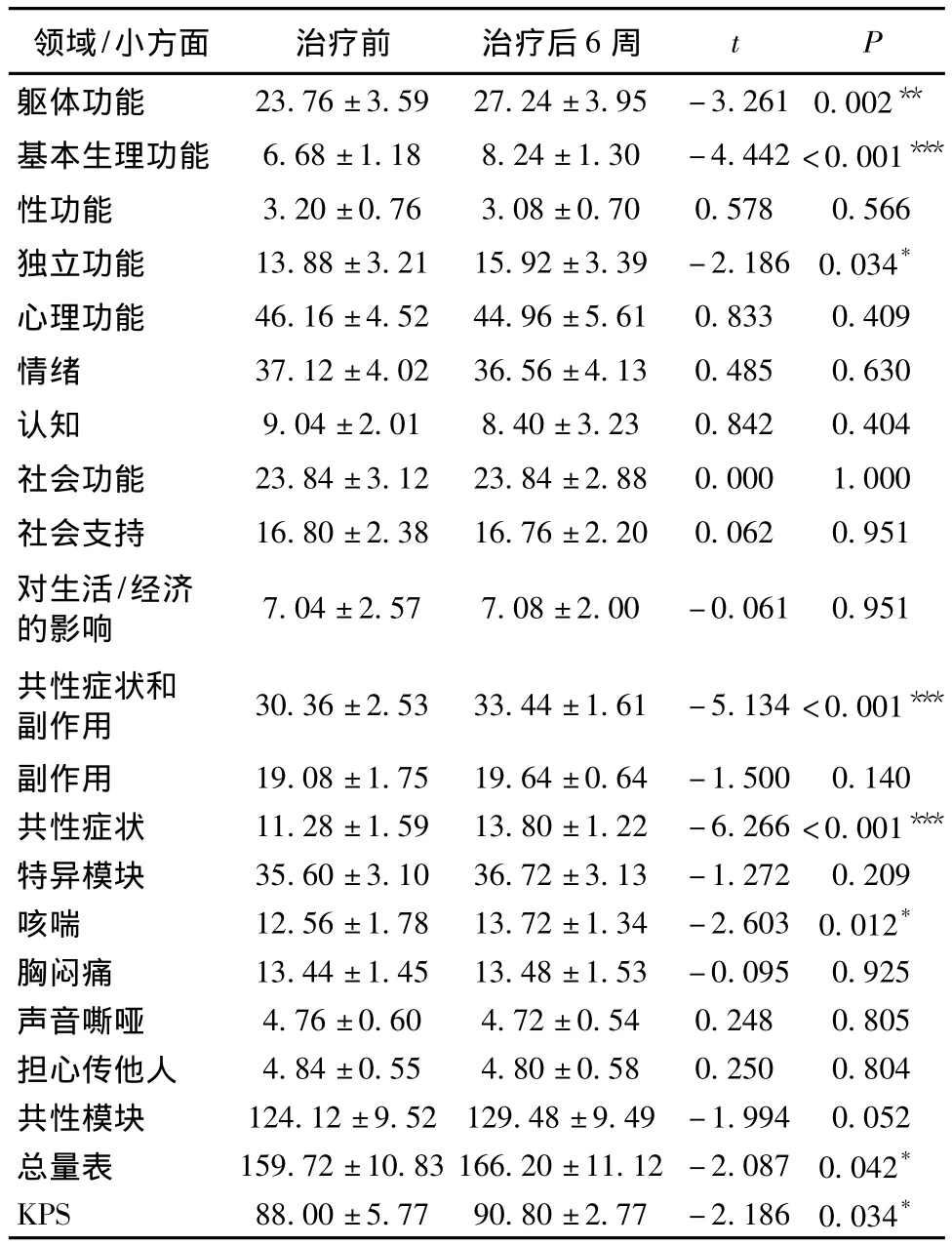
表3 A组治疗前、治疗后6周生活质量各领域及其小方面平均得分比较
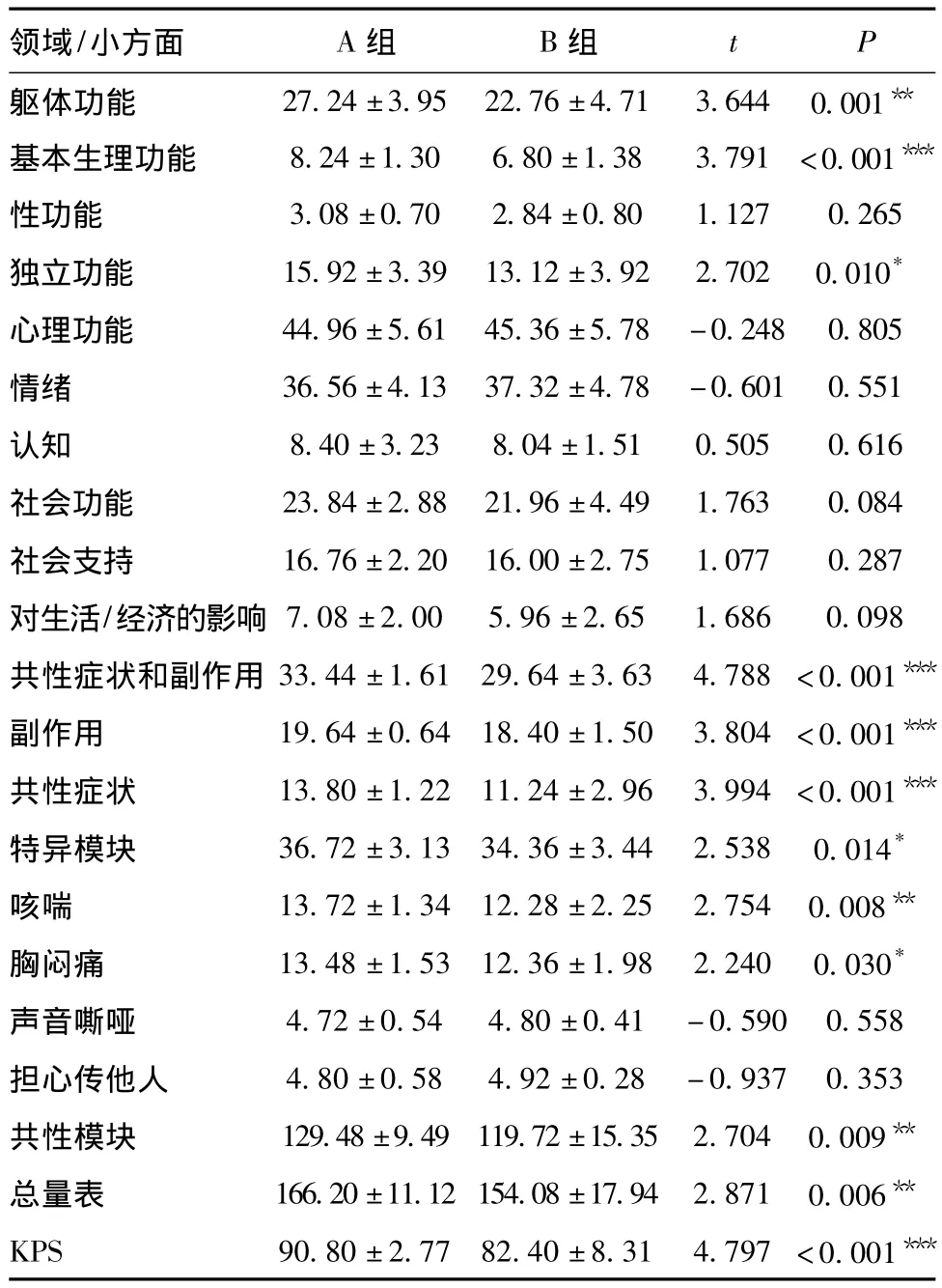
表4 两组患者治疗后6周生活质量评分比较
2.4 A组与B组治疗后QOL差异的亚组分析
2.4.1 年龄 A、B两组中年龄>60岁的患者,治疗后6周的QOL总分有明显差异(P<0.05)。领域分析显示,躯体功能(基本生理功能、独立功能)、共性症状和副作用(共性症状、副作用)、特异模块(咳喘)、共性模块以及KPS评分等领域评分差异存在统计学意义(P<0.05),A组患者评分高于B组。而两组中年龄≤60岁的患者治疗后6周的QOL总分无显著性差异(P>0.05),但副作用以及KPS评分出现了显著变化(P<0.05),表现为A组患者评分高于B组。见图1。
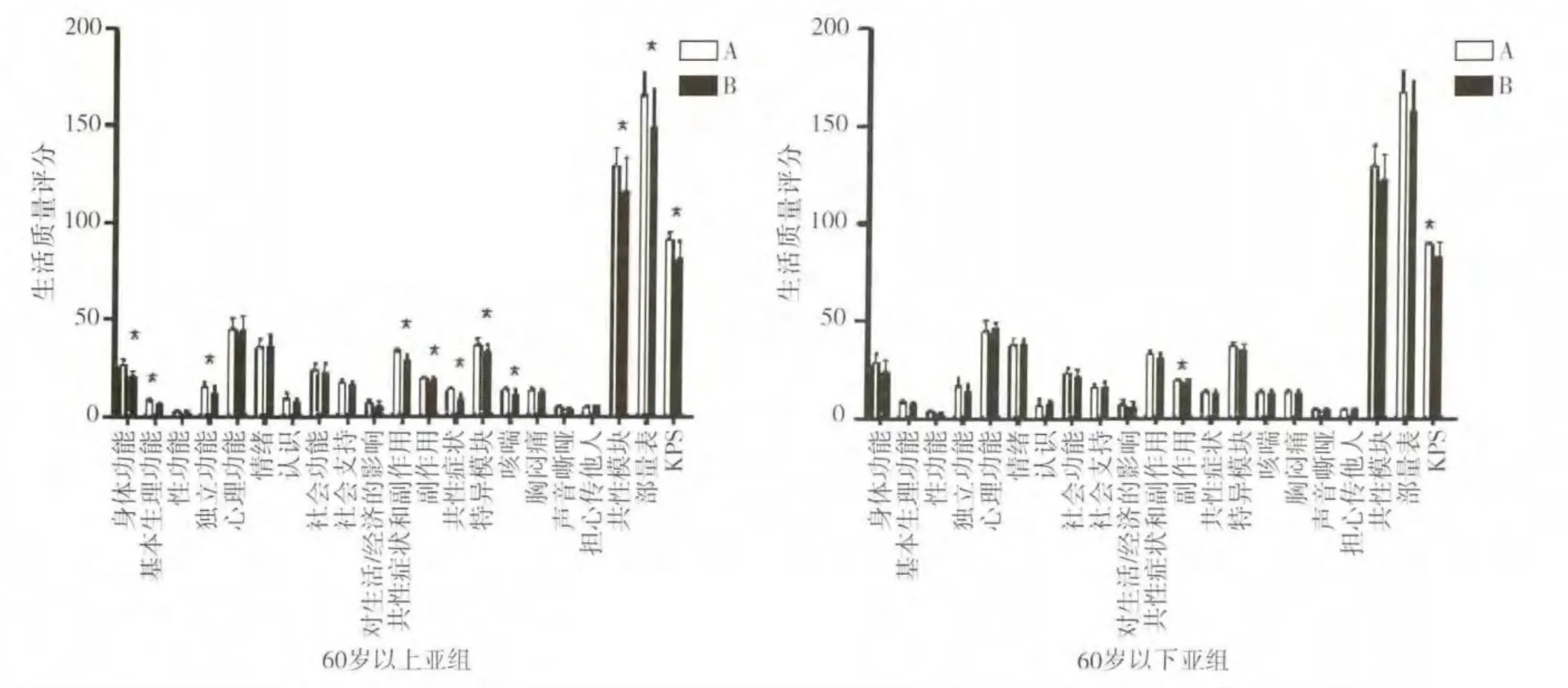
图1 年龄亚组在治疗后6周时的生活质量评分比较(*代表P<0.05)
2.4.2 性别 A、B两组中男性患者,治疗后6周的QOL总分有明显的差异(P<0.05)。领域分析显示,躯体功能(基本生理功能、独立功能)、共性症状和副作用(共性症状、副作用)、共性模块以及KPS评分等领域存在显著性不同(P<0.05),A组患者评分高于B组。而两组中的女性患者在治疗后6周QOL总分无显著性差异(P>0.05)。领域分析显示,疾病对生活/经济的影响、共性症状及副作用、特异模块(咳喘、胸闷痛)、KPS评分等领域存在明显不同(P<0.05),A组患者评分高于B组。见图2。

图2 性别亚组在治疗后6周时的生活质量评分比较(* 代表P<0.05)
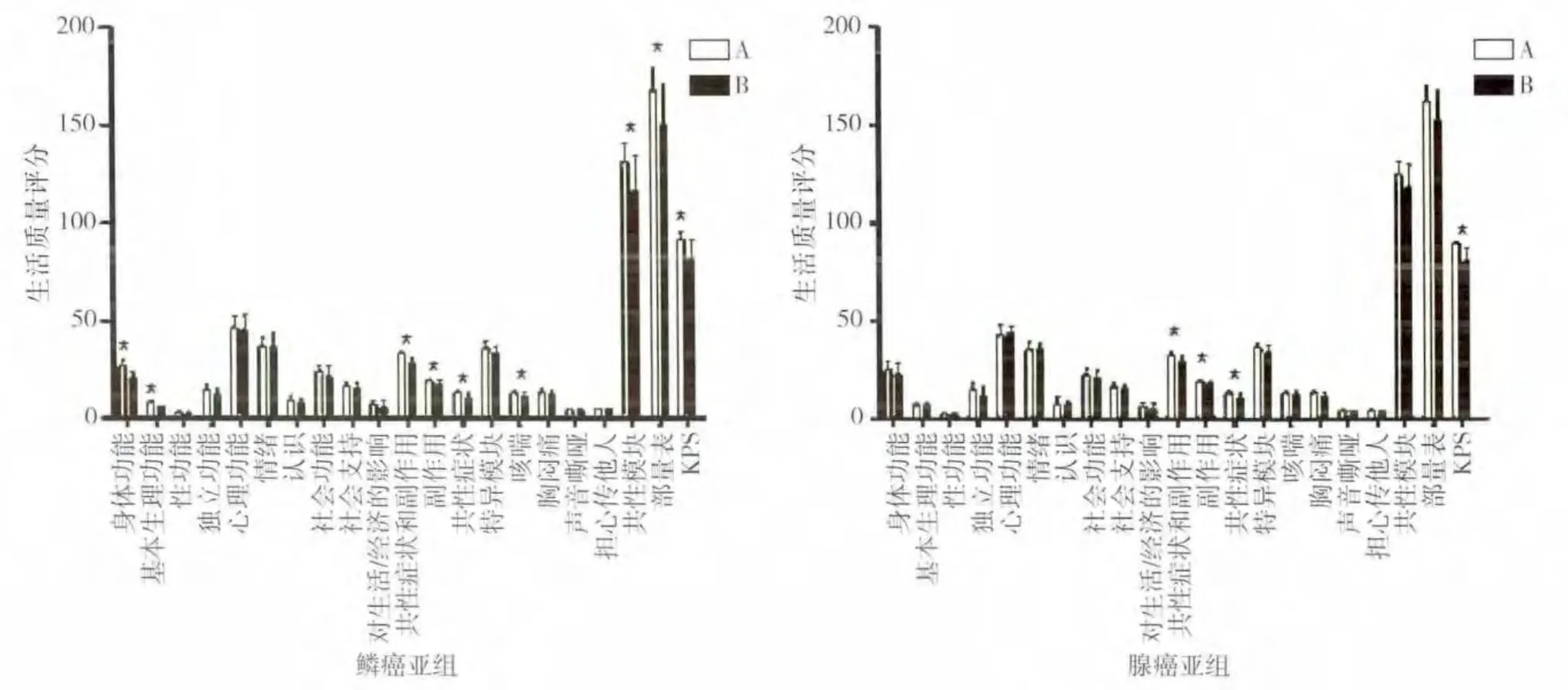
图3 病理类型亚组在治疗后6周时的生活质量评分比较(* 代表P<0.05)
2.4.4 临床分期 A、B两组中IV期的患者,治疗后6周的QOL总分有显著性差异(P<0.05)。领域分析显示,躯体功能(基本生理功能、独立功能)、社会功能(对生活/经济的影响)、共性症状和副作用(共性症状、副作用)、特异模块(咳喘、胸闷痛)、共性模块以及KPS评分等领域存在明显的不同(P<0.05),A组患者评分高于B组。而两组中Ⅲb期的患者治疗后6周的QOL总分无明显的差异(P>0.05),领域分析显示基本生理功能和性功能方面存在显著不同(P<0.05),A组患者评分高于B组。见图4。
图4 临床分期亚组在治疗后6周时的生活质量评分比较(* 代表P<0.05)
2.5 A组患者治疗期间毒副反应
A组患者在采血、DC-CIK回输时及回输后均未出现严重的不良反应,在细胞回输过程中有1例患者出现低热,最高体温37.9℃,嘱患者多饮水后体温逐渐恢复正常;治疗前后患者的血象、肝肾功能及心电图无明显变化。总不良反应发生率为4%,对症治疗后或休息后缓解,无严重的骨髓抑制、肝肾毒性及消化道反应。
3 讨论
非小细胞肺癌以高发病率、高死亡率、低生存期[8]为特点,对患者的躯体、心理和社会功能均造成严重打击[9]。病痛的折磨、放化疗引起的毒副作用以及由于治疗带来的经济压力、角色功能削弱、对死亡的恐惧感等问题使患者QOL下降,到终末期时甚至感到生不如死。维持治疗实质是一种维持疗效、改善生活质量、延长总生存期的巩固治疗手段[2]。目前主要采取的化疗或分子靶向治疗等方式由于严重的毒副反应及受益人群谱窄等原因,在临床上的应用受到一定限制。自体CIK治疗是肿瘤过继免疫治疗的全新策略,具有增殖速度快、杀瘤活性高、杀瘤谱广、安全性高及对多重耐药肿瘤敏感等特性[10],与同源DC在体外共培养时扩增能力及杀伤活性明显提高[11]。多项基础及临床研究证明[12],DC-CIK能特异性地识别肿瘤细胞而不伤害正常细胞,加上其有别于化疗的0级杀伤方式,对于手术、放化疗后肿瘤负荷较小的病人,在清除微小残留病灶、预防肿瘤复发转移、提高治愈率方面发挥着重要作用。所以,本研究采用自体DC-CIK作为晚期NSCLC的维持治疗方案。
生活质量综合评价患者生活中躯体功能的、心理的、社会的、经济的、情绪的以及疾病本身及其治疗引起的症状和体征等多方面因素[13],是一种主观感受,其变化不仅受患者健康状况的影响,而且受到社会生活环境和医疗保健措施的影响[14]。现有研究证实,生活质量作为肺癌的独立预后因素及终末评价指标,具有良好的可靠性、客观性、有效性和可行性[15]。目前,国外较为权威的肺癌患者生活质量测定量表有欧洲的肺癌生命质量量表(quality of life questionnaire-lung,QLQ-L)和美国的肺癌治疗功能评价表(functional assessment of cancer therapy-lung,FACT-L),由于民族性、文化背景、价值观念的差异,国外量表汉化形成的中文版并不完全适用于我国患者[16]。肺癌患者生命质量测定量表(quality of life Instruments for cancer patients-lung,QLICP-LU)是由我国学者万崇华等自主研发的,其语言通俗易懂,适合中国人的文化背景和习惯,有较好的可操作性,特别是添加了医疗保障情况等符合我国国情的测定项目,有很好的信度、效度和反应度[17]。
本研究通过对DC-CIK维持治疗组患者的生活质量进行治疗前后的对比发现,治疗后患者在食欲、睡眠、独立生活能力等方面有所好转,疼痛、疲乏、体重减轻、咳喘等症状较前改善。同时将DC-CIK维持治疗组患者治疗后的生活质量与对照组进行比较,体现出明显的优越性,主要表现在治疗后基本生理功能、独立生活能力的好转和癌症共性症状及副反应的发生率减低,总体生活质量得到改善。由此可以看出,自体DC-CIK维持治疗能提高规范放化疗后获益的晚期非小细胞肺癌患者的生活质量[6,10]。
我们进一步将两组患者分别按性别、年龄、临床分期、病理类型等最有可能影响生活质量的相关因素分组,进行亚组分析。结果表明,年龄大于60岁的IV期肺鳞癌男性患者,生活质量改善更为明显,且主要表现为躯体功能、癌症共性症状及副作用、肺癌特异性症状以及KPS评分等领域的恢复。其原因可能涉及以下几个方面。首先CIK通过直接的细胞毒活性能诱导肿瘤细胞的凋亡和坏死,对体内的耐药细胞、肿瘤干细胞及抗放射细胞均有杀伤作用;第二,DC通过释放抗血管生成物质和前血管生成因子,阻止肿瘤血管形成,能够加速肿瘤细胞的凋亡;第三,DC-CIK能够启动机体的细胞免疫和体液免疫并分泌各种细胞免疫因子,从而提高机体免疫功能;第四,DC-CIK所分泌的多种细胞因子,如IL-2和IFN等,有一定的催眠、镇痛作用,也有利于患者的生活质量改善[17]。第五,由于DC-CIK有靶向肿瘤细胞而不伤害正常细胞的特性,对骨髓造血、肝肾功能以及胃肠道粘膜无明显伤害,故不会造成生活质量的下降。此外,生活质量是评价治疗对患者不同生活方面正负影响的一个综合概念,其各个领域间是相互关联、影响的。当DC-CIK在体内发挥一定抑瘤作用,引起肿瘤体积回缩或肿瘤所分泌的相关细胞因子减少时,患者的疼痛、咳喘、胸闷痛等癌症共性症状和肺癌特异性症状可能有所好转,进而引起精神、食欲、睡眠的恢复,疲乏缓解,体重增加,随着身体状况的逐渐改善,独立生活能力也能缓慢得到提升。但是年龄大于60岁的IV期肺鳞癌患者获益更大的原因,目前尚不清楚,也许这可能是由于老年、IV期患者免疫功能相对更差,所以输入DC-CIK后免疫功能提高的程度更大,而腺癌本身生物学行为比鳞癌更为恶劣,更容易发生转移,也许是治疗效果不如鳞癌明显的原因之一。
在DC-CIK治疗的安全性方面,在细胞回输过程中1例患者出现一过性的低热,为目前细胞免疫治疗最为常见的不良反应,可能是回输的细胞悬液中含有诱导DC-CIK生成时加入的IL-2和IFN-γ等细胞因子引起。
综上所述,自体DC-CIK细胞作为一种维持治疗手段,可提高规范治疗后获益的60岁以上IV期肺鳞癌男性患者的生活质量。本研究尚存在一些缺点:病例数量较少,随访时间较短,治疗疗程少,缺乏长期、动态的观察数据,所得部分结果可能存在一定误差。我们还将继续扩大病例数,增加治疗疗程数,延长随访时间,观察无疾病进展期及总生存期,进一步证实DC-CIK的治疗效果。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Shi SB,Ma TH,Li CH,et al.Effect of maintenance therapy with dendritic cells:cytokine-induced killer cells in patients with advanced non-small cell lung cancer[J].Tumori,2012,98(3):314-319.
[3] Gunnes N,Seierstad TG,Aamdal S,et al.Assessing quality of life in a randomized clinical trial:correcting for missing data[J].BMC Med Res Methodol,2009,9:28.
[4] Jang RW,Le Maitre A,Ding K,et al.Quality-adjusted time without symptoms or toxicity analysis of adjuvant chemotherapy in non-small-cell lung cancer:an analysis of the National Cancer Institute of Canada Clinical Trials Group JBR.10 trial[J].J Clin Oncol,2009,27(26):4268-4273.
[5] Blattman JN,Greenberg PD.Cancer immunotherapy:a treatment for the masses[J].Science,2004,305(5681):200-205.
[6] 邵 青,杨卫兵,余丽梅,等.自体CIK细胞维持治疗晚期非小细胞肺癌临床观察[J].西部医学,2011,23(9):1641-1643.
[7] González-Carmona MA,Märten A,Hoffmann P,et al.Patientderived dendritic cells transduced with an a-fetoprotein-encoding adenovirus and co-cultured with autologous cytokine-induced lymphocytes induce a specific and strong immune response against hepatocellular carcinoma cells[J].Liver Int,2006,26(3):369-379.
[8] Chang A.Chemotherapy,chemoresistance and the changing treatment landscape for NSCLC[J].Lung Cancer,2011,71(1):3-10.
[9] Thongprasert S,Duffield E,Saijo N,et al.Health-related qualityof-life in a randomized phase III first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients from Asia with advanced NSCLC(IPASS)[J].J Thorac Oncol,2011,6(11):1872-1880.
[10] Li XD,Xu B,Wu J,et al.Review of Chinese clinical trials on CIK cell treatment for malignancies[J].Clin Transl Oncol,2012,14(2):102-108.
[11] Hackstein H,Thomson AW.Dendritic cells:emerging pharmacological targets of immunosuppressive drugs[J].Nat Rev Immunol,2004,4(1):24-34.
[12]鲍 锋,盛春华,杨 光.DC-CIK细胞治疗中晚期恶性肿瘤531例分析[J].中国免疫学杂志,2011,27:360-362.
[13]张 蕾,李 平.生活质量在肿瘤治疗疗效评价中的应用[J].临床肺科杂志,2008,13(1):68-69.
[14]万崇华,张灿珍,宋元龙.肺癌患者生命质量测定研究概况[J].中国肿瘤,2001,10(2):83-85.
[15] Thongprasert S.Lung cancer and quality of life[J].Aust N Z J Med,1998,28(3):397-399.
[16]万崇华,罗家洪,张灿珍,等.癌症患者生命质量测定量表体系研究[J].中国行为医学科学,2003,12(3):341-342.
[17]孟 琼,万崇华,罗家洪,等.癌症患者生命质量测定量表体系中各量表的测量学特性分析[J].肿瘤,2011,31(3):245-249.

