Notch信号通路抑制剂对原代耐药白血病干细胞生长分化的影响
杜 宏,吴南海,栾 佐
·基础研究·
Notch信号通路抑制剂对原代耐药白血病干细胞生长分化的影响
杜 宏,吴南海,栾 佐
目的 探讨Notch信号通路抑制剂对白血病干细胞自我更新及分化的影响。方法 分离再诱导化疗前初次就诊复发患者骨髓中单个核细胞与Notch信号通路阻滞剂γ-分泌酶抑制剂DAPT共培养。细胞增殖抑制实验测定细胞存活率,干细胞集落培养测定集落形成能力及细胞自我更新能力。观察细胞形态。流式细胞术检测细胞表面CD34、CD38、CD123、CD14的表达水平。结果 DAPT抑制细胞增殖及自我更新,破坏细胞增多,并可显著减少S期(分裂期)细胞比例,使细胞分裂停滞于G1/G0期。结论 DAPT对细胞增殖和自我更新有抑制作用,并促进其向成熟阶段分化。
白血病干细胞;Notch信号通路;γ-分泌酶抑制剂
Notch基因最初是由突变果蝇翅上凹陷的表型所命名。随着研究的深入,Notch信号通路作为一个高度保守的信号传导通路,在胚胎发育、组织再生及肿瘤产生等多方面功能逐渐被人们所认识。Notch信号通路的调节异常成为一系列血液系统恶性肿瘤发生的关键事件。在多种肿瘤中均发现一类因干细胞功能异常而产生的一群具有自我更新能力的干细胞样细胞,即肿瘤干细胞,在白血病中称白血病干细胞(leukemia stem cells,LSCs)。LSCs的存在成为白血病复发、耐药及难治的一重要因素。本研究选取难治复发白血病样本中的单个核细胞为研究对象,难治及复发的临床特征表明其单个核细胞群中存在LSCs。本研究通过Notch信号通路抑制剂对难治复发白血病中单个核细胞群中的白血病干细胞的自我更新及分化的影响作一初步研究,现报道如下。
1 材料与方法
1.1 实验材料 γ-分泌酶抑制剂DAPT(美国,Sigma公司),溶于二甲基亚砜(dimethylsulfoxide,DMSO)中(美国,Xiasi Bio公司),以1 mmol/L浓度分装储存于-20℃避光保存。淋巴细胞分离液(中国医科院血研所科技公司)。1640培养液(美国,Gibco公司)。10%胎牛血清(fetal bovine serum,FBS,中国医科院血研所科技公司)。四甲基偶氮唑盐(methylthio tetrazole,MTT,美国,Sigma公司)。H4434培养基(加拿大,Stem Cell公司)。CD34、CD38、CD123、CD14、及阴性对照鼠免疫球蛋白(immunoglobulin,Ig)G(美国,BD公司)。
1.2 样本采集 样本选自中国医学科学院血液病研究所韩明哲教授惠赠初治复发白血病骨髓样本9例,患者临床特征见表1。取骨髓5 mL,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝,骨髓不用肝素抗凝。采集后1 h内经淋巴细胞分离液分离单个核细胞(mononuclear cells,MNCs)。
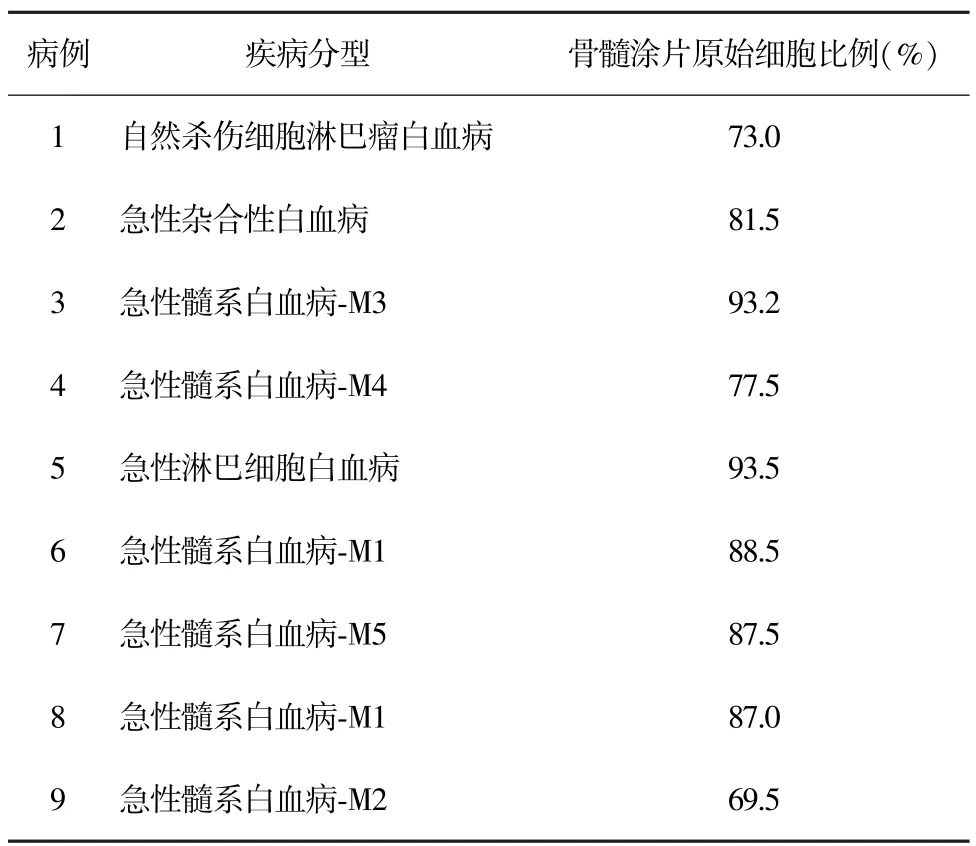
表1 患者临床特征
1.3 细胞培养 分离出的MNCs接种于培养瓶,培养液为加入10%FBS的1640培养液,于37℃、5%CO2全湿条件下培养。加药处理组DAPT以1 μmol/L浓度处理细胞。
1.4 细胞增殖抑制实验 将经淋巴细胞分离液分离的MNCs以1×104/mL接种于96孔板,每孔100 μL。DAPT以1 μmol/L浓度处理[1],设3个复孔,并设未加药孔作为对照组,药物作用5 d后加5% MTT溶液,每孔20 μL,置CO2培养箱孵育4 h,离心弃上清终止培养,加入DMSO每孔150 μL,于Bio-Rad 450型酶标仪570 nm读取各孔吸光度(A570)值,按细胞存活率(%)=A570用药组/A570未用药组× 100%计算。
1.5 干细胞集落培养 常规半固体培养法进行造血祖细胞培养7 d计数集落数。
1.6 细胞自我更新能力检测 1×105细胞于1 mL含10%FBS的1640培养液中培养5 d后,计数细胞,取其中1×104细胞植于H4434培养基中,于7 d后计数集落数。
1.7 细胞形态检测 药物处理5 d后细胞PBS洗3遍,甩片后甲醇固定10 min,行瑞特-姬姆萨染色,显微镜下观察细胞形态变化。
1.8 流式细胞术检测细胞表型 于药物处理48 h后收集培养细胞,采用直接免疫荧光染色法,加入藻红蛋白或异硫氰酸荧光素或藻红蛋白偶联物标志的鼠抗人CD34、CD38、CD123、CD14及阴性对照鼠IgG孵育30min,FBS洗涤2次后加入1%多聚甲醛0.5mL上机,采用FACScabilur型流式细胞术CELLQuest软件检测分析。
1.9 统计学处理 应用SPSS 10.0软件,计量资料以均数±标准差(¯x±s)表示,组间比较采用两样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 DAPT对细胞增殖的抑制作用 MTT测定结果表明,1 μmol/L浓度DAPT对白血病细胞的增殖有明显的抑制作用,DAPT处理组较对照组可抑制细胞存活率的(82.4±15.2)%,两者比较差异有统计学意义(P=0.02)。
2.2 DAPT对细胞形态的作用 瑞特-姬姆萨染色显示,DAPT作用后细胞形状不规则,细胞膜出现芽状或棘刺状突起,且破坏细胞增多(油镜放大100倍,图1)。
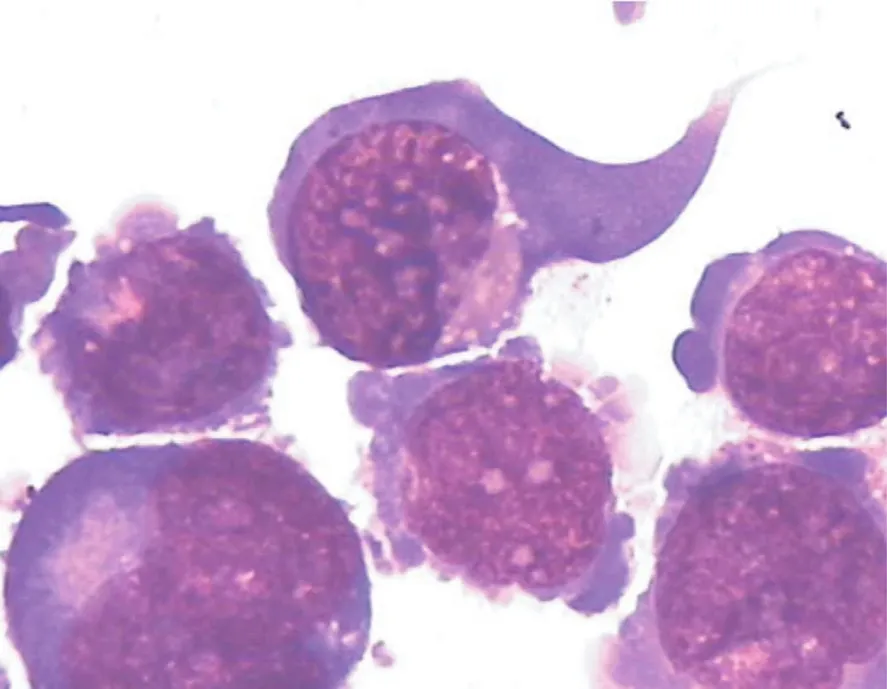
图1 经DAPT处理后细胞形态变化(瑞特-姬姆萨染色,×100)
2.3 DAPT对干细胞集落形成能力的抑制作用对照组集落形成数较加入DAPT处理组显著增加,差异有统计学意义(P=0.01,图2~4)。

图2 低倍镜下对照组克隆形成情况(未染色,×10)

图3 高倍镜下对照组克隆形成情况(未染色,×40)
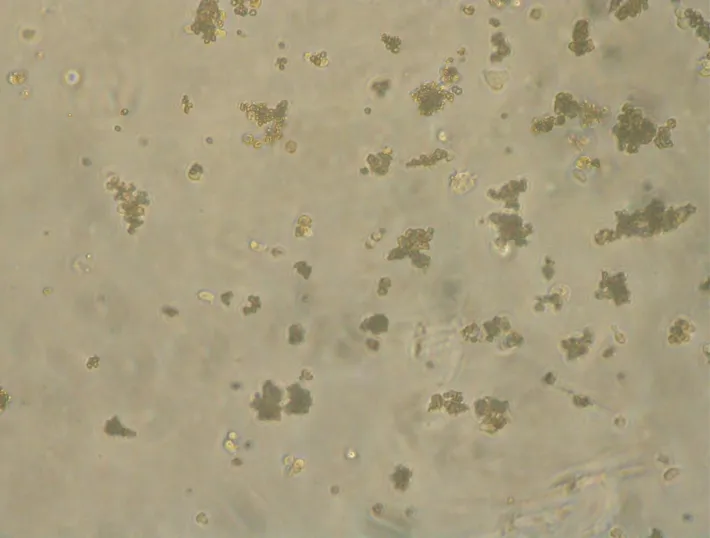
图4 加入DAPT处理7 d后细胞克隆形成情况(未染色,×40)
2.4 DAPT对细胞自我更新能力的作用 白血病细胞经DAPT处理7 d后再植细胞集落形成能力明显受抑,DAPT处理组较对照组再植细胞形成的集落数显著减少,差异有统计学意义(P=0.026)。
2.5 DAPT对细胞分化的影响 经流式细胞术对细胞表型的检测,DAPT处理48 h后,CD34、CD34+CD38-、CD123表达水平降低(P<0.05),CD14表达水平增高(P<0.05)。对DAPT处理后细胞行流式细胞术检测细胞周期显示,DAPT可显著减少S期(分裂期)细胞的比例,使细胞停滞于G1/G0期(图5、6)。
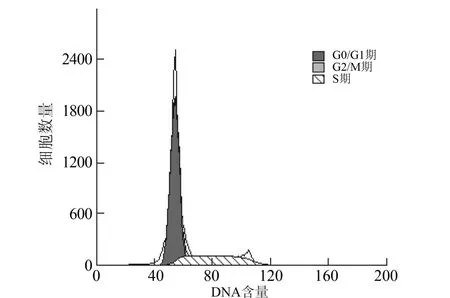
图5 对照组流式细胞周期

图6 处理组流式细胞周期
3 讨论
干细胞是体内最原始的一类细胞群,其具备自我更新及分化2个方面基本特征。同样LSCs同造血干细胞(hematopoietic stem cells,HSCs)一样也具备干细胞的特征,正是由于LSCs的自我更新特征使其成为白血病难治及复发的根本原因。因此,本研究中选取难治复发白血病样本中的单个核细胞为研究对象,其难治及复发的临床特征表明其单个核细胞群中存在LSCs。
Notch信号通路在调节干细胞自我更新及分化的平衡中发挥着关键作用[2]。Lee等[3]在最新的一系列有关HSCs研究中发现,白血病/淋巴瘤相关因子作为胚胎发育过程中特异性抑制干细胞自我更新特征的抑制物是通过抑制Notch信号通路Detta样配体4的表达而发挥作用。由此可认为,Notch信号通路的抑制有助于抑制干细胞的自我更新,也同样可能抑制LSCs的自我更新而减少因此导致的白血病复发和难治。在关于HSCs研究中也发现,在HSCs中Notch信号通路的表达是增强的,而在HSCs的分化过程中则表达减弱[4]。由此提示,Notch信号通路可能在抑制干细胞分化、促进其自我更新的过程中起作用。本研究发现,应用DAPT可促进白血病细胞CD14的表达,而降低CD34的表达水平。提示Notch信号通路的阻滞可抑制干细胞水平的细胞自我更新而促进细胞的分化,尤其是向单核细胞的分化。Neves等[5]利用表达Notch配体Delta1和Jagged1的基质细胞与CD34+CD38+细胞共培养的实验显示,Jagged1可减少粒系-巨系造血祖细胞集落和已分化的单核细胞数量,与本实验中Notch信号通路的阻滞促进细胞的分化,尤其是向单核细胞的分化的结果相一致。
LSCs作为白血病复发根源,存在于难治复发的肿瘤细胞中,有关其是否有独特的细胞表型也进行了相关研究。研究发现,白介素-3受体(interleukin-3 receptor,IL-3R)即CD123在急性髓细胞性白血病(acute myelocytic leukemia,AML)中被频繁发现,被认为与白血病细胞的增殖优势及不良预后密切相关[6]。IL-3R的过表达涉及高度恶性白血病表型的病理发生机制。对AML各亚细胞群的CD123表达水平进一步分析,发现在富含LSCs的细胞群即表型为CD34+CD38-的细胞群中CD123表达水平显著高于正常对照样本中的CD34+CD38-细胞群[7]。由此认为,CD123可以作为LSCs的标志。体内试验显示,纯化的CD34+CD123+细胞可植入非肥胖糖尿病/严重联合免疫缺陷小鼠中竞争性生成白血病细胞并维持白血病状态,进一步从功能上证实了CD34+CD123+细胞为LSCs。针对Notch信号通路与LSCs的关系,Chiang等[8]在Notch诱导的T系急性淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)的鼠模型中进行了相关研究发现,在HSCs中Notch信号通路的活化导致最初的造血系统以及T系祖细胞的活化、增殖并同时打破干细胞的静默状态。在HSCs中超生理水平的Notch信号通路活化可促进T系祖细胞中的LSCs的增殖,并同时伴随长期造血干细胞的消失。在本研究中,应用Notch信号通路阻滞剂DAPT与白血病细胞共培养后,使CD123的表达水平下降,同时CD34+CD38-表达水平也下降。提示Notch信号通路阻滞剂可以减少LSCs的数量,进一步解释DAPT可抑制样本中白血病细胞的自我更新能力并促进其分化的结果相一致。
经Notch1结构性活化激活的Notch信号通路是T淋巴细胞转变为T-ALL的最重要的致癌性信号通路[9-10]。Tohda等[11]对8个白血病细胞系和15例AML样本中Notch1和Jagged1蛋白水平进行了研究,发现Notch信号通路在AML中广泛存在且存在异常,推断与LSCs的自我更新增多及分化阻滞有关。Tohda等[12]又进一步运用 Delta重组蛋白与TMD7、OCI/AML-6细胞系体外共培养,发现Delta蛋白促进TMD7细胞的短期生长,而抑制自我更新及长期生存。同样在急性淋巴细胞白血病中,Notch信号通路也有异常活化,且与肿瘤的耐药及复发密切相关。Yuan等[13]研究发现,在T-ALL细胞系Jurkat中,Notch配体Jagged1和Notch受体Notch1均存在高表达,提示Notch信号通路自我活化的可能。应用中和抗体阻断Jagged1的表达可修复白血病细胞耐药,提高其对药物的敏感性。相反加入Jagged1重组体可对Jurkat细胞起到保护作用。而在应用Notch信号通路阻滞剂DAPT的本研究中,肿瘤细胞的干细胞集落形成能力和自我更新能力均较对照组显著受抑。本研究选取的样本均为复发患者的肿瘤细胞,其在二次再植集落形成实验中,可二次再植形成集落的肿瘤细胞中不乏白血病干细胞的成分,也正是这部分细胞组分的存在才使得细胞原代具备较强的自我更新能力。Notch信号通路阻滞剂DAPT可极大地抑制这群细胞的自我更新能力的研究结果,也与Notch信号通路的过度活化导致的白血病的复发相一致。Grieselhuber等[14]的研究团队则在急性早幼粒细胞白血病中也进行了相似的研究,在人急性早幼粒细胞白血病及前早幼粒细胞白血病的鼠模型(Ctsg-PML-RARα鼠)中应用基因学或药理学的Notch信号通路抑制剂均可去除前早幼粒细胞白血病的鼠模型中造血干/祖细胞已增强的自我更新能力,且在体内试验中发现Notch信号通路的基因移植物可有效抑制肿瘤细胞的生长。
Li等[15]研究发现,与Notch配体共培养的白血病细胞出现了形态的改变,部分细胞黏附于底部,呈现外形变长变窄,部分则呈现巨噬细胞样的形态。本研究中,应用Notch信号通路阻滞剂后,也出现形态的改变,细胞形状不规则,细胞膜出现芽状或棘刺状突起,且破坏细胞增多。考虑与Notch信号通路受抑后,促进细胞分化并改变细胞分化方向有关。
基于Notch信号通路在细胞转化、肿瘤生成过程中的关键性作用,Notch信号通路抑制剂抑制Notch信号通路并得以抑制肿瘤细胞生成及增殖的研究也广泛开展[16]。本研究中,Notch信号通路阻滞剂DAPT对白血病干细胞自我更新及分化方面的作用虽然作了初步的探讨,但对DAPT下一步用于抑制白血病干细胞自我更新以及促进分化,并进一步应用于难治及复发白血病的治疗指明了方向。
[1]Gal H,Amariglio N,Trakhtenbrot L,et al.Gene expression profiles of AML derived stem cells;similarity to hematopoietic stem cells[J].Leukemia,2006,20(12):2147-2154.
[2]Bigas A,D′Altri T,Espinosa L.The Notch pathway in hematopoietic stem cells[J].Curr Top Microbiol Immunol,2012,360:1-18.
[3]Lee SU,Maeda M,Ishikawa Y,et al.LRF-mediated Dll4 repression in erythroblasts is necessary for hematopoietic stem cell maintenance[J].Blood,2013,121(6):918-929.
[4]Duncan AW,Rattis FM,DiMascio LN,et al.Integration of Notch and Wnt signaling in hematopoietic stem cell maintenance[J].Nat Immunol,2005,6(3):314-322.
[5]Neves H,Weerkamp F,Gomes AC,et al.Effects of Delta1 and Jagged1 on early human hematopoiesis:correlation with expression of notch signaling-related genes in CD34+cells [J].Stem Cells,2006,24(5):1328-1337.
[6]Testa U,Riccioni R,Militi S,et al.Elevated expression of IL-3Ralpha in acute myelogenous leukemia is associated with enhanced blast proliferation,increased cellularity,and poor prognosis[J].Blood,2002,100(8):2980-2988.
[7]Jordan CT,Upchurch D,Szilvassy SJ,et al.The interleukin-3 receptor alpha chain is a unique marker for human acute myelogenous leukemia stem cells[J].Leukemia,2000,14(10):1777-1784.
[8]Chiang MY,Shestova O,Xu L,et al.Divergent effects of supraphysiologic Notch signals on leukemia stem cells and hematopoietic stem cells[J].Blood,2013,121(6):905-917.
[9]Weng AP,Ferrando AA,Lee W,et al.Activating mutations of NOTCH1 in human T cell acute lymphoblastic leukemia [J].Science,2004,306(5694):269-271.
[10]Blackburn JS,Liu S,Raiser DM,et al.Notch signaling expands a pre-malignant pool of T-cell acute lymphoblastic leukemia clones without affecting leukemia-propagating cell frequency[J].Leukemia,2012,26(9):2069-2078.
[11]Tohda S,Murata-Ohsawa M,Sakano S,et al.Notch ligands,Delta-1 and Delta-4 suppress the self-renewal capacity and long-term growth of two myeloblastic leukemia cell lines [J].Int J Oncol,2003,22(5):1073-1079.
[12]Tohda S,Kogoshi H,Murakami N,et al.Diverse effects of the Notch ligands Jagged1 and Delta1 on the growth and differentiation of primary acute myeloblastic leukemia cells [J].Exp Hematol,2005,33(5):558-563.
[13]Yuan Y,Lu X,Chen X,et al.Jagged1 contributes to the drug resistance of Jurkat cells in contact with human umbilical cord-derived mesenchymal stem cells[J].Oncol Lett,2013,6(4):1000-1006.
[14]Grieselhuber NR,Klco JM,Verdoni AM,et al.Notch signaling in acute promyelocytic leukemia[J].Leukemia,2013,27(7):1548-1557.
[15]Li L,Forman SJ,Bhatia R.Expression of DLK1 in hematopoietic cells results in inhibition of differentiation and proliferation[J].Oncogene,2005,24(27):4472-4476.
[16]Shao H,Huang Q,Liu ZJ.Targeting Notch signaling for cancer therapeutic intervention[J].Adv Pharmacol,2012,65:191-234.
Effects of Notch inhibitor γ-secretase inhibitor on the growth differentiation of primary drug-resistant leukemia stem cells
DU Hong,WU Nanhai,LUAN Zuo
(Department of Pediatrics,Navy General Hospital,Beijing 100048,China)
Objective We do some research about effects of Notch inhibitor γ-secretase inhibitor(DAPT)on the growth differentiation of leukemia stem cells(LSCs).Methods Mononuclear cells(MNCs)separated from bone marrow from 9 pro-induction chemotherapy relapsed patients were cultrure in wells with DAPT.We evaluated the cells survival rate by cell proliferation inhibition experiment,tested colony forming ability and the self-renewal capacity by stem cell colon cultivation,and observed cells morphology.We evaluated the expression levels of CD34,CD38,CD123,CD14 by flow cytometric analysis.Results The result showed that DAPT inhibited the cells proliferation and self-renewal capacity of LSCs and increased the express of differentiation marker such as CD14. There were more destroied cells by cultured with DAPT and less S phase cell by cultured with DAPT,more cells were division arrested in G1/G0 phase.Conclusion DAPT have inhibitory action to LSCs proliferation and self-renewal capacity.DAPT can promote the LSCs different to more maturation stage.
Leukemia stem cells(LSCs);Notch pathway;γ-secretase inhibitor
R733.7
A
2095-3097(2015)01-0032-05
10.3969/j.issn.2095-3097.2015.01.010
2014-01-02 本文编辑:徐海琴)
100048北京,海军总医院儿科(杜 宏,吴南海,栾 佐)
栾 佐,E-mail:luanzuo@aliyun.com.cn

