螺旋藻提取物对S180荷瘤小鼠抑瘤作用的研究
孙玉红
安徽省阜阳市人民医院药剂科,安徽阜阳 236300
螺旋藻提取物对S180荷瘤小鼠抑瘤作用的研究
孙玉红
安徽省阜阳市人民医院药剂科,安徽阜阳 236300
目的 研究螺旋藻提取物对S180荷瘤小鼠的抑瘤作用以及对荷瘤小鼠胸腺脾脏重量的影响。 方法将腋下移植了S180腹水瘤的昆明种小鼠根据性别分别分成模型组(生理盐水组)、环磷酰胺组(30 mg/kg)、螺旋藻提取物(80、40、20、10、5 mg/kg)组,每组10只,连续灌胃给药10 d。第11天小鼠称重,脱臼处死,摘取瘤块,分离,称重,计算抑瘤率。摘取胸腺、脾脏,称量湿重,计算胸腺脾脏指数。 结果环磷酰胺组瘤重较模型组低(P<0.05),螺旋藻提取物高浓度(80 mg/kg)组瘤重与模型组无差异(P>0.05),螺旋藻提取物低浓度(40、20、10、5 mg/kg)组瘤重较模型组低(P<0.05),但仍比环磷酰胺组高(P<0.05)。螺旋藻提取物低浓度组(10、20、10、5 mg/kg)抑瘤率明显高于高浓度(80 mg/kg)组(P<0.05),但仍低于环磷酰胺组(P<0.05)。 结论螺旋藻提取物的抑瘤作用与浓度有关,低浓度的抑瘤作用比高浓度显著,其直接治疗效果虽不如环磷酰胺明显,但其能很好的提高机体免疫器官的重量,促进机体免疫器官的发育。
螺旋藻;S180荷瘤小鼠;抑瘤作用
螺旋藻 (Spirulina)是一类没有细胞核的低等植物,属于蓝藻(Cyanophyta)、颤藻科(Oscillatoraceae)、螺旋藻属。螺旋藻是目前地球上人类已知的营养成分最丰富均衡的生物,含有大量蛋白质、纤维素、必需氨基酸和矿物质等丰富均衡的营养成分和多种活性物质,具有蛋白质含量高、繁殖速度快等特点,是一种很好的纯天然食品[1]。螺旋藻含有藻蓝蛋白、多糖、β-胡萝卜素、γ-亚麻酸等多种生物活性物质,这些物质以其特有的营养和保健价值受到广泛的重视。而在这众多的活性物质中,藻蓝蛋白和多糖是目前研究的热点。藻蓝蛋白具有一定的医疗价值,美国哈佛医院Schwartz等[2]发现螺旋藻藻蓝蛋白对癌细胞有抑制作用。蔡心涵等[3]研究了螺旋藻藻蓝蛋白对激光疗法的增敏作用。近年来大量研究结果已经表明,螺旋藻多糖具有抗辐射和抗肿瘤作用,此外还有提高核酸内切酶的活性、促进修复和提高机体免疫力的功效。刘力生等[4]报道了螺旋藻多糖具有明显的体外抑瘤作用。吴洁等[5]研究发现,螺旋藻多糖能显著提高免疫功能低下小鼠NK细胞杀伤力,并能明显刺激ConA诱导的体外淋巴细胞转化。大量文献综述以及实验证明,螺旋藻具有很好的抗肿瘤、抗氧化、抗辐射、降血糖、免疫调节、保肝、促进细胞生长、清除自由基等多种生理活性[6-11]。究竟是哪种成分起到主要作用还有待进一步的实验验证。我国对螺旋藻的利用仅处于其保健作用,作为药物使用的研究极少。本实验以S180荷瘤小鼠为实验模型,通过计算其抑瘤率证明了螺旋藻提取物具有明显的抗肿瘤作用,通过螺旋藻提取物抗肿瘤药效学动物实验探究螺旋藻提取物对S180荷瘤小鼠的抗肿瘤作用,从而对大规模生产的螺旋藻提取物的药效学给予验证。通过测定其胸腺脾脏的重量证明螺旋藻提取物对免疫器官的增长具有一定的促进作用,为螺旋藻的临床应用提供了一定的实验数据。
1 材料与方法
1.1 材料
动物和瘤株:选择10周龄左右健康昆明小鼠,雌雄各半,体重18~22 g,由山东绿叶制药有限公司提供,合格证编号:SCXK(鲁)20140009。S180瘤株由烟台大学生命科学院提供。
试剂及药品:螺旋藻提取物为笔者实验制备,依据相关文献[12],通过高速离心、超滤、喷雾干燥后得到粗提取物。环磷酰胺为江苏恒瑞医药股份有限公司生产(批号:14021525),是一种烷化剂,主要用于肿瘤免疫,对多种肿瘤有明显的抑制作用,为本研究的阳性对照药。实验中用生理盐水配成0.2 mg/mL,现用现配。
1.2 方法
1.2.1 肿瘤细胞的复苏 从液氮中取出冻存管,直接浸入37℃温水中,并不时摇动,尽快融化。从37℃水浴中取出冻存管,取出细胞悬液,加到离心管并加入10倍以上细胞培养液,混匀,以1000 r/min离心5 min,弃去上清液,加入10%小牛血清培养液重悬细胞,计数,调整细胞密度。接种培养瓶,37℃培养箱中静置培养。
1.2.2 S180腹水瘤传代细胞的制备 取肿瘤细胞按1∶2的比例稀释,抽取0.3 mL注射到健康小鼠腹腔。每隔7 d进行1次腹水传代,传代4~5次后肿瘤细胞趋于稳定。
1.2.3 制备S180肿瘤动物模型 小鼠肉瘤S180瘤株腹腔接种传代,待腹水生长旺盛时,无菌条件下抽取腹水,用灭菌的生理盐水按腹水∶生理盐水=1∶7稀释。采用台盼蓝染色法,取0.2 mL细胞悬液加等量0.4%台盼蓝溶液,充分混匀,立即取少许于载玻片上,覆于盖玻片,用低倍镜计数至少200个细胞,计算细胞活力=(总细胞数-着色细胞数)/总细胞数×100%。本实验抽取适用的小鼠腹水细胞活力约为1.05×107个/mL。无菌条件下取细胞计数为1.05×107个/mL的S180腹腔积液混悬液,每只小鼠右前肢腋窝皮下接种0.2 mL。整个操作过程30 min内完成,24 h后随机分组。
1.2.4 动物分组及给药 接种后24 h,随机分成14组,雌性7组,雄性7组,每组10只,分开放置,分别编号为 A1、A2、B1、B2、C1、C2、D1、D2、E1、E2、F1、F2、G1、G2,其中1为雌性,2为雄性。A组为模型组(生理盐水组)每天给予生理盐水0.5 mL灌胃;B、C、D、E、F组为螺旋藻提取物各剂量组,分别按每日5、10、20、40、80 mg/kg灌胃;G组为环磷酰胺阳性对照组,每日给予30 mg/kg环磷酰胺生理盐水溶液3 mL灌胃。连续给药10 d。
1.3 指标检测
末次给药24 h后,小鼠称重,脱臼处死,摘取瘤块,分离,称重,计算抑瘤率。抑瘤率(%)=(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重×100%。摘取胸腺、脾脏,电子天平称量湿重,计算胸腺、脾脏指数。小鼠胸腺(脾脏)指数=小鼠胸腺(脾脏)重量/小鼠体重×10。
1.4 统计学方法
采用SAS 8.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠一般情况
实验过程中小鼠活动正常,精神状态良好,毛色有光泽,其中,螺旋藻提取物10、20 mg/kg剂量组小鼠明显比较活跃;螺旋藻提取物80 mg/kg剂量组小鼠雌性组意外死亡2只,且未死亡的小鼠精神状态不佳,消瘦,肿瘤较大,抑制其行动,表现出异常;环磷酰胺组小鼠精神状态最佳,肿瘤与其他组比较明显较小,小鼠正常活动,且小鼠比较活跃;生理盐水组小鼠出现活动减少、消瘦、精神萎靡、毛色不清洁,且小鼠肿瘤生长最大,有向腹部、头部转移的趋势,小鼠开始出现张口呼吸的状态。
2.2 各组小鼠肿瘤重量比较
从实验数据可知,螺旋藻提取物各剂量组与环磷酰胺组平均瘤重均小于生理盐水组,除螺旋藻提取物80 mg/kg组外,其他组瘤重与生理盐水组比较,差异均有统计学意义(P<0.05),且环磷酰胺组瘤重最低(P<0.05)。提示螺旋藻提取物各剂量组均有很好的抑瘤作用,但其抑瘤作用弱于环磷酰胺。在雌雄小鼠间瘤重差异无统计学意义(P>0.05)。见表1、图1。
表1 雌雄各组小鼠肿瘤重量比较(g,)
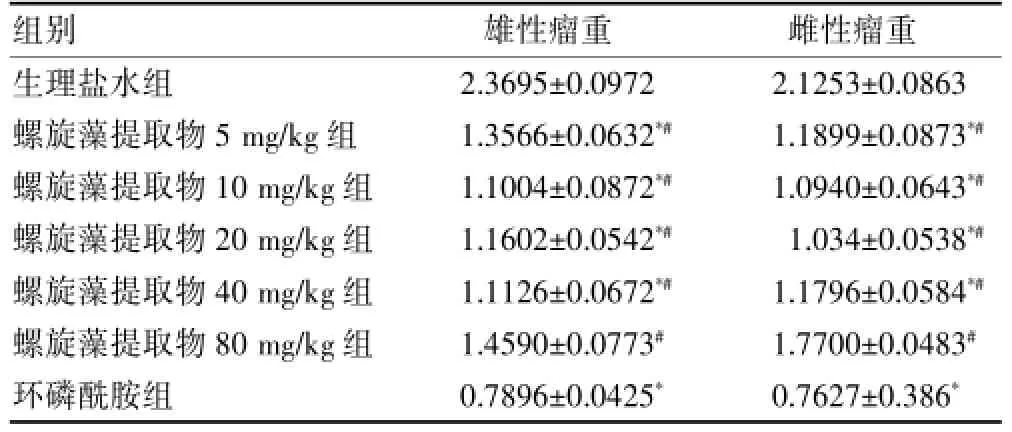
表1 雌雄各组小鼠肿瘤重量比较(g,)
注:与生理盐水组比较,*P<0.05;与环磷酰胺组比较,#P<0.05
组别 雄性瘤重 雌性瘤重生理盐水组螺旋藻提取物5 mg/kg组螺旋藻提取物10 mg/kg组螺旋藻提取物20 mg/kg组螺旋藻提取物40 mg/kg组螺旋藻提取物80 mg/kg组环磷酰胺组2.3695±0.0972 1.3566±0.0632*#1.1004±0.0872*#1.1602±0.0542*#1.1126±0.0672*#1.4590±0.0773#0.7896±0.0425*2.1253±0.0863 1.1899±0.0873*#1.0940±0.0643*#1.034±0.0538*#1.1796±0.0584*#1.7700±0.0483#0.7627±0.386*

图1 雌雄小鼠肿瘤重量比较
2.3 各组小鼠抑瘤率比较
由结果可知,与环磷酰胺相比螺旋藻提取物的抑瘤率较低(P<0.05)。当螺旋藻提取物浓度为5、10、20、40 mg/kg时其抑瘤效果较好,且雌雄小鼠差异无统计学意义(P>0.05)。当螺旋藻提取物浓度达80 mg/kg时,其对肿瘤的抑制作用有明显下降的趋势,实验中螺旋藻提取物80 mg/kg雌性组有2只小鼠死亡且剩余未死亡雌性小鼠和雄性小鼠精神状态都不佳,且肿瘤较大。推测与螺旋藻提取物对实验小鼠的肿瘤抑制作用下降有关。由抑瘤率结果可见,当螺旋藻提取物浓度处于5~40 mg/kg时,其对肿瘤的抑制作用略有上升,当螺旋藻提取物浓度继续增大时,其抑瘤率有下降的趋势。见表2、图2。
2.4 各组小鼠胸腺及脾脏指数比较
从实验结果可知,在雌性和雄性小鼠中,螺旋藻提取物5、10、20、40 mg/kg剂量组对小鼠的免疫器官均有一定的促进作用,与生理盐水组比较,差异有统计学意义(P<0.05);环磷酰胺组小鼠胸腺及脾脏指数低于螺旋藻提取物各剂量组(P<0.05),小鼠性别差异无统计学意义(P>0.05)。在雌性小鼠80 mg/kg剂量组中,小鼠胸腺指数和脾脏指数均有降低的趋势,这与实验中雌性小鼠80 mg/kg剂量组死亡的现象有一定的关系。见表3、图3、4。
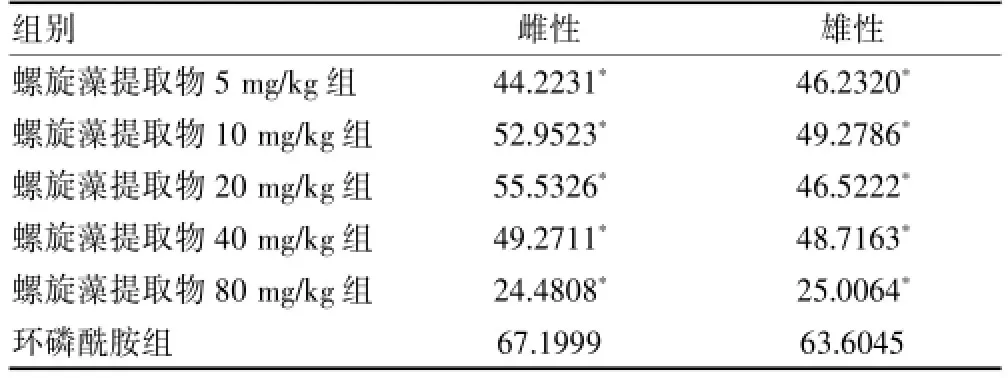
表2 各组小鼠抑瘤率比较(%)
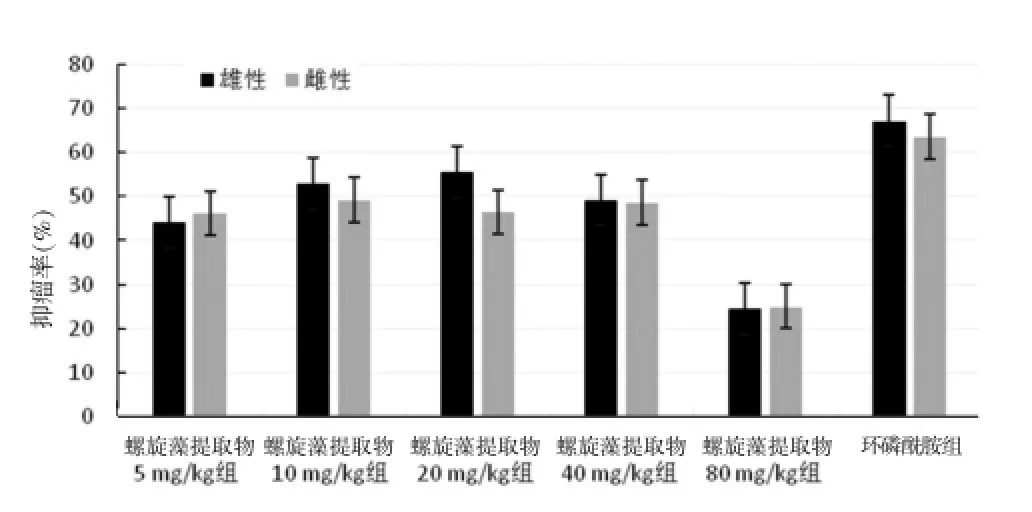
图2 各组小鼠抑瘤率比较
表3 各组小鼠胸腺及脾脏指数比较(mg/g,)

表3 各组小鼠胸腺及脾脏指数比较(mg/g,)
注:与生理盐水组比较,*P<0.05;与环磷酰胺组比较,#P<0.05
组别 胸腺指数 脾脏指数生理盐水组雌性雄性螺旋藻提取物5mg/kg组雌性雄性螺旋藻提取物10 mg/kg组雌性雄性螺旋藻提取物20 mg/kg组雌性雄性螺旋藻提取物40 mg/kg组雌性雄性螺旋藻提取物80 mg/kg组雌性雄性环磷酰胺组雌性雄性85.4972±18.8129 66.9745±11.4376 166.6436±24.3421 141.6234±12.8754 95.0561±12.2915*#79.6508±15.1418*#159.9229±23.6034*#169.8730±18.9987*#90.8821±13.7692*#87.5270±15.6512*#204.9045±21.9872*#197.2603±16.9532*#90.7725±17.4361*#81.5509±10.1915*#172.3534±19.1346*#164.2902±20.7397*#94.6752±19.9408*#76.6238±12.3421*#156.1956±15.9703*#158.6817±23.2542*#93.9858±17.9385#75.3190±13.3163#165.0890±11.9776#153.4392±15.6632#64.8279±14.3342*48.4844±14.5741*145.1561±22.7761*143.5057±19.6555*
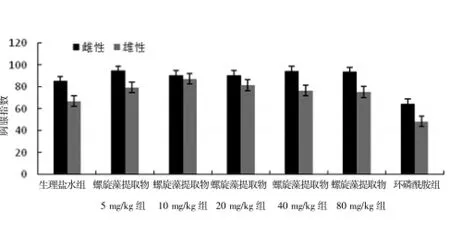
图3 各组小鼠胸腺指数比较
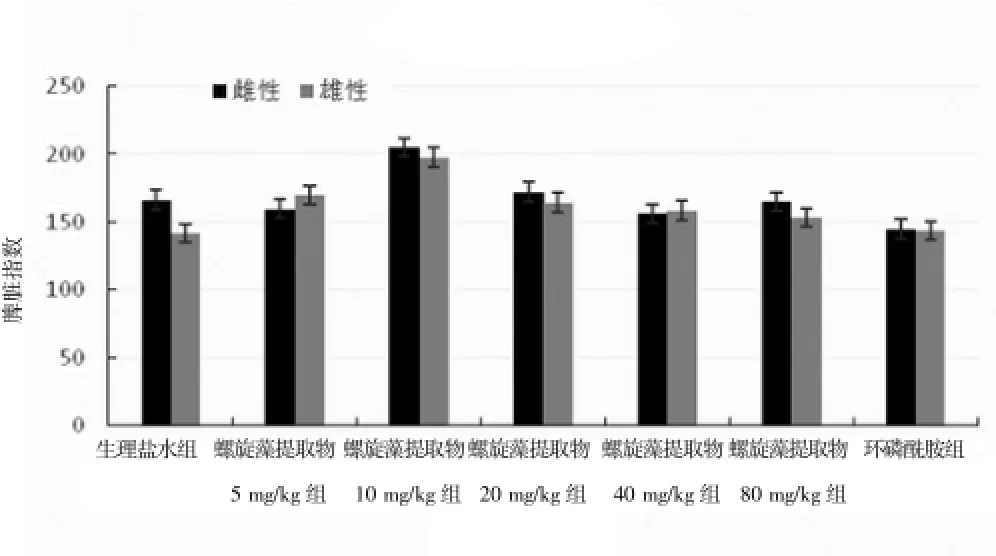
图4 各组小鼠脾脏指数比较
3 讨论
在螺旋藻提取物浓度处于5~40 mg/kg时,其对肿瘤的抑制作用是逐渐上升的,且螺旋藻提取物剂量组对小鼠胸腺、脾脏等免疫器官均有良好的促进作用;当螺旋藻提取物浓度继续增大时,其抑瘤率下降。在本实验中对雌性和雄性小鼠进行了分组,目的是研究螺旋藻提取物对不同性别小鼠的作用是否有差别,通过实验研究发现,当螺旋藻提取物浓度处于5~40 mg/kg时,对不同性别小鼠的抗肿瘤作用没有明显差异。当螺旋藻提取物浓度为80 mg/kg时,雌性小鼠有死亡现象,雄性小鼠虽未死亡但是有明显的消瘦和精神不振的现象,后期实验数据显示其对不同性别小鼠免疫器官的影响无明显差别。实验中螺旋藻提取物浓度过高时其抑制肿瘤的作用明显下降且有一定的毒性。由此推测高剂量的螺旋藻提取物能够产生一定的细胞毒性作用,引发机体免疫功能下降,由此引发小鼠的死亡。这为继续探究螺旋藻提取物抗肿瘤药效剂量有重要的意义。对以后螺旋藻提取物抗肿瘤作用最佳剂量的继续探究有很好的参考价值。
螺旋藻中主要的抗肿瘤活性物质是藻蓝蛋白和多糖,研究表明,螺旋藻多糖、藻蓝蛋白在减轻对肺癌的化疗、放疗副作用、升高白细胞方面均有确切效果[13]。于虹等[14]及杜玲等[15]报道螺旋藻多糖在一定浓度范围内对S180荷瘤具有一定的抑制作用,螺旋藻多糖能增加脾脏和胸腺的重量,并通过全面调节机体的免疫功能,刺激T细胞、NK细胞等功能来达到控制和杀灭肿瘤细胞的目的。刘永举等[16]研究也表明,螺旋藻多糖能通过提高小鼠的免疫功能来抑制肿瘤的生长。大量文献综述以及实验证明,螺旋藻藻蓝蛋白具有很好的抗肿瘤、抗氧化、抗辐射、降血糖、血脂、免疫调节、保肝、促进细胞生长、清除自由基等多种生理活性[6-11,17-19]。在藻蓝蛋白的抗肿瘤实验中,大量的体外抗肿瘤实验证明,藻蓝蛋白对Hela细胞、肝癌细胞SMMC-7721等都有很好的抑制作用[20]。在藻蓝蛋白的体内抗肿瘤实验中,李冰等[21]通过实验探究了藻蓝蛋白以及多糖对小鼠肿瘤的抑制作用。实验以S180荷瘤小鼠为实验模型,通过计算其抑瘤率证明螺旋藻提取物具有明显的抗肿瘤作用。本研究显示,通过螺旋藻提取物剂量组与环磷酰胺组比较发现,螺旋藻提取物能够很好地提升胸腺指数和脾脏指数,提高机体免疫器官的重量,促进机体免疫器官的发育,从而增强机体免疫机能,而环磷酰胺组胸腺脾脏指数均有下降的趋势,说明环磷酰胺对免疫器官有损伤,螺旋藻提取物很好地避免化学药品对机体免疫器官损伤的现象,具有良好的开发前景。
本实验提示螺旋藻提取物主要是通过增强和恢复机体的免疫网络功能来达到抑制肿瘤细胞的作用,但具体是藻蓝蛋白还是螺旋藻多糖发挥作用还需要进一步的实验验证。螺旋藻提取物在免疫化疗中具有相当好的应用前景。螺旋藻抑制肿瘤细胞生长的有关机制目前正在研究,其作为天然植物在我国资源丰富,但我国对螺旋藻的利用仅处于其保健作用,作为药物使用的研究极少。目前随着螺旋藻的提取纯度提高,其临床研究及应用将会进一步深入。
[1]Vadiraja BB,Madyastha K.Scavenging of Peroxynitrite by Phycocyaninand Phycocyanobilin from Spirulina platensis:Protection against OxidativeDamage to DNA[J].Biochemical and Biophysical Research Communications,2007,28(5):262-266.
[2]Schwartz JL,Sklar G.Growth inhibition and destruction of oral cancer cells by extracts of Spirulina[J].Proc Amer O-ral Pathol,1986,40:23-27.
[3]蔡心涵,何立明,蒋家伦,等.螺旋藻藻蓝蛋白对激光疗法增敏作用的研究[J].中国海洋药物,1995,14(1):15-18.
[4]刘力生,郭宝红,阮继红.螺旋藻多糖对移植性癌细胞的抑制作用及其机理研究[J].海洋科学,1991,15(5):33-38.
[5]吴洁,张成武,刘义峰.极大螺旋藻胞外多糖EPⅡ的分离纯化及免疫学研究[J].药物生物技术,1999,6(2):99-102.
[6]王勇,钱峰,钱凯先,等.藻蓝蛋白的抗癌活性研究[J].浙江大学学报:工学版,2001,35(6):672-674.
[7]张申峰.藻蓝蛋白及其亚基的分离纯化和体外抗肿瘤研究[D].杭州:浙江大学,2005.
[8]陈新美,王晓华.螺旋藻藻蓝蛋白的稳定性级抗癌活性研究[J].氨基酸和生物资源,2006,28(1):59-62.
[9]张成武,刘宇峰,王习霞,等.螺旋藻藻蓝蛋白对人血癌细胞株HL-60、K-562和U-937的生长影响[J].海洋科学,2000,24(1):45-48.
[10]张昕,郦剑勇,龚兴国,等.螺旋藻藻蓝蛋白C-藻蓝蛋白亚基分离及抗肿瘤活性研究[J].浙江大学学报:理学版,2010,37(3):319-323.
[11]李敏,黄惟立,叶颖,等.螺旋藻不同组份对小鼠脾细胞分泌IL-2的促进作用[J].中国海洋药物,2001,20(3):36-39.
[12]Soni B,Trivedi U,Madamwar D.A novel method of single step hydrophobic interaction chromatography for the purifcation of phycocyanin from Phormidium fragile and its characterization for antioxidant propert[J].Bioresource Technology,2007,16(3):242-249.
[13]张成武,曾昭琪,张爱贞,等.钝顶螺旋藻多糖和藻胆蛋白对小鼠急性放射病的防护作用 [J].营养学报,1996,18(1):327-332.
[14]于红,张学成.螺旋藻多糖抗肿瘤作用的实验研究[J].高技术通讯,2003,(7):83-86.
[15]杜玲,扈瑞平,穆文静,等.非洲乍得湖钝顶螺旋藻多糖对S180腹水瘤小鼠免疫抗肿瘤作用的实验研究[J].天然产物研究与开发,2014,(6):957-960
[16]刘永举,贾玉辉,唐超,等.复合螺旋藻多糖对S180荷瘤小鼠免疫功能的影响[J].青岛农业大学学报:自然科学版,2014,31(1):27-30.
[17]左绍远,钱金袱,万顺康,等.钝顶螺旋藻多糖调血脂实验研究[J].中国生化药物杂志,2000,12(6):289-291.
[18]左绍远,钱金袱,万顺康,等.螺旋藻多糖降血糖活性实验研究[J].时珍国医国药,2000,11(8):677-678.
[19]陈新美,王晓华.螺旋藻藻蓝蛋白的稳定性级抗癌活性研究[J].氨基酸和生物资源,2006,28(1):59-62.
[20]唐玫,金鹰,郭宝江,等.螺旋藻藻蓝蛋白对小鼠免疫功能的影[J].暨南大学学报,1998,19(5):93-97.
[21]李冰,张学成,高美华,等.钝顶螺旋藻藻蓝蛋白和多糖的抗肿瘤免疫活性研究[J].中国海洋大学学报,2004,34(3):396-402.
Antitumor role of the extraction from spirulina in S180-tumor bearing mice
SUN Yuhong
Department of Pharmacy,Fuyang People's Hospital,Anhui Province,Fuyang 236300,China
Objective To study the antitumor activity and its influence of the spirulina extraction on the weight of thymus and spleen of S180 tumor-bearing mice.Methods S180-tumor bearing mice were established and randomly divided into model group,Cyclophosphamide and spirulina extraction(80,40,20,10,5 mg/kg)groups,according to the gender,each of which contained 10 mice.Mice from each group were administrated daily via gavage with normal saline, Cyclophosphamide(30 mg/kg)or the extraction from spirulina(80,40,20,10,5 mg/kg)respectively for 10 days.At day 11,mice were decapitated after recording the weight,then the tumor tissues were detached and weighted for the weight as well as the tumor inhibition rates were recorded.Moreover,the wet weight of thymus and spleen of each mouse was recorded for thymus index calculation.Results The average tumor weight of Cyclophosphamide group was significantly lower than that of model group (P<0.05),and there was no obvious change of average tumor weight between the spirulina extract group(80 mg/kg)and model group(P>0.05).Besides,the tumor weight of spirulina extract group(40,20, 10,5 mg/kg)was lower than that of model group(P<0.05),but still higher than that of Cyclophosphamide group(P<0.05).The tumor inhibition rates of the spirulina extract(40,20,10,5 mg/kg)group was significantly higher than that of corresponding high concentration(80 mg/kg)group(P<0.05),but still lower than that of Cyclophosphamide group(P<0.05).Conclusion The anti-tumor effect of spirulina extraction in tumor mice model is determined by the concentration.Low-concentration spirulina extraction shows better anti-tumor effect than high-concentration spirulina extraction. Though low-concentration spirulina extraction exhibit less direct anti-tumor effect than that of Cyclophosphamide,it can promote the growth of immune organs and further indirectly improve the function of immunological system of mice bearing with cancer.
Spirulina;S180-tumor bearing mice;Antitumor
R282.77
A
1673-7210(2015)11(c)-0043-05
2015-08-20本文编辑:程 铭)

