基于二氧化钛光催化剂生物质转化制备氢气和化学品的研究进展
种瑞峰,吴文鹏,张 凌,李德亮,常志显*
(1.河南大学 化学化工学院,环境与分析科学研究所,河南 开封 475004;2.中国科学院 大连化学物理研究所,洁净能源国家实验室,辽宁 大连 116023)
生物质能是一种可再生能源,是仅次于煤炭、石油、天然气的第四大能源,其在构建稳定、清洁、安全的能源供应体系中具有非常重要的地位.近年来,世界各国都加大了对生物质能开发利用的力度.生物质资源是由生物直接或间接利用光合作用形成的有机物,是生物质能的重要来源.自然界每年通过光合作用合成的生物质资源达2 000亿吨,其中95%为可利用碳水化合物,然而只有3%~4%的碳水化合物作为食品以及非食品被人类利用.太阳能储量丰富、分布广泛,是理想的可再生资源.因此,对生物质能和太阳能的开发,利用太阳能转化生物质为碳基化学品或燃料,是解决当今能源和环境问题的重要途径之一,已成为科学技术领域研究的热点.
光催化生物质转化,即利用太阳能光催化转化生物质为人类可利用的燃料或化学品,是太阳能和生物质能利用的主要途径.目前,光催化生物质转化的研究主要集中在制H2和化学品方面[1-2],包含3种过程:1)光催化重整生物质制H2(Biomass reforming),是指在合适的半导体催化剂上将生物质分子完全转化为H2和CO2;2)光催化氧化生物质制备化学品(Biomass oxidation),主要是在反应中将生物质部分的氧化,使反应停留在中间产物阶段;3)光催化生物质转化同时制H2和化学品(Biomass conversion).以负载贵金属的TiO2为例,光催化重整生物质制H2和化学品的过程如图1所示.在光催化重整生物质制H2(Biomass reforming)过程中,导带上的光生电子迁移到具有较高功函数和较低费米能级的金属上,发生H+还原反应生成H2(process i);生物质和H2O在催化剂表面或助催化剂上被价带上光生空穴氧化转化为CO2(process ii).在光催化生物质氧化(Biomass oxidation)过程中,O2接受导带上的电子发生还原反应(process iii);生物质和价带上空穴或空穴氧化水产生的活性物种发生氧化反应转化为化学品(process iv).在光催化生物质转化(Biomass conversion)的过程中,导带上发生H+还原反应生成H2(process i);同时,价带上发生生物质的氧化过程生成化学品(process iv).

本文作者以TiO2光催化剂为例,介绍光催化重整生物质制H2、光催化氧化生物质制备化学品及光催化生物质转化同时制H2和化学品三方面的研究进展,分析光催化生物质转化过程的反应机理,探索光催化生物质转化的新途径,同时对光催化生物质转化存在的问题进行了分析和展望.
1 光催化生物质重整制H2
1.1 光催化重整甲醇、乙醇制H2
在光催化重整生物质制H2领域,甲醇、乙醇是最常用的制H2半反应的牺牲试剂.1980年,KAWAI等采用机械混合的TiO2和Pd、Pt、RuO2进行光催化重整甲醇制H2,最高量子效率达到44%[3].他们认为光催化重整甲醇体系类似于一个以TiO2作为光阳极、贵金属作为对电极的光电化学池.从此拉开了金属纳米颗粒和半导体复合体系光催化重整生物质制H2研究的序幕.李灿课题组研究发现,通过控制金属助催化剂的尺寸可以提高产氢活性.以Au/TiO2为例,Au纳米粒子的粒径越小单位质量的产氢效率越高.这是因为粒径越小纳米粒子表面原子数所占比例越高,即表面活性位数目越高,产氢活性也越高[4].CHIARELLO等也报道了类似的现象,颗粒小、分散性好的助催化剂(Ag、Au、Au-Ag合金和Pt)可以显著提高TiO2光催化剂对甲醇的光催化产氢活性[5].WU等研究发现采用廉价的CuOx作为TiO2的助催化剂,可以有效地促进电荷的分离,进而大幅度提高TiO2光催化重整乙醇的产氢活性[6].
除了对助催化剂的研究外,通过对半导体催化剂的合成方法改进和设计也能提高光催化剂的产氢活性.STRATAKI等采用Pt/TiO2作为催化剂,通过对TiO2的合成条件进行优化,在乙醇重整制氢的反应中获得了高达74%的量子效率[7].李灿课题组通过构建TiO2的异相结也大幅度提高了TiO2的产氢活性[8-10].WANG等构建了具有p-n结结构的CoOx/TiO2纳米颗粒,在甲醇和乙醇的重整制氢中其性能远远优于商品P25[11].
1.2 光催化重整甘油制H2
甘油,即丙三醇,是制备生物柴油以及肥皂工业的副产物,它的重整制氢具有重要价值[12].研究发现,光照条件下,甘油在担载贵金属的TiO2表面可以转化为H2和CO2[13-14].GOMBAC等使用微乳法制备CuOx/TiO2催化剂,并研究了光催化重整甘油制氢反应,发现其活性高于采用浸渍法制备的CuOx/TiO2的[15].MONTINI等通过光沉积的方法制备Cu/TiO2催化剂,发现其在光催化甘油产氢反应中表现出很好的活性[16].值得一提的是,在该反应中作者采用高度分散的Cu物种作为助催化剂取代贵金属,进一步降低了催化剂成本.同时,作者通过GC-MS对反应液进行检测,发现有多种中间产物存在,其中1,3-二羟基丙酮和羟基乙醛具有工业应用价值.在此基础上,作者提出了光催化甘油重整制氢反应的基本途径.如图2所示,作者认为在该反应中主要涉及到甘油上羟基官能团的氧化,进而产生一系列的中间物种.

图2 甘油在Cu/TiO2光催化剂上的可能反应途径[15]Fig.2 Reaction pathways in the photoreforming of glycerol over Cu/TiO2[15]
1.3 光催化重整糖类制H2
葡萄糖及多糖可经过纤维素材料降解得到,是太阳能重整生物质制氢中具有较大应用前景的原料.近年来,越来越多的学者关注于光催化重整糖类制氢的研究[17-23].上世纪80年代,日本科学家KAWAI等提出可以采用光催化的方法,以Pt和RuO2共担载的TiO2作为光催化剂,从多种生物质分子(如:氨基酸、蛋白质及海藻等)的水溶液中制备氢气[24].此后,该课题组对光催化重整糖类制氢气的反应进行了比较深入的研究[25],发现食糖、可溶性淀粉,甚至撕碎的滤纸(主要成分是纤维素)都可以在光催化条件下产氢.
近年来,光催化重整生物质制氢的研究依然很热.LUO等采用N、B共掺杂的TiO2对甘油、葡萄糖、蔗糖等一系列碳水化合物进行了光催化产氢研究[26].他们认为,这种光催化重整生物质制氢的方法是光催化可持续发展的重要途径.
1.4 光催化重整生物质制H2的机理
随着光催化重整生物质制氢体系的发展,对光催化重整生物质制氢机理的研究也不断深入.李灿课题组利用原位红外光谱法检测光催化甲醇重整反应过程,发现在TiO2表面上生成了CH2O,CH2OO和HCOO等物种,证明了甲醇的产氢反应是逐步脱氢氧化的过程[27].在实际反应体系中通常采用水作为溶剂,并且较多的研究者使用电子自旋共振(EPR)技术在光催化分解水的过程中观察到了·OH的存在.他们认为在多数的光催化过程中·OH都是主要的活性物种[28-29],而上述的甲醇的产氢反应则是间接氧化机理.
WANG利用一种非线性光谱技术(SFG)原位研究甲醇和水的竞争吸附,认为氧化产氢的途径取决于TiO2催化剂表面吸附物种的种类[30].当水是主要吸附物种,TiO2表面吸附的水和甲醇的物质的量之比大于300时,·OH间接氧化甲醇;而当水和甲醇的物质的量之比小于300时,表面的空穴直接氧化甲醇.在水溶液中,催化剂表面的主要吸附物种是水,所以在水溶液中发生的光催化反应是·OH间接氧化机理.
CHIARELLO等在贵金属担载的TiO2上研究了气-固相光催化重整甲醇制氢反应,他们认为甲醇经过中间产物甲醛和甲酸最终被氧化为CO2.在反应过程中作者也检测到甲烷、一氧化碳、甲酸甲酯等多种副产物[5,31].之后,他们采用同位素标记实验对甲醇氧化的反应动力学行为进行了研究,认为甲醇有三种平行的反应途径(图3):1)·OH间接氧化途径,即光生空穴与吸附在表面上的H2O反应生成·OH,然后由·OH氧化甲醇分子;2)直接氧化途径,即吸附在TiO2与贵金属界面上的甲醇被TiO2价带空穴直接氧化;3)H2O参与的直接反应途径,即远离TiO2/金属界面的甲醇分子被价带空穴氧化的途径,其中H2O起到了为甲醛转化提供氧源和向贵金属转移质子扩散媒介的作用.

YANG等采用担载Pd、Pt或Rh的TiO2进行乙醇重整反应,发现担载Pd、Pt的TiO2的产氢活性高于担载Rh的[32].通过透射电子显微镜(TEM)和X射线光电子能谱(XPS)表征发现,担载Rh活性低的主要原因是由其在TiO2表面的量少和分散性差造成的.他们认为在反应过程中乙醇分子吸附在催化剂表面,并在金属和TiO2的界面发生解离生成乙氧基和羟基(图4).在光照条件下,羟基中的质子接受Pt上的光生电子发生还原反应生成H2,同时吸附在TiO2表面的乙氧基被空穴氧化生成乙醛.
JOHN等较早的提出了光催化重整葡萄糖制氢机理[33].他们认为,葡萄糖的末端醛基或羟基首先会被光生空穴氧化生成羧基和质子,之后羧基通过photo-Kolbe反应发生脱羧放出CO2,而反应中生成的H+被光生电子还原生成氢气.FU等使用Pd、Pt、Au、Rh、Ag、Ru担载的TiO2为催化剂,系统研究了反应气氛、助催化剂担载量、反应液浓度、体系pH等对葡萄糖水溶液体系产氢的影响[34].基于以上研究,他们对葡萄糖光催化制氢提出的可能的反应途径如图5所示.首先,葡萄糖上的羟基和TiO2表面上不饱和的TiIV配位,解离生成H+和醇盐(RCH2O-),RCH2O-捕获光生空穴形成氧化产物RCH2O·(process a);然后RCH2O·进攻另一分子葡萄糖(R'CH2OH),将电子转移给该分子形成R'C·HOH自由基,R'C·HOH再经历process a形成醛和羧酸(process b),接着继续反应生成CO2(process c).由此可见,光催化重整葡萄糖制氢的反应机理非常复杂,这使得对反应过程的研究存在很大的挑战性.
2 光催化氧化生物质制备化学品
2.1 光催化选择性氧化生物质制备化学品
将廉价的生物质分子转化为高品质的化学品在工业上具有极其重要的应用价值.传统的催化氧化反应通常采用O2、铬酸盐和高锰酸钾等作为氧化剂,以氯代有机物作为溶剂,并且需要较高的反应温度和压力,导致反应能耗高、污染环境等问题[35-37].相比而言,光催化氧化反应在常温常压下就能发生,反应途径更温和清洁.近年来光催化氧化生物质的研究也受到很多学者的关注[1].

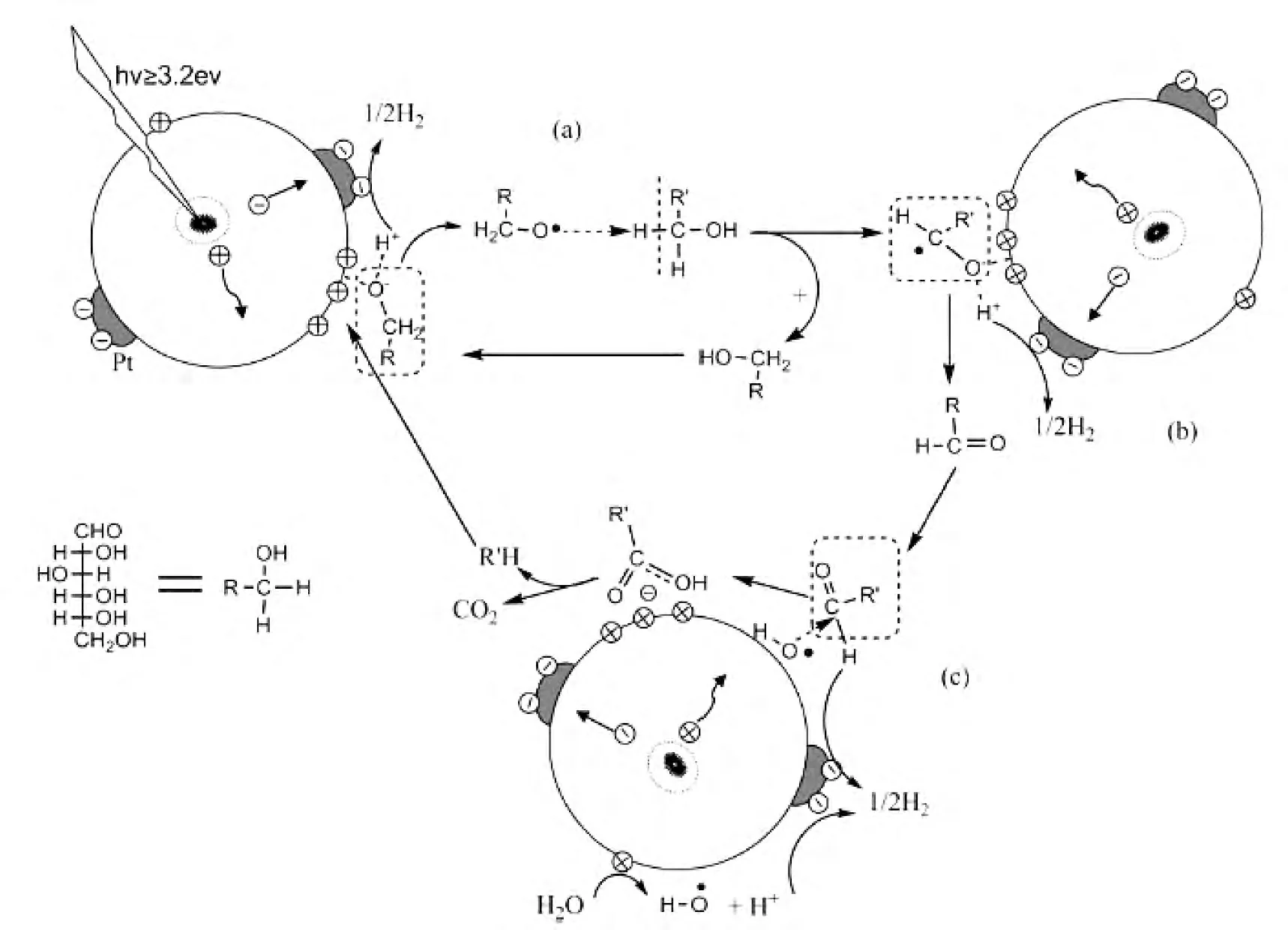
图5 Pt/TiO2光催化重整葡萄糖的可能反应途径[34]Fig.5 Proposed mechanism of the photocatalytic reforming of glucose on Pt/TiO2[34]
MOLINARI等利用TiO2(Degussa P25)为光催化剂,乙腈为溶剂,研究了伯醇的选择性氧化[38].发现香叶醇可以选择性的转化为醛,收率为70%.当反应体系中加入少量水时,醛的收率会显著降低.作者通过EPR技术检测到光照条件下水在P25表面上被氧化生成了·OH.进一步分析认为反应选择性降低的原因有二,一方面是水抑制了底物的吸附;另一方面是生成的·OH加速了产物的后续反应.KOMINAMI等采用流动相反应,以高比表面积的TiO2作为光催化剂,在室温下将甲醇转化为甲酸甲酯,选择性高达91%[39].流动相反应可以在很大程度上避免产物的氧化,但对于不挥发性的碳水化合物,液相反应则更为适合.AUGUGLIARO等采用具有不同相结构、形貌和结晶度的TiO2将甘油部分转化为1,3-二羟基丙酮、甘油醛、甲酸和CO[40].作者发现,当采用P25作为催化剂时效果最佳,但在35%的转化率时液相产物的最高选择性仅为35.2%.作者认为产物的选择性较差主要是由于在多相催化剂表面存在多种反应的活性位,不利于生成单一产物.
COLMENARES等在光催化选择性氧化葡萄糖方面做了大量研究.该课题组采用不同的TiO2作为催化剂,发现葡萄糖可以转化为葡萄糖二酸和葡萄糖酸,这两种羧酸是农业和食品加工中的重要原料[41].作者还发现产物的选择性受到催化剂、光照时间以及溶剂的影响.在乙腈和水的混合溶剂中(体积比=1∶1),葡萄糖转化率为11%时产物总选择性为71.3%;而使用水作为溶剂,其液相产物的选择性为0.为了提高反应产物的选择性,该课题组进行了催化剂的设计,采用超声辅助溶胶-凝胶法制备了高硅Y型分子筛负载的TiO2样品.当采用乙腈和水的混合溶剂(体积比=1∶1),反应时间为10 min,葡萄糖转化率为15.5%时,产物的总选择性达到68.1%;而以水为溶剂时,其产物总选择性仍为0[42].之后,作者采用Fe或Cr掺杂的TiO2进行光催化葡萄糖选择性氧化反应,发现同样在乙腈和水的混合溶剂中(体积比=1∶1),以Fe/TiO2为催化剂,反应20min后,转化率为7.2%,产物总选择性为94%;以Cr/TiO2为催化剂时,在葡萄糖转化率为8%时,产物总选择性为99.7%[43-44].然而,作者发现产物的选择性随反应时间的延长快速下降,即在较高的转化率下产物的选择性较差.同样地,以水作为溶剂时其选择性均为零.由此可见,在光催化氧化葡萄糖反应中,反应介质对产物选择性起着主要的作用.在乙腈体系中加入一定量的水,有利于产物从催化剂表面脱附,但是水的加入产生羟基自由基,又能加快产物的分解[38,45-46].
目前的研究结果表明,光催化选择性氧化生物质所得产物的选择性还比较低,本文作者认为这主要是由于反应中采用O2作为电子受体,而O2捕获光生电子后生成的O2·—参与生成的有机自由基物种的矿化反应,导致有机物深度氧化.同时,H2O作为溶剂将产生·OH,导致产物深度氧化.因此,在生物质转化过程中产物的选择性较低.
2.2 光催化选择性氧化的机理
MINERO等 通 过 对 比Evonik P25和Merck TiO2的光催化氧化甘油反应推测了反应机理(图6)[47].当以Evonik P25为催化剂时,在较低转化率下,甘油先转化成甘油醛和二羟基丙酮,然后生成甲醛和乙醇醛,由此作者推测Evonik P25上甘油的氧化是一个直接电子转移过程.有趣的是,当以Merck TiO2为催化剂时,生成的主要产物是甘油醛和二羟基丙酮,作者认为在Merck TiO2上的甘油氧化反应是自由基反应历程.由此可见,TiO2表面性质的差异有可能导致甘油氧化反应经历不同的途径.
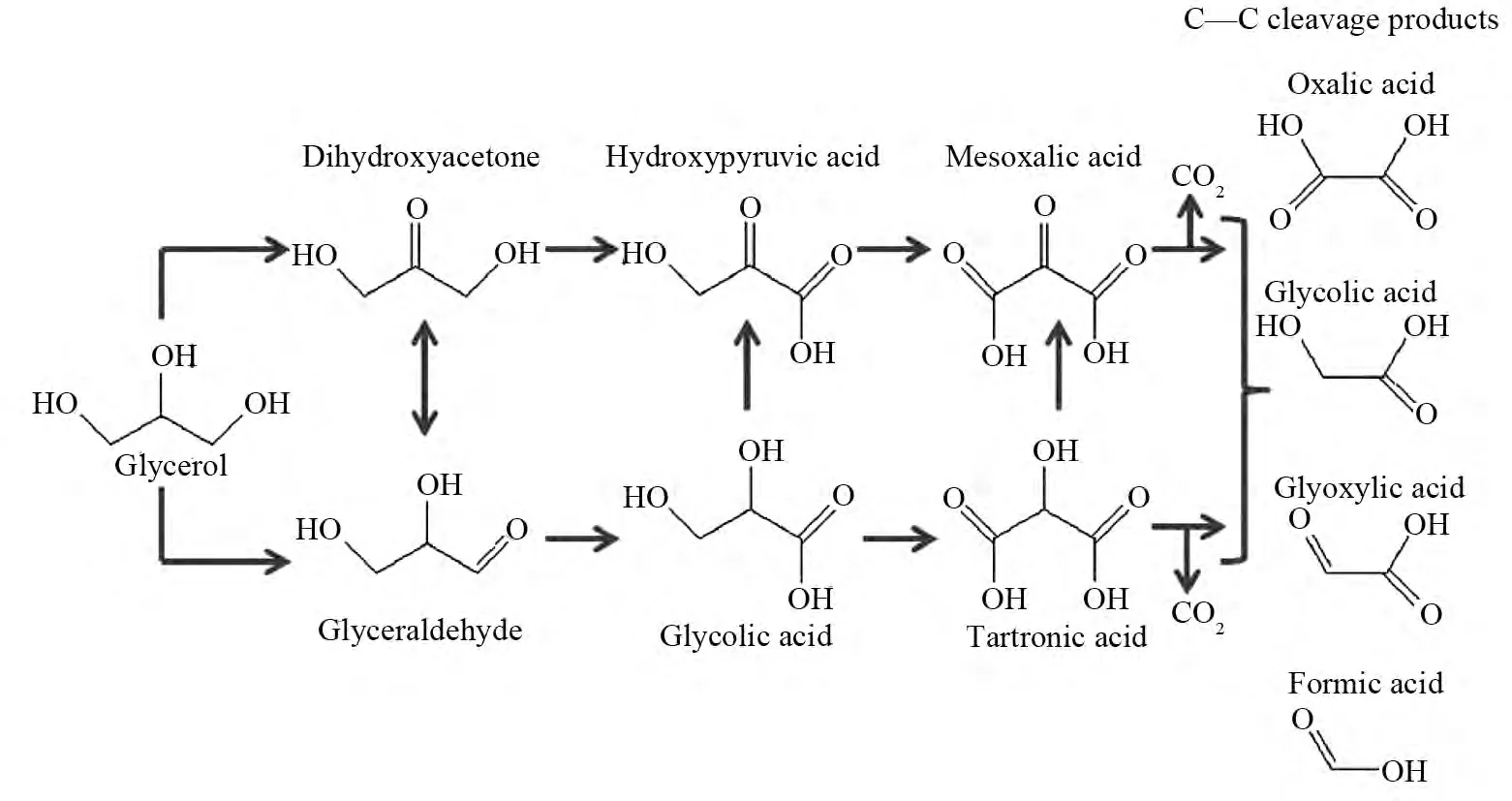
图6 基于TiO2的甘油光催化氧化反应途径[47]Fig.6 Photocatalytic oxidation of glycerol on TiO2[47]
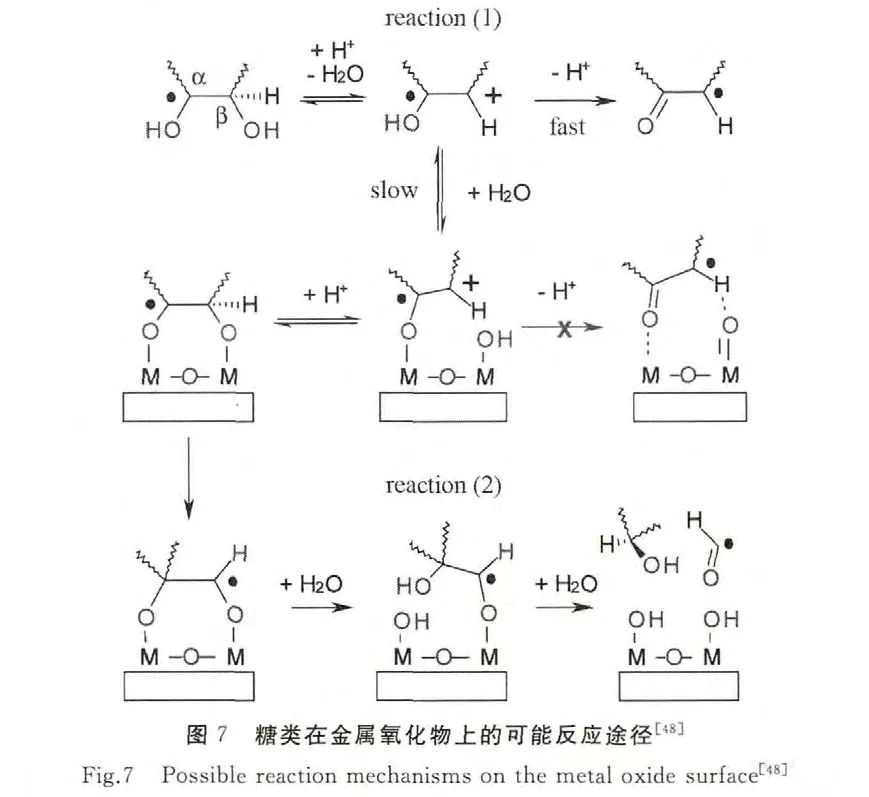
SHKROB等通过理论计算研究了糖(单糖和多元醇等)与半导体表面在光催化氧化过程中的相互作用机制[48].如图7所示,通过计算作者发现了碳水化合物与金属氧化物表面(如TiO2、α-FeOOH和α-Fe2O3)的相互作用,形成桥氧键.在光照下,碳水化合物中参与形成桥氧的位置被氧化,经过重排后去掉甲酸自由基.对于天然的碳水化合物来说,理论计算的结果认为上述反应过程主要发生在C1位置,而EPR的实验结果表明该反应在C1、C2、和C3位置均有发生.同时作者提出,光激发的TiO2可以氧化所有碳水化合物和多元醇,α-FeOOH可以氧化部分碳水化合物,而α-Fe2O3没有光催化活性.
3 光催化生物质转化制备H2和化学品
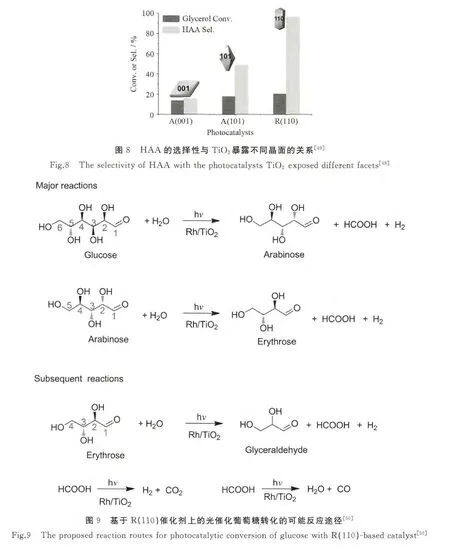
基于以上研究,为了提高生物质的利用效率,李灿课题组在无氧条件下,以担载不同贵金属的TiO2为催化剂,通过光催化的方法均能实现生物质转化为H2和化学品[49-50].该课题组通过对催化剂设计以及反应过程中的活性氧物种的分析,探讨了影响产物选择性的因素.以担载Rh的TiO2为催化剂、水为溶剂,在光照条件下,甘油通过C-C键断裂方式转化为羟基乙醛(HAA),同时释放出H2和甲酸[49].作者通过调变TiO2暴露的晶面,发现产物HAA的选择性受TiO2暴露晶面的影响.如图8所示,金红石高比例暴露(101)晶面(R(110))时,产物HAA选择性高达90%以上,而锐钛矿TiO2暴露(001)晶面(A(001))时HAA的选择性仅为16%,锐钛矿暴露(110)晶面(A(101))时HAA的选择性为48%.进一步的电子顺磁共振分析和理论计算结果表明,H2O在金红石相TiO2(110)晶面活化生成氧化能力温和的过氧物种TiOO·,而锐钛矿相TiO2暴露(001)和(101)晶面产生无选择性活性氧物种·OH.作者认为TiO2的表面结构及活性氧物种的差异是造成产物HAA选择性差异的主要原因.
将研究拓展到分子结构更为复杂的葡萄糖,作者发现,在光照条件下,用水作溶剂,葡萄糖在TiO2上通过C1―C2断裂方式(α-scission)转化为阿拉伯糖、赤藓糖,同时生成H2和甲酸[50].在金红石相TiO2高比例暴露(110)晶面(R(110))的催化剂上,葡萄糖转化率达65%时,阿拉伯糖和赤藓糖的总选择性仍能保持在90%以上.通过对所有产物进行计算发现葡萄糖和水的反应是以化学计量比进行的.在该反应中H2O被TiO2的光生空穴活化后,生成的活性氧物种是该反应中的氧化剂.可能的反应途15径如图9所示.活性氧物种进攻葡萄糖分子,经C1―C2键断裂脱掉一分子氢气生成阿拉伯糖和甲酸;随着阿拉伯糖生成量的增加,阿拉伯糖与葡萄糖分子之间发生竞争反应,阿拉伯糖被活性氧物种氧化,经C1―C2键断裂生成赤藓糖和甲酸,脱掉一分子氢气.类似地,生成的赤藓糖也会被氧物种缓慢氧化生成甘油醛、甲酸和氢气.而甲酸最终在催化剂表面分解为CO和水或者生成CO2和H2.通过向反应体系中加入H2O2(用于生成·OH),作者进一步证实了活性氧物种是影响产物选择性的主要因素.对比实验表明,加入H2O2后阿拉伯糖的选择性为21.1%,远远低于不加双氧水体系74.7%的选择性,说明·OH对产物也具有较强的分解能力,导致产物选择性下降.通过与阿拉伯糖、赤藓糖以及多元醇在金红石暴露(110)晶面上光催化反应过程的比较,发现C1―C2断裂是醛糖在TiO2上光催化转化的特有性质.
4 光催化生物质转化研究中的不足与展望
近年来,利用半导体光催化转化生物质不论是在制氢气还是在制化学品方面都取得了较大进展,展现了巨大的应用潜力.但是,采用光催化的方法转化生物质仍然存在很多问题,如在光催化重整生物质制氢体系中生物质在反应中会生成大量的中间体,导致不能完全转化为H2和CO2,进而降低了生物质能的利用效率;在光催化转化生物质制备化学品体系中通常采用O2作为电子受体,生成具有较强氧化能力的O2·—,而O2·—主要参与有机物种的矿化反应,导致化学品的产率降低和选择性变差;在光催化生物质转化的研究中还没有找到合适的手段,从根本上控制后续反应的进行,使得体系产物复杂、选择性差.从生物质分子本身来看,目前的研究仍集中在甲醇、乙醇、甘油、葡萄糖等小分子上,关于大分子生物质(如淀粉、木质素、纤维素等)的研究还比较少.
通过选择合适的半导体,调变半导体价带位置和氧化助催化剂构建复合催化剂体系,进而调变光催化剂的氧化能力达到控制生物质的反应途径,则可以实现生物质完全转化或高选择性的目的.光催化直接转化纤维素和木质素仍是一个难题,若能在反应中产生大量活性氧物种将纤维素(或木质素)和半导体催化剂间的固—固反应转变为液—固反应,则能提高反应速率.光催化反应体系活性氧物种的种类对生物质反应过程有决定性影响,通过设计合适的催化剂结构有目的地控制活性氧物种的种类,则可以实现产物的高选择性.
总之,光催化生物质转化制氢气和化学品是一个极具挑战性的研究课题.随着光催化生物质转化体系研究的不断深入,生物质在光催化反应过程中的转化机理逐步明晰,使得我们能够有目的地设计新的催化反应体系,进一步提高生物质能和太阳能的利用效率.光催化生物质转化制氢气和化学品必将在新能源体系的构建中占据重要地位.
[1]COLMENARES J C,LUQUE R.Heterogeneous photocatalytic nanomaterials:prospects and challenges in selective transformations of biomass-derived compounds[J].Chem Soc Rev,2014,43(3):765-778.
[2]CARGNELLO M,GASPAROTTO A,GOMBAC V,et al.Photocatalytic H2and added-value by-products-the role of metal oxide systems in their synthesis from oxygenates[J].Eur J Inorg Chem,2011,2011(28):4309-4323.
[3]KAWAI T,SAKATA T.Photocatalytic hydrogen production from liquid methanol and water[J].J Chem Soc,Chem Commun,1980:694-695.
[4]WU G P,CHEN T,SU W G,et al.H2production with ultra-low CO selectivity via photocatalytic reforming of methanol on Au/TiO2catalyst[J].Int J Hydrogen Energy,2008,33(4):1243-1251.
[5]CHIARELLO G L,AGUIRRE M H,SELLI E.Hydrogen production by photocatalytic steam reforming of methanol on noble metal-modified TiO2[J].J Catal,2010,273(2):182-190.
[6]WU Y Q,LU G X,LI S B.The role of Cu(I)species for photocatalytic hydrogen generation over CuOx/TiO2[J].Catal Lett,2009,133(1/2):97-105.
[7]STRATAKI N,BEKIARI V,KONDARIDES D I,et al.Hydrogen production by photocatalytic alcohol reforming employing highly efficient nanocrystalline titania films[J].Appl Catal B:Environ,2007,77(1/2):184-189.
[8]ZHANG J,XU Q,FENG Z,et al.Importance of the relationship between surface phases and photocatalytic activity of TiO2[J].Angew Chem Int Ed,2008,47(9):1766-1769.
[9]MA Y,XU Q,ZONG X,et al.Photocatalytic H2production on Pt/TiO2-SO42-with tuned surface-phase structures:Enhancing activity and reducing CO formation[J].Energy Environ Sci,2012,5(4):6345-6351.
[10]XU Q,MA Y,ZHANG J,et al.Enhancing hydrogen production activity and suppressing CO formation from photocatalytic biomass reforming on Pt/TiO2by optimizing anatase-rutile phase structure[J].J Catal,2011,278(2):329-335.
[11]WANG Y,HSIEH M,LEE J,et al.Nonaqueous synthesis of CoOx-TiO2nanocomposites showing highphotocatalytic activity of hydrogen generation[J].Appl Catal B:Environ,2013,142/143:626-632.
[12]SIVASAMY A,CHEAH K Y,FORNASIERO P,et al.Catalytic applications in the production of biodiesel from vegetable oils[J].ChemSusChem,2009,2(4):278-300.
[13]KONDARIDES D I,DASKALAKI V M,PATSOURA A,et al.Hydrogen production by photo-induced reforming of biomass components and derivatives at ambient conditions[J].Catal Lett,2008,122(1/2):26-32.
[14]BOWKER M,DAVIES P R,AL-MAZROAI L S.Photocatalytic reforming of glycerol over gold and palladium as an alternative fuel source[J].Catal Lett,2009,128(3/4):253-255.
[15]GOMBAC V,SORDELLI L,MONTINI T,et al.CuOx-TiO2photocatalysts for H2production from ethanol and glycerol solutions[J].J Phys Chem A,2010,114(11):3916-3925.
[16]MONTINI T,GOMBAC V,SORDELLI L,et al.Nanostructured Cu/TiO2photocatalysts for H2production from ethanol and glycerol aqueous solutions[J].ChemCatChem,2011,3:574-577.
[17]FU X,WANG X,LEUNG D Y C,et al.Photocatalytic reforming of glucose over La doped alkali tantalate photocatalysts for H2production[J].Catal Commun,2010,12(3):184-187.
[18]JING D,LIU M,SHI J,et al.Hydrogen production under visible light by photocatalytic reforming of glucose over an oxide solid solution photocatalyst[J].Catal Commun,2010,12(4):264-267.
[19]LI Y,GAO D,PENG S,et al.Photocatalytic hydrogen evolution over Pt/Cd0.5Zn0.5S from saltwater using glucose as electron donor:An investigation of the influ-ence of electrolyte NaCl[J].Int J Hydrogen Energy,2011,36(7):4291-4297.
[20]LI Y,WANG J,PENG S,et al.Photocatalytic hydrogen generation in the presence of glucose over ZnS-coated ZnIn2S4under visible light irradiation[J].Int J Hydrogen Energy,2010,35(13):7116-7126.
[21]MOHAMED R M,AAZAM S E.H2Production with low CO selectivity from photocatalytic reforming of glucose on Ni/TiO2-SiO2[J].Chin J Catal,2012,33(2):247-253.
[22]WU G P,CHEN T,ZHOU G H,et al.H2production with low CO selectivity from photocatalytic reforming of glucose on metal TiO2catalysts[J].Sci China Ser B,2008,51(2):97-100.
[23]LI M,LI Y,PENG S,et al.Photocatalytic hydrogen generation using glycerol wastewater over Pt/TiO2[J].Front Chem China,2009,4(1):32-38.
[24]KAWAI T,SAKATA T.Photocatalytic hydrogen production from water by the decomposition of polyvinychloride,protein,algae,dead insects and excrement[J].Chem Lett,1981:91-94.
[25]KAWAI T,SAKATA T.Conversion of carbohydrate into hydrogen fuel by aphotocatalytic process[J].Nature,1980,286(5772):474-476.
[26]LUO N,JIANG Z,SHI H,et al.Photo-catalytic conversion of oxygenated hydrocarbons to hydrogen over heteroatom-doped TiO2catalysts[J].Int J Hydrogen Energy,2009,34(1):125-129.
[27]CHEN T,FENG Z C,WU G P,et al.Mechanistic studies of photocatalytic reaction of methanol for hydrogen production on Pt/TiO2by in situ Fourier transform IR and time-resolved IR spectroscopy[J].J Phys Chem C,2007,111(22):8005-8014.
[28]JAEGER C D,BARD A J.Spin trapping and electron spin resonance detection of radical intermediates in the photodecomposition of water at titanium dioxide particulate systems[J].J Phys Chem,1979,83:3146-3152.
[29]HARBOUR J R,HAIR M L.Transient radicals in heterogeneous systems:Detection by spin trapping[J].Adv Colloid Interface Sci,1985,24(1):103-141.
[30]WANG C,GROENZIN H,SHULTZ M J.Direct observation of competitive adsorption between methanol and water on TiO2:An in situ sum-frequency generation study[J].J Am Chem Soc,2004,126(26):8094-8095.
[31]CHIARELLO L,FERRI D,SELLI E.Effect of the
CH3OH/H2O ratio on the mechanism of the gas-phase photocatalytic reforming of methanol on noble metalmodified TiO2[J].J Catal,2011,280(2):168-177.
[32]YANG Y Z,CHANG C H,IDRISS H.Photo-catalytic production of hydrogen form ethanol over M/TiO2catalysts(M=Pd,Pt or Rh)[J].Appl Catal B:Environ,2006,67:217-222.
[33]JOHN M R S,FURGALA A J,SAMMELLS A F.Hydrogen generatlon by photocatalytic oxidation of glucose by platinized n-TiO2powder[J].J Phys Chem,1983,87(5):801-805.
[34]FU X L,LONG J L,WANG X X,et al.Photocatalytic reforming of biomass:a systematic study of hydrogen evolution from glucose solution[J].Int J Hydrogen Energy,2008,33(22):6484-6491.
[35]COLLINSON S R,THIELEMANS W.The catalytic oxidation of biomass to new materials focusing on starch,cellulose and lignin[J].Coordin Chem Rev,2010,254(15/16):1854-1870.
[36]CHHEDA J,HUBER G,DUMESIC J.Liquid-phase catalytic processing of biomass-derived oxygenated hydrocarbons to fuels and chemicals[J].Angew Chem Int Ed,2007,46(38):7164-7183.
[37]HUGHES M D,XU Y J,JENKINS P,et al.Tunable gold catalysts for selective hydrocarbon oxidation under mild conditions[J].Nature,2005,437(7062):1132-1135.
[38]MOLINARI A,MONTONCELLO M,REZALAB H,et al.Partial oxidation of allylic and primary alcohols with O2by photoexcited TiO2[J].Photochem Photobiol Sci,2009,8(5):613-619.
[39]KOMINAMI H,SUGAHARA H,HASHIMOTO K.Photocatalytic selective oxidation of methanol to methyl formate in gas phase over titanium(IV)oxide in a flowtype reactor[J].Catal Commun,2010,11(5):426-429.
[40]AUGUGLIARO V,NAZER H A H E,LODDO V,et al.Partial photocatalytic oxidation of glycerol in TiO2water suspensions[J].Catal Today,2010,151(1/2):21-28.
[41]COLMENARES J C,MAGDZIARZ A,BIELEJEWSKA A.High-value chemicals obtained from selective photo-oxidation of glucose in the presence of nanostructured titanium photocatalysts[J].Bioresour Technol,2011,102(24):11254-11257.
[42]COLMENARES J C,MAGDZIARZ A.Room temperature versatile conversion of biomass-derived compounds by means of supported TiO2photocatalysts[J].J Mol Catal A:Chem,2013,366(1):156-162.
[43]COLMENARES J C,MAGDZIARZ A,CHERNYAYEVA O,et al.Sonication-assisted low-temperature routes for the synthesis of supported Fe-TiO2econano-materials:Partial photooxidation of glucose and phenol aqueous degradation[J].ChemCatChem,2013,5(8):2270-2277.
[44]COLMENARES J C,MAGDZIARZ A,KURZYDLOWSKI K,et al.Low-temperature ultrasound-promoted synthesis of Cr-TiO2-supported photocatalysts for valorization of glucose and phenol degradation from liquid phase[J].Appl Catal B:Environ,2013,134/135:136-144.
[45]SHIRAISHI Y,MORISHITA M,HIRAI T.Acetonitrile-assisted highly selective photocatalytic epoxidation of olefins on Ti-containing silica with molecular oxygen[J].Chem Commun,2005(48):5977-5979.
[46]MORISHITA M,SHIRAISHI Y,HIRAI T.Ti-containing mesoporous organosilica as a photocatalyst for selective olefin epoxidation[J].J Phys Chem B,2006,110(36):17898-17905.
[47]MINERO C,BEDINI A,MAURINO V.Glycerol as a probe molecule to uncover oxidation mechanism in photocatalysis[J].Appl Catal B:Environ,2012,128:135-143.
[48]SHKROB I A,MARIN T W,CHEMERISOV S D,et al.Mechanistic aspects of photooxidation of polyhydroxylated molecules on metal oxides[J].J Phys Chem C,2011,115(11):4642-4648.
[49]CHONG R F,LI J,ZHOU X,et al.Selective photocatalytic conversion of glycerol to hydroxyacetaldehyde in aqueous solution on facet tuned TiO2-based catalysts[J].Chem Commun,2014,50(2):165-167.
[50]CHONG R F,LI J,MA Y,et al.Selective conversion of aqueous glucose to value-added sugar aldose on TiO2-based photocatalysts[J].J Catal,2014,314:101-108.

