外科肿瘤细胞减灭术联合腹腔内热灌注化疗——结直肠癌腹膜转移治疗的突破方向?
孙立峰 童舟 丁克峰
一、关于结直肠癌腹膜转移
结直肠癌治疗失败的一个主要的原因是发生了转移,其中腹膜转移患者约占全部结直肠癌人群的40%左右[1]。结直肠癌发生腹膜转移后,以往被认为是全身性疾病,或者说是终末期疾病,姑息性的全身性化疗是常规的推荐治疗手段,在多中心EVOCAPE研究中,5-FU联合CF的化疗使结直肠癌腹膜转移的患者生存时间不超过7个月;而再联合奥沙利铂或伊立替康的化疗,也只能达到23.4个月的生存时间[2]。然而从上世纪80年代以来,在腹膜转移的结直肠癌患者中引入了细胞减灭术(cytoreductive surgery,CRS)联合腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)的治疗模式,给这部分患者带来了治愈的可能和明显的生存获益,总生存时间平均可达到46个月,5年生存时间(OS)可达51%[3]。如此好的治疗效果是否可能颠覆结直肠癌腹膜转移的治疗理念?是否可能类同于多年之前人们在结直肠癌肝转移治疗理念中的突破性探索?
二、结直肠癌腹膜转移的可能机制和临床表现
结直肠癌腹膜转移可能包含五个步骤:(1)肿瘤细胞从原发灶脱落进入腹膜腔:这个过程可以自发发生,也可以通过医源性播散发生。(2)脱落细胞在腹膜腔里转运:脱落的肿瘤细胞在重力作用、胃肠道的蠕动以及膈肌运动造成负压的作用下,分布到腹腔各个部位。其中最常见的部位为右下腹部、右膈肌、肝十二指肠韧带、大网膜、盆腔脏器以及壁腹膜等。(3)肿瘤细胞的腹膜粘附:目前的证据显示,在这个过程中,炎症通过增强粘附分子的表达起着重要的作用。(4)腹膜间皮下层组织的侵入。间皮下层的侵袭伴随着细胞外基质的粘附和降解的过程。(5)肿瘤细胞进入体循环:肿瘤细胞一旦侵入间皮下基质,就有可能进入血管和淋巴管的微循环,包含肿瘤细胞的微粒可通过位于膈肌肌纤维间的淋巴陷窝(lymphatic lacunae)进入体循环,另外,Douglas窝的腹膜下也富含淋巴管和奶斑(milky spots)。
结直肠癌腹膜转移的临床症状多样并且无特异性。有些患者因为腹水和肠梗阻而表现出极度疲劳,腹部不适和腹痛等症状。腹水的细胞学检查可以诊断大约50%的腹膜转移的患者;大约40%的患者可以通过 CT、MRI、PET和超声而被诊断;还有8%的患者是在开腹手术中被发现。腹膜种植转移好发于女性,原发肿瘤为粘液腺癌、T4、N2和阳性切缘的患者,平均复发时间14~16个月[4]。
三、结直肠癌腹膜转移的治疗
(一)全身化疗
腹膜转移的结直肠癌以往被认为是全身性疾病,或者说是终末期疾病。姑息性的系统性化疗是常规的推荐治疗手段,北方中心癌症治疗组(North Central Cancer Treatment Group,NCCTG)的Ⅲ期临床试验N9741和N9841的荟萃分析显示,以5-FU为基础的全身化疗,FOLFOX等方案不能显著改善结直肠癌腹膜转移的生存时间。对于联合生物制剂如Bevacizumab、Cetuximab或Panitumumab的化疗方案能否延长生存时间仍旧不清楚,因为这样的研究数据很少。
(二)腹膜腔内化疗
结肠癌动物模型显示,腹膜腔内给予化疗药物(Intraperitoneal chemotherapy)成功地预防了结肠癌的腹膜转移。但是,临床研究却显示腹腔内辅助的化疗药物不能带来任何的获益。Vaillant等把267例Ⅱ和Ⅲ期病人随机分为两组,一组仅手术治疗,另一组手术联合术中静脉5-FU治疗及术后腹腔内5-FU治疗;结果显示患者的DFS和OS不能从5-FU治疗中获益,5-FU也不能降低腹膜转移的发生率[4]。
(三)术后早期腹膜腔内化疗
术后早期腹膜腔内化疗(Early postoperative intraperitoneal chemotherapy,EPIC)是肿瘤细胞减灭术(CRS)后早期把化疗药物灌注入腹膜腔,可以进行化疗药物的循环和/或1-5天内放出化疗药物,目的是杀灭腹腔内残留的微小或游离的肿瘤细胞。EPIC可以在术后数月内重复多次进行。Mahteme比较了CRS、EPIC(5-FU、cisplatin或irinotecan)联合5-FU为基础的化疗与单独全身化疗对结直肠癌腹膜转移的疗效,结果发现CRS组患者的平均生存时间32个月,2年和5年生存率分别是60%和28%;而单独化疗组的平均生存时间14个月,2年和5年生存率分别是 10% 和 5%(P=0.01,vs CRS group)。Glehen也分析了28个国际中心登记的506例结直肠癌腹膜转移并经CRS+EPIC治疗的患者,平均随访53个月后,发现这些患者平均随生存时间19个月,1、3、和5年生存率分别为72%,39%和19%;根治切除术后(CCR-0)的271位患者平均生存时间32个月,1、3、和5年生存率分别为87%,47%和31%[4];但是,不同中心的CRS操作步骤和化疗方案的不同影响了这项研究结果的可靠性。
(四)腹膜转移癌的细胞减灭术和腹腔内热灌注化疗
现在证实了腹膜转移癌的细胞减灭术(CRS)联合腹腔内热灌注化疗(HIPEC)是延长结直肠癌腹膜转移患者生存时间最有效的方法。
1.术前评估及患者选择:在制定CRS和HIPEC治疗方案之前,进行患者选择非常关键。肿瘤细胞减灭术(CRS)的目的是为了消除腹腔内的所有病灶。因此治疗前的诊断应尽可能提供关于肿瘤位置、肿瘤大小、病灶分布扩散的范围的可靠信息,以评估切除的可能性。2006年米兰会议中,制定了一份共识,指出:一旦患者确诊为具有腹膜累及的结直肠癌,完整检查应包括全面的结肠镜检查、口服或静脉注射最大剂量对比剂的胸部、腹部和盆腔增强CT扫描以评估腹膜的扩散范围。若有其他腹部病灶可能,可考虑行PET检查[5]。但是术中分期仍是最可靠的评估办法。现在用于评估腹腔内肿瘤负荷的可量化的评分系统主要是Sugarbaker腹膜转移癌指数(Sugarbaker peritoneal carcinomatosis index,PCI)[6],如下图。
Sugarbaker PCI评分是应用最广泛的腹腔转移癌评价系统,它将腹部分为9个区域,将小肠进一步分为4个区域。每一个区域按肿瘤大小评分为0-3分,最大可能分值39分,最小分值可能分值0分。Sugarbaker的研究表明,PCI评分20分以下的患者,若应用CRS和HIPEC术,相对于姑息性化疗和支持治疗的患者,预后明显提高[7]。

图1 Sugarbaker腹膜转移癌指数(PCI)示意图
除了PCI指数,最近出现了另一个术前评估腹膜种植癌严重程度的评分指数叫“腹膜种植癌疾病严重程度评分(peritoneal surface disease severity score,PSDSS)[2]。这个评分,包括了 PCI指数和其他因素如临床症状和原发肿瘤的组织分级,共分4级(表1)。Grade III和IV期患者的预后不佳。
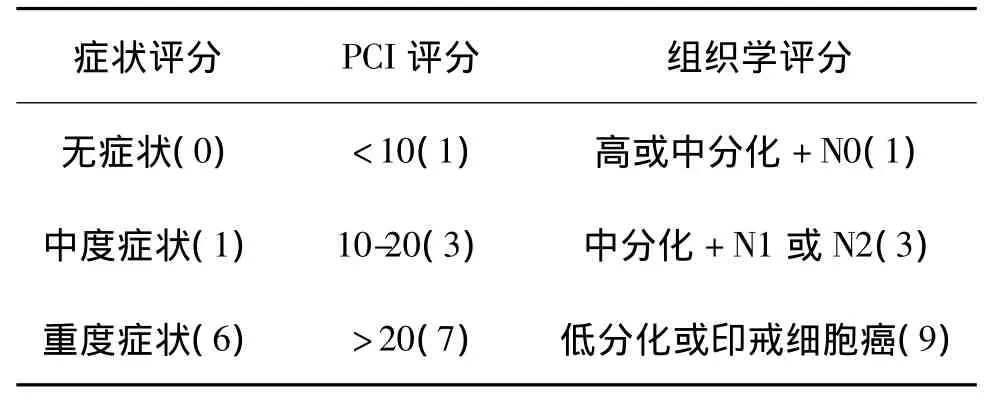
表1 腹膜种植癌疾病严重程度评分表
2.细胞减灭术(CRS):大量的研究结果表明对各种组织学类型的腹膜转移癌来说,CRS的完全性均为保证治疗疗效的关键。CRS的完全性以细胞减灭术完全性分级(completeness of cytoreduction,CC)进行评估。在众多的CC评分系统中,Jacquet和Sugarbaker的CC分级系统应用最为广泛(表2)。

表2 Sugarbaker的细胞减灭术完全性分级表
为保证所有可见病灶完全彻底的切除,并减少手术损伤降低术后并发症和死亡率,术中应系统的、按部就班的逐步推进,对整个腹腔进行检查以确保不遗漏病灶。Bao及Bartlett在2009年提出了的详尽的系统性CRS手术的方案建议:在开腹手术之前,首先进行腹腔镜探查以评估CC0切除的可能性。腹腔镜探查过程尽量在15min之内完成。若完全的细胞减灭术看似可行则中转开腹。开腹后再次评估腹腔内情况。对于可行CC0或CC1切除的患者继续手术,若最好的结果只能达到CC2以上切除,则结束手术。
3.腹腔内热灌注化疗(HIPEC):Dedrick等人发现亲水性肿瘤药物的腹膜渗透率要低于同一药物的血浆清除率。因此,若静脉给药,则因为腹膜部位的血流量较低,而肝脏和肾脏的药物清除率又较快,最终能够达到的腹膜内渗透浓度较低。相反的,若经腹膜内给药,特别是给予较高分子量(molecular weights,MW)的药物,则可达到较高的腹腔内浓度,并维持较长的时间。因此Jacquet和Sugarbaker在1996年提出了“腹膜-血浆屏障(peritoneal-plasma barrier)”的概念。进一步的研究指出,腹膜内的水分及小分子物质(MW<2000)通过渗透作用穿过壁层腹膜进入系统血液循环,而细胞及大分子物质吸收进入横膈、网膜及脏层腹膜的淋巴管道中,最终进入门脉系统并被肝脏清除。并且腹腔内药物的清除率与其分子量的平方根成反比。因此,通过腹膜腔内给予高分子量的、非脂溶性的化疗药物可形成腹腔内的高剂量浓度,而将全身毒性降到最低(表3)[8]。

表3 常见化疗药物IP及IV给药后曲线下面积的比值表
理想的化疗药物应有最大的效率,提供最大的区域治疗获益,同时最小化全身毒性。丝裂霉素C(MMC)是现今最常用的HIPEC的化疗药物。MMC分子量较高(334 KD),组织穿透能力强(可达5mm),且具有良好的药代动力学特性,可使其在有限的系统性吸收内达到较高的腹腔内浓度。除此之外,奥沙利铂、伊立替康、脂质体阿霉素、多西他赛及卡铂也是潜在的有效化疗药物。
许多学者认为加热在治疗过程中存在重要意义:(1)41℃以上的温度可产生直接的抗肿瘤效应。然而,肿瘤细胞也可通过上调热休克蛋白来增加热耐受度。(2)研究表明含有铂类的化疗药物、MMC及其它一些化疗药物在加热后细胞毒性效应上升。(3)在灌注过程中加热可增加药物的作用深度。但近年来一些研究对以上观点提出质疑,认为加热本身并无特殊获益或者只在与新辅助化疗相结合时才产生获益。因此热灌注化疗中加热的作用仍需进一步的临床试验证实。其次,许多学者认为基于以下2点原理,HIPEC在CRS术后立即进行,具有特殊的意义:(1)在新的肠粘连形成之前行腹腔内灌注化疗可最大限度的将腹膜表面暴露于化疗药物之中。(2)术后立即行腹腔内灌注化疗可延缓手术造成的腹腔内肿瘤细胞种植过程。最后,HIPEC应开腹还是关腹后进行现在仍存在争论,开腹技术支持者认为开腹有助于保持温度的一致性并有利于空间位置的扩散,而关腹技术的支持者认为关腹后增加的腹腔压力可增加化疗药物的组织穿透深度,并且关腹方式可减少手术团队对化疗药物的暴露风险。但直至今日仍无回顾性的研究来直接对比两种技术方式的效果。
鉴于各个癌症中心进行HIPEC的方法均有不同,为了临床研究、规范化治疗及医疗保险覆盖的需要,美国腹膜表面恶性肿瘤协会(the americansociety of peritoneal surface malignancies,ASPSM)于2013 年发表了一份专家共识,建议将腹膜扩散的结直肠癌患者的HIPEC治疗标准化。在综合分析专家意见之后,推出的标准化治疗建议(表4)。
4.细胞减灭术(CRS)和腹腔内热灌注化疗(HIPEC)的并发症、死亡率和生存获益:有关CRS/HIPEC的生存获益的报道主要来自于回顾性的研究,结果显示肿瘤细胞减灭的完全程度是 CRS/HIPEC生存获益的最大决定因素。所有比较研究显示结直肠癌腹膜转移在进行CC-0或CC-1级的肿瘤细胞减灭术(CRS)后,生存时间均超过2年以上,5年生存率(overall survival,OS)高达50%。最早也是最著名的随机对照研究结果由荷兰的Verwaal等人在2003年发表[9],结果显示中位生存时间在CRS/HIPEC组为22.3个月,而相应的标准治疗组为12.6个月;2008年原作者发表了8年随访的最新资料。结果表明CRS/HIPEC组患者的无进展生存时间(progression-free survival,PFS)为12.6个月,而对照组为7.7个月。中位疾病特异性生存率(disease-specific survival,DSS)CRS/HIPEC 组 为22.2个月,而对照组仅为12.6个月;R1切除CRS/HIPEC患者的5年生存率达到45%,未接受该治疗方式的患者中则不到10%。但是这个临床试验所采用的化疗方案中不包含 Irinotecan和/或Oxaliplatin,而限制其应用的价值。后来,Elias又开展了一项随机对照研究,在孤立或可切除的腹膜转移癌中,比较了含Oxaliplatin或Irinotecan的化疗方案与CRS/HIPEC的疗效。结果显示:单纯化疗组获得中位生存时间为24个月,而在CRS/HIPEC组中位生存时间为63月,5年OS达到51%。这是迄今报道的有关结直肠癌腹膜转移CRS/HIPEC的最好疗效。
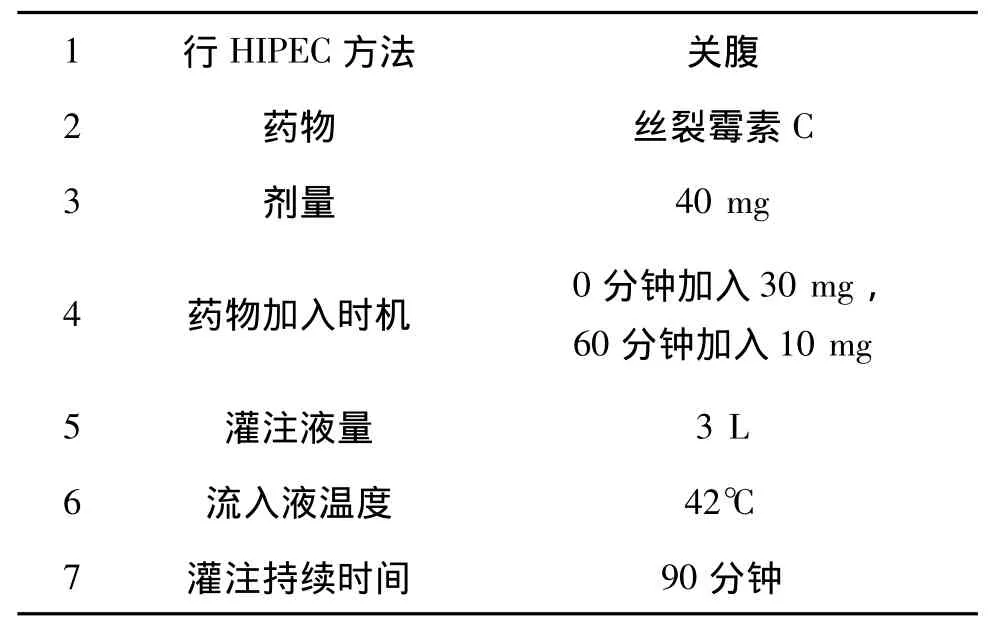
表4 ASPSM关于腹膜扩散的结直肠癌患者HIPEC治疗的标准化方案表
2013年荷兰的Verwaal等[10]统计了荷兰全国范围内的结直肠癌腹膜转移共660例患者,经CRS/HIPEC治疗后的预后,发现3年和5年生存率分别是46%和31%,而围手术期的死亡率为3%,III-IV级的并发症率为34%。另外,法国的一项非随机回顾性多中心的临床研究,报道了有CRS/HIPEC治疗的523例腹膜种植癌患者。有16%的患者是不完全的CRS(CCR-1),30天的围手术期死亡率也仅为3%,显著低于荷兰Verwaal的临床试验的8%;实行了CCR-0的患者获得了32.4个月的中位生存时间,明显高于非CCR-0的19个月。多变量分析显示,腹膜转移癌的生存还与肿瘤累及范围、是否应用其他治疗手段、年龄小于65岁和是否应用辅助化疗相关。
另外一方面,在CRS/HIPEC治疗模式开始应用的时候,确实存在着较高的并发症。但是,目前其并发症发生率已经和腹部外科其他大手术的并发症发生率基本相似。CRS/HIPEC的并发症主要与手术相关的包括吻合口瘘、腹腔感染或脓肿等;与HIPEC相关的包括血液学和肾毒性。研究显示,并发症发生与肿瘤累及范围,吻合口的数目,手术持续时间和不完全减瘤密切相关。浙江大学医学院附属二院大肠癌诊治中心自2014年4月起,已完成近60例腹膜转移癌和腹膜转移高风险结直肠癌的CRS+HIPEC,其中有21例是来源于结直肠癌,一例发生了轻度的吻合口瘘(保守治疗好转),这个患者进行了广泛的肿瘤切除,并有3个吻合口;两例患者出现了术后肠梗阻,经对症处理后好转。尽管HIPEC会带来一定的并发症,但有文献报道HIPEC术后3-6个月生活质量会有所改善。诸多文献都认为生活质量评分最低分通常出现在术后首次评估的时候,但生活质量也通常在6个月之后恢复到基线水平,当随访时间大于6个月时,生活质量反而超过基线水平,这表明从长远来看,HIPEC可改善生活质量[11-12]。有文献表明术后12个月后,74% ~94%的患者可以继续日常生活所需活动。Hill等认为虽然疼痛评分在术后3个月是超过基线水平的,经过术后6个月、12个月的随访,他们发现疼痛评分反而比术前还低[13]。我们对CRS+HIPEC治疗后的患者术前及出院时的生活质量进行了评估,结果发现出院时的患者的躯体功能、角色功能、口干和术前有显著差异,而其余指标无显著差异。说明CRS+HIPEC的治疗模式安全可靠。
四、目前对于结直肠癌腹膜转移的处理共识
尽管CRS/HIPEC术的应用已取得进展,肿瘤学家对于将其作为常规的结直肠癌腹膜转移的治疗方式仍然存在顾虑。2014年出版的NCCN结肠癌和直肠癌指南中,对于腹膜转移癌仍然建议采用姑息性治疗的方式,而不建议采用CRS/HIPEC治疗。与之相反,有些专家对HIPEC治疗方式态度非常积极,认为行HIPEC术对于预防结直肠癌腹膜种植转移也具有良好的前景。
所有的外科医师或肿瘤科医生在手术前、后或手术中发现了结直肠癌腹膜转移,特别是病变比较局限的年轻患者,都应该MDT讨论该患者有无治愈的可能。禁止没有术前充分评估病变范围的剖腹探查术。然而,在术中发现的腹膜种植转移,外科医师应该根据PCI评分描述腹膜转移的位置和范围,准确的评估可以避免对患者的不恰当的治疗。同样地,要避免无HIPEC的细胞减瘤术(CRS),因为单纯的细胞减瘤术可能引起肿瘤细胞的种植和手术并发症的增加,而没有生存获益。
2014年在荷兰阿姆斯特丹召开的第九届国际腹膜癌大会上,正式提出了肿瘤细胞减灭术加腹腔热灌注化疗的国际建议,将CRS/HIPEC治疗模式作为阑尾粘液癌,结直肠癌腹膜转移癌,恶性间皮瘤的标准治疗,并强调有必要继续严格设计前瞻性随机对照多中心研究,进一步明确疗效和安全性,完善治疗技术,稳步推广。目前ClincalTrials.gov已经注册了两项HIPEC预防结直肠癌腹膜种植转移的III期临床实验,其中一项为浙江大学医学院附属二院大肠癌诊治中心所发起(NCT02179489)。
五、展望
CRS/HIPEC可能成为治愈结直肠癌腹膜转移的一种重要的治疗手段。外科医生和肿瘤科医生在发现结直肠癌腹膜种植转移后,不要忽视还有CRS/HIPEC这种的治疗手段以及向有CRS/HIPEC经验的治疗中心转诊这样的病人。对于CRS/HIPEC将来仍有许多问题有待解决,例如:不同的治疗手段的组合;不同的时间、剂量、温度和药物(细胞毒药物和生物制剂)的HIPEC去降低CC-0切除术后的局部复发;用HIPEC能否预防具有高危腹膜转移的结直肠癌发生转移等。患者适应证选择是决定疗效及降低术后并发症和死亡率的关键因素,而PCI是决定患者选择的最重要条件之一。寻找有效的手段进行快捷、方便而无创的术前评估是对结直肠癌腹膜转移的诊治需要解决的一个重要的问题。
[1] Koppe MJ, Boerman OC, Oyen WJ, et al. Peritoneal carcinomatosis of colorectal origin:incidence and current treatment strategies.Ann Surg,2006,243:212-222.
[2] Alvaro Arjona-Sánchez,Francisco Javier Medina-Fernández,Francisco Cristobal Mu oz-Casares,et al.Peritoneal metastases of colorectal origin treated by cytoreduction and HIPEC:An overview.World JGastrointestOncol,2014,6(10):407-412.
[3] Ung L,Chua TC,Morris DL.Peritoneal metastases of lower gastrointestinal tract origin:a comparative study of patient outcomes following cytoreduction and intraperitoneal chemotherapy.J Cancer Res ClinOncol,2013.
[4] Tomoyoshi Aoyagi,Krista P Terracina,Ali Raza,et al.Current treatment options for colon cancer peritoneal carcinomatosis.World J Gastroenterol,2014,20(35):12493-12500.
[5] Esquivel J,Sticca R,Sugarbaker P,et al.Cytoreductive surgery and hyperthermicintraperitoneal chemotherapy in the management of peritoneal surface malignancies of colonic origin:a consensus statement.Society of Surgical Oncology.Ann SurgOncol,2007,14(1):128-133.
[6] Jacquet P,PHSugarbaker.Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis.Cancer Treat Res,1996,82:359-374.
[7] Brucher BL,Piso P,Verwaal V,et al.Peritonealcarcinomatosis:cytoreductive surgery and HIPEC--overview and basics.Cancer Invest,2012,30(3):209-224.
[8] Kelly1KJ, Nash1GM. Peritoneal debulking/intraperitoneal chemotherapy-non-sarcoma.J SurgOncol,2014,109(1):14-22.
[9] Verwaal VJ,van Ruth S,de Bree E,et al.Randomized trial of cytoreduction and hyperthermicintraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer.Journal of Clinical Oncology:Official Journal of the American Society of Clinical Oncology,2003,21(20):3737-3743.
[10] Kuijpers AM,Mirck B,Verwaal VJ,etal.Cytoreduction and HIPEC in the Netherlands:nationwide long-term outcome following the Dutch protocol.Ann SurgOncol,2013,20(13):4224-4230.
[11] Passot G,Bakrin N,Roux AS,et al.Quality of life after cytoreductive surgery plus hyperthermicintraperitoneal chemotherapy:a prospective study of 216 patients.European Journal of Surgical Oncology,2014,40(5):529-535.
[12] Tsilimparis N,Bockelmann C,Raue W,et al.Quality of life in patients after cytoreductive surgery and hyperthermicintraperitoneal chemotherapy:is it worth the risk?Annals of surgical oncology,2013,20(1):226-232.
[13] Hill AR,McQuellon RP,Russell GB,et al.Survival and quality of life following cytoreductive surgery plus hyperthermicintraperitoneal chemotherapy for peritoneal carcinomatosis of colonic origin.Annals of surgical oncology,2011,18(13):3673-3679.
孙立峰,童舟,丁克峰.外科肿瘤细胞减灭术联合腹腔内热灌注化疗——结直肠癌腹膜转移治疗的突破方向?[J/CD].中华结直肠疾病电子杂志,2015,4(3):234-239.

