锂基硅酸盐吸附剂的合成及性能研究
孙成志, 杨丽霞, 左臣盛, 李明丽, 任永峰, 刘 丹, 刘道胜
(1.辽宁石油化工大学化学化工与环境学部,辽宁抚顺 113001;2.朝阳市环境科学研究院,辽宁朝阳 122500;3.天津工业大学环境与化学工程学院,天津300389)
锂基硅酸盐吸附剂的合成及性能研究
孙成志1, 杨丽霞1, 左臣盛1, 李明丽1, 任永峰2, 刘 丹3, 刘道胜1
(1.辽宁石油化工大学化学化工与环境学部,辽宁抚顺 113001;2.朝阳市环境科学研究院,辽宁朝阳 122500;3.天津工业大学环境与化学工程学院,天津300389)
采用高温固相合成法和沉淀法分别制备了高温CO2吸附剂正硅酸锂(Li4SiO4),利用X射线粉末衍射仪(XRD)和扫描电镜(SEM)对吸附剂进行表征,化学吸附仪测试CO2吸附/脱附性能,研究了合成方法、焙烧温度、锂硅物质的量比和不同硅源对吸附剂的影响。实验结果表明,在750 ℃下沉淀法制备的吸附剂比固相法合成的颗粒分布均匀,经过6次CO2(VCO2/VHe=1∶5)吸附-解吸循环后,以SiO2-II为硅源的沉淀法吸附剂吸附量由13.38%降为9.92%,解吸量由11.74%降为8.52%;以SiO2-I为硅源的沉淀法吸附剂的吸附量、解吸量大约下降2.61%、2.39%,固相法吸附剂的吸附量、解吸量分别下降1.85%、1.42%。
正硅酸锂;二氧化碳;高温固相法;沉淀法
自工业革命以来,CO2排放逐年增加,温室效应加剧,引起全球气候变暖,备受世界各国广泛关注。由于发电厂、炼油厂等排放的烟道气温度较高,吸附其中的CO2通常要经过降温处理,导致能耗大,吸收成本高。为此,针对性地研究在高温下直接捕获CO2具有重要的理论意义和应用价值,也一直是人们研究的热点。
近年来,正硅酸锂作为一种新型的高温CO2吸附材料,受到很多学者的青睐。目前,国内外学者主要研究固相合成的正硅酸锂吸附动力学,如J. I. Ida等[1-2]研究了正硅酸锂高温条件下吸附CO2动力学模型;王银杰等[3-5]研究了 Na+、K+掺杂对正硅酸锂吸附速度的影响。然而,对于合成方法的研究相对比较少,仅仅M. E. Bretado等[6]以Li2CO3、HNO3和SiO2为原料,利用沉淀法合成Li4SiO4,研究发现沉淀法制取的材料吸附速度更快;郑楚光等[7-9]利用溶胶凝胶法制备的正硅酸锂材料于700 ℃时吸收性能为25%;张超武等[10]利用凝胶-固相反应法于700 ℃下煅烧16 h制备出纯硅酸锂高温CO2吸附材料,其吸附平衡温度为700 ℃,27 min后饱和吸附量为35%;袁文辉等[11]用柠檬酸-乙醇(CA-EtOH)络合法制备粒度均匀、化学组成均匀、吸附速率适中的Li4SiO4粉体,于700 ℃下达到最大吸附量时,样品质量增加32.2%。
本课题组已研发可用于变温吸附脱附的流化床工艺的中温(200~400 ℃)镁基吸附剂[12],在此基础上,本文以SiO2为硅源,氢氧化锂(LiOH·H2O)为锂源,碳酸氢铵(NH4HCO3)为沉淀剂,采用沉淀法合成正硅酸锂高温吸附剂,将其与固相法(碳酸锂和二氧化硅固相混合)合成的粉体进行比较,采用XRD、SEM、ChemBET-TCD等表征方法和测试手段对吸附剂的相组成、微观形貌和循环吸附-脱附CO2能力进行研究。
1 实验部分
1.1 试剂
Li2CO3(AR)、LiOH·H2O(AR)、NH4HCO3(AR)、固态SiO2-I(AR)、液态SiO2-II(AR),以上试剂均来自国药集团化学试剂有限公司;CO2与He混合气(体积比为1∶5)来自于抚顺气体运输公司。
1.2 正硅酸锂的制备
通过沉淀法合成正硅酸锂(Li4SiO4)材料。以SiO2-I、SiO2-II为硅源,按n(Li)/n(Si)=4的原料配比准确配置氢氧化锂(LiOH) 溶液和碳酸氢铵(NH4HCO3)溶液,称取SiO2粉末,室温下先将SiO2悬浮于LiOH溶液中,以0.5 mL/min的流量将NH4HCO3溶液滴入混合溶液中,搅拌速度300 r/min,滴定完毕,搅拌2 h,升温至60 ℃,继续反应1 h,停止搅拌后,抽滤,120 ℃下恒温干燥24 h,将得到的粉体研磨均匀后,放入管式炉,在一定的温度下焙烧6 h。
通过固相法合成Li4SiO4材料。为使反应物质混合均匀,首先准确称取物质的量之比为2∶1的Li2CO3和SiO2,放入玛瑙研钵中,向混合物质加入少量去离子水,研磨使反应物混合均匀,加热至100 ℃蒸发溶剂,于750 ℃下煅烧6 h。
1.3 吸附剂的物性表征
XRD:采用日本岛津XRD-7000衍射仪对样品物相组成进行分析,采用Cu辐射源,管电流30 mA,管电压40 kV,扫描角度2θ为5°~65°,速度为5(°)/min。
SEM:利用德国布鲁克QUANTAX 200X扫描电子显微镜(SEM)观察样品的形貌、尺寸。
1.4 吸附剂的吸附性能测试
在美国康塔的Chembet PULSAR TPR/TPD化学吸附仪上进行试验,原料为CO2和He的混合气(VCO2/VHe=1∶5),流量为60 mL/min,升温降温速率5 ℃/min,在500~700 ℃进行CO2吸附-解吸循环。
2 结果与讨论
2.1 不同制备方法吸附剂的XRD
图1给出了固相法和沉淀法合成的吸附剂在750 ℃焙烧下的XRD谱图。由图1可知,两种方法合成的吸附剂都含有活性相Li4SiO4(2θ≈16.67°、17.18°、22.16°、22.52°、24.14°、28.13°、33.82°、34.82°、38.17°、49.24°、60.57°;PDF: 20-0637);有杂质相Li2CO3(2θ≈21.30°、30.56°、31.74°;PDF:15-0519)的衍射峰,说明沉淀法制备的吸附剂在750 ℃下发生吸附反应。
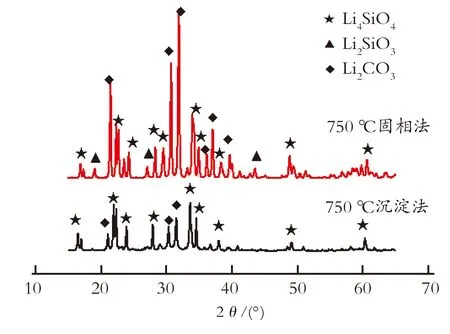
图1 固相法和沉淀法合成Li4SiO4 的XRD谱图
Fig.1 XRD patterns of Li4SiO4with solid-state reaction method and precipitation method
高温固相法存在Li4SiO4(2θ≈16.69°、17.17°、22.18°、22.52°、24.10°、29.42°、33.84°、34.78°、38.20°、49.18°、60.57°;PDF: 20-0637)、Li2SiO3(2θ≈18.86°、26.94°、43.42°;PDF:15-0519)和Li2CO3(2θ≈21.32°、30.58°、31.74°、36.94°、39.54°;PDF:15-0519)混合相,并且Li4SiO4峰型扁小,而Li2CO3和Li2SiO3的峰型尖锐,说明固相法原料混合不均匀,反应不充分,在此温度下焙烧6 h很难得到较纯正的Li4SiO4吸附剂。
2.2 不同焙烧温度下吸附剂的XRD
图2为沉淀法制备的Li4SiO4不同焙烧温度下的XRD图谱。由图2可以看出,700~800 ℃反应时,样品中均有Li4SiO4的衍射峰存在。当反应温度为700 ℃时,存在Li2CO3的最强峰,说明Li2CO3过量,没有反应完全,其会阻碍吸附反应的进行,导致吸附量下降。而且700 ℃反应时,有Li2SiO3的衍射峰出现,说明此温度还未达到Li4SiO4的最佳合成温度,而750 ℃和800 ℃反应时没有观察到Li2SiO3,说明高温可生成较多的Li4SiO4,但焙烧温度越高,Li4SiO4粒径越大,影响其吸收CO2,且温度过高可能导致Li4SiO4烧结。
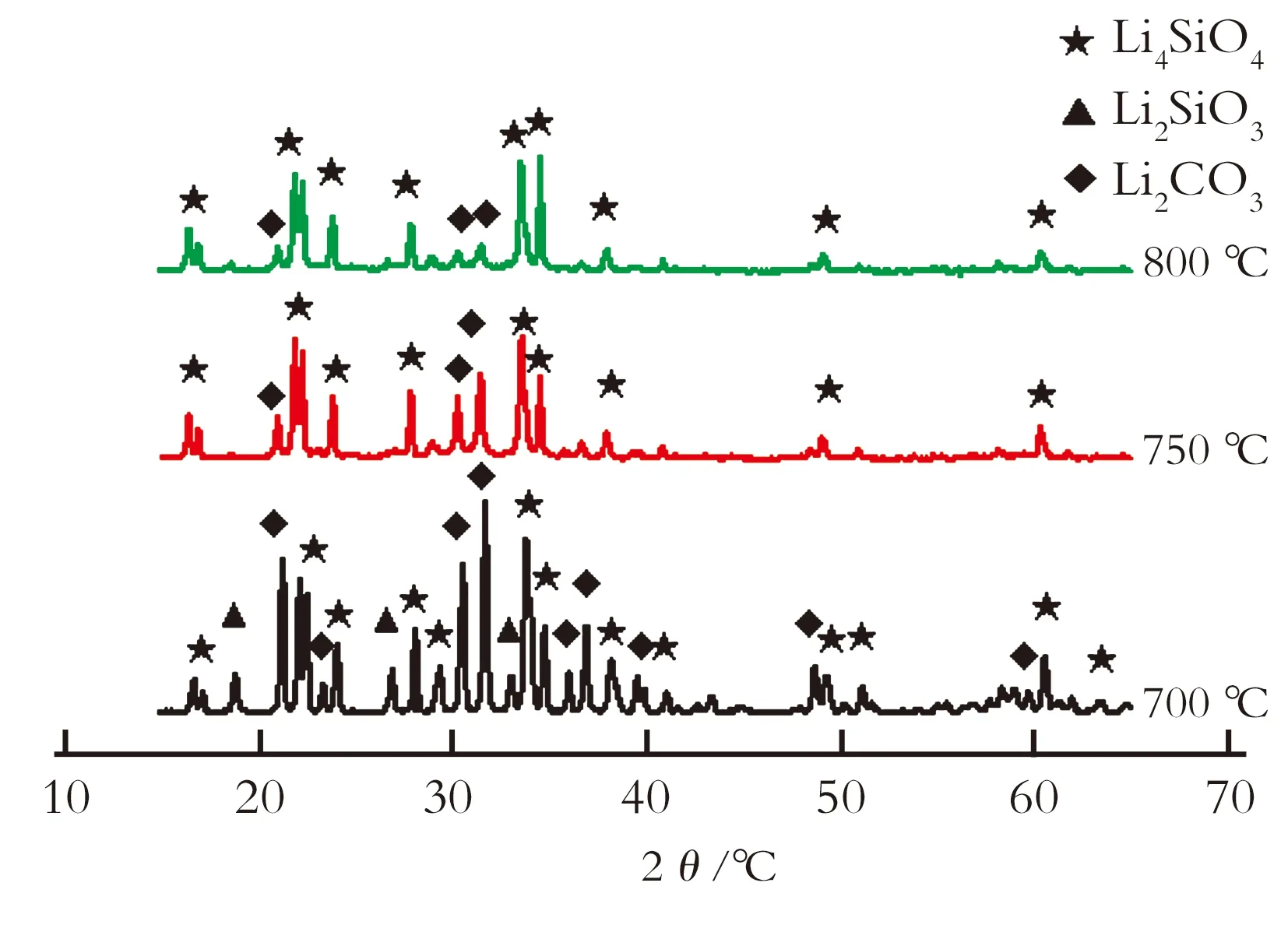
图2 不同焙烧温度下Li4SiO4(沉淀法)的XRD图谱
Fig.2 XRD patterns of Li4SiO4by precipitation method with different temperature
2.3 不同n(Li)/n(Si)吸附剂的XRD
图3比较了不同n(Li)/n(Si)物质的量比对750 ℃下合成的吸附剂的影响。由图3可以明显看出,当n(Li)/n(Si)=3∶1、5∶1时,所得产品中主要含有Li2CO3和Li2SiO3杂质相,基本没有吸附剂Li4SiO4存在;当n(Li)/n(Si)=2∶1,产物主要以Li2SiO3和Li2Si2O5形式存在,也没有Li4SiO4存在;当n(Li)/n(Si)=4∶1,Li4SiO4衍射峰明显出现,说明Li/Si物质的量比对合成的吸附剂的成分及其吸附性能起到决定性作用。
2.4 吸附剂SEM微观形貌分析
图4为沉淀法和固相法合成的Li4SiO4粉末SEM。由图4可见,采用沉淀法制备的Li4SiO4主要由20~40 μm的颗粒组成,高温固相法制备的LiSiO4的颗粒尺寸为200~300 μm,显然,沉淀法合成的样品颗粒相对较小,颗粒分布均匀;而固相法合成样品团聚成小球,颗粒尺寸明显增大,700 ℃焙烧后粉体容易聚结,这会严重限制正硅酸锂吸收和解吸CO2的速率。
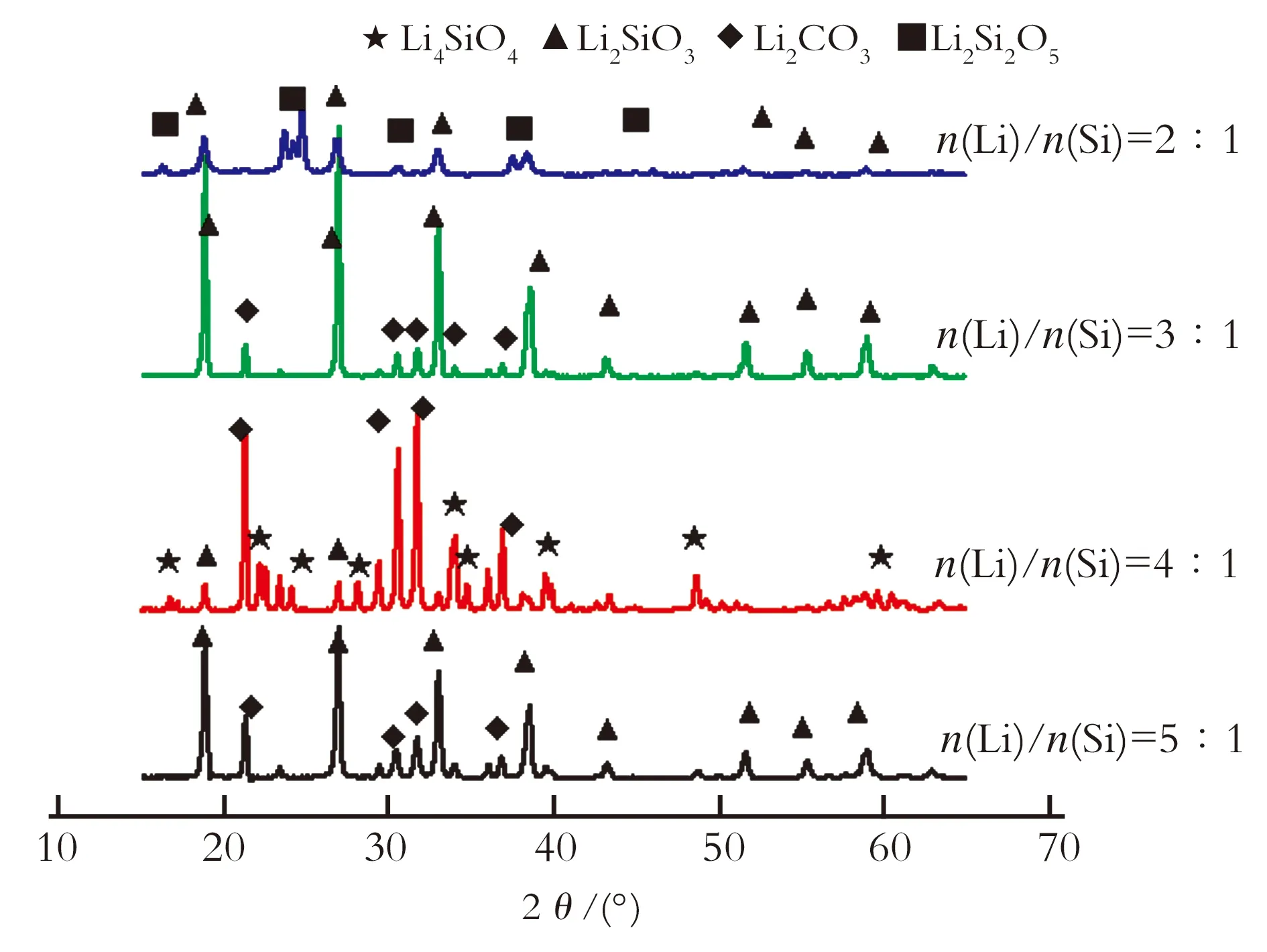
图3 不同n(Li)/n(Si)合成Li4SiO4(沉淀法)XRD图谱
Fig.3 XRD patterns of Li4SiO4with different Li/Si mole ratio by precipitation method

图4 沉淀法和固相法合成的Li4SiO4粉末SEM
Fig.4 SEM images of Li4SiO4by precipitation method and solid-state reaction method
2.5 典型吸附剂变温吸附-解吸CO2性能考察
正硅酸锂与CO2反应的方程式为:
理论吸附量为1 g正硅酸锂完全与CO2反应,消耗CO2的质量为36.67 mg。本实验采取吸附容量-解吸容量的计量方法对吸附剂的吸附-解吸性能进行评价。计算公式如下:
CO2吸附容量=吸附CO2的质量/Li4SiO4的质量×100%
CO2解吸容量=解吸CO2的质量/Li4SiO4的质量×100%
图5描绘了沉淀法和固相法制备的正硅酸锂吸附剂变温动态循环吸附-解吸CO2的曲线。将图5中的吸附-解吸峰进行Split Gaussian拟合,拟合结果见表1。
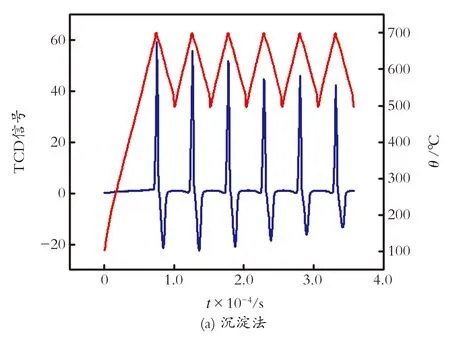
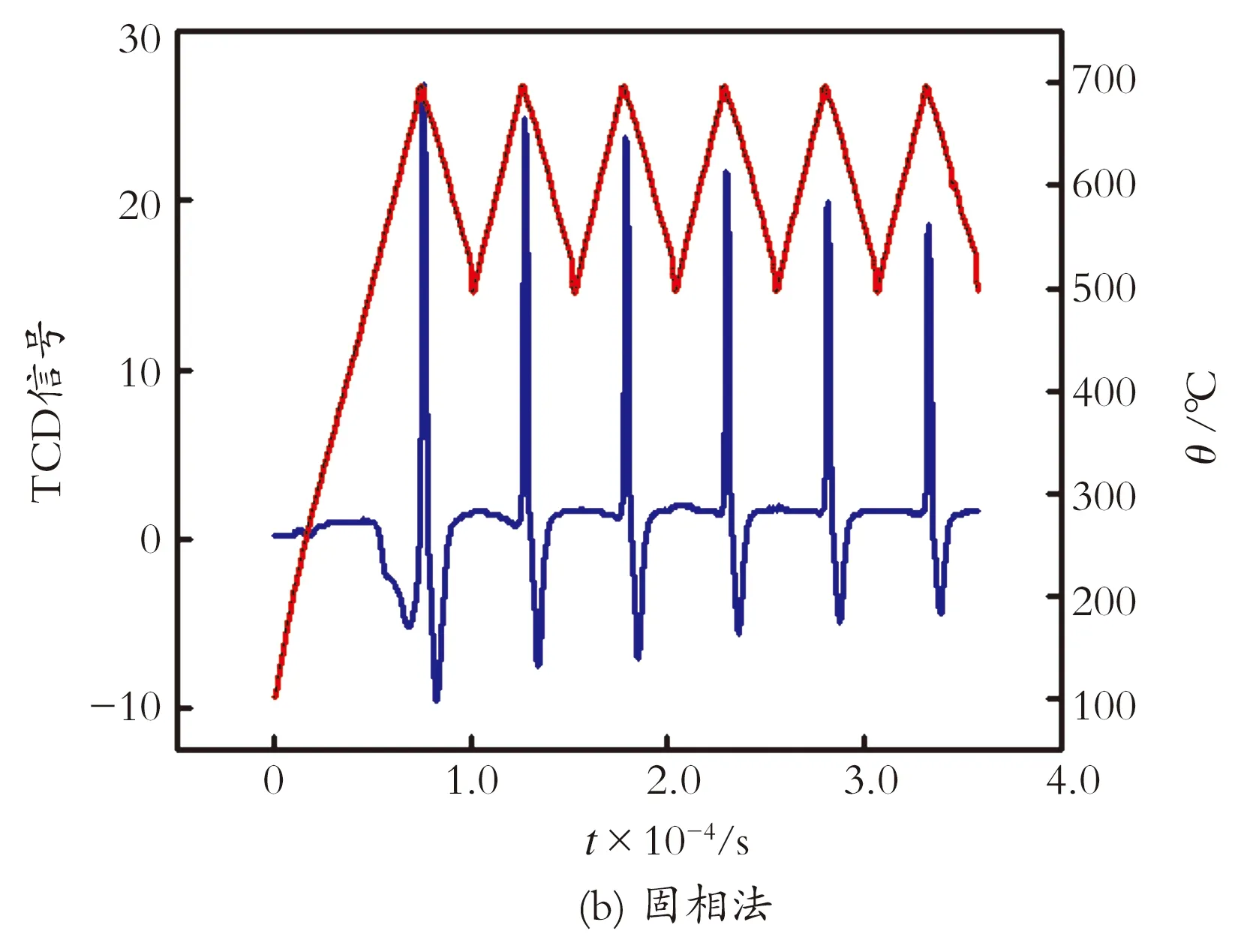
图5 沉淀法和固相法合成吸附剂变温动态脱附-吸附循环
Fig.5 Temperature swing adsorption-desorption dynamic cyclic test of sorbent by precipitation method and solid-state reaction method
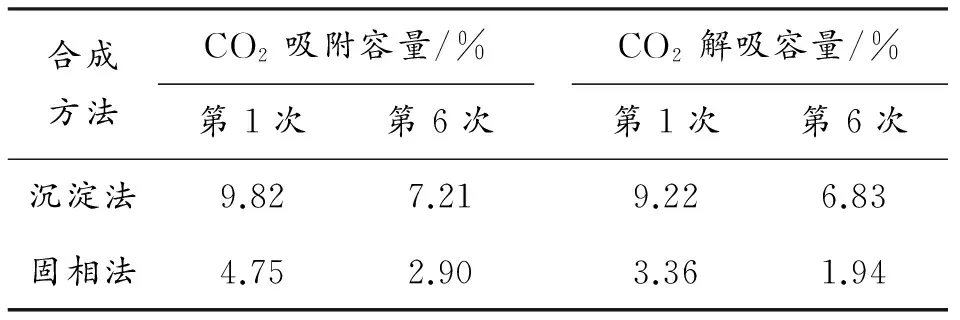
表1 合成方法对吸附剂变温吸附脱附循环结果影响
由表1可知,沉淀法所制备的吸附剂6次循环后,CO2吸附容量为初始吸附量的73.42%,CO2解吸容量为初始解吸容量的74.08%;相比之下,固相法所制备的吸附剂6次循环后,CO2吸附容量为初始吸附容量的61.05%,CO2解吸容量为初始解吸容量的57.74%。两种合成方法所制备的吸附剂在模拟烟道气模型中吸附-解吸性能稳定性都未达到最佳效果,这说明固相法所制备的吸附剂颗粒尺寸较大,杂质相Li2CO3和Li2SiO3极大阻碍Li4SiO4的吸附-解吸能力;而沉淀法所制备的吸附颗粒较均匀,稳定性下降的原因在于脱附出的部分Li4SiO4在高温下分解为Li2O气体而升华逸出,导致吸附容量下降。
表2列出固态SiO2-I、液态SiO2-II对吸附剂变温吸附解吸的影响。通过表2数据对比,可以明显看出SiO2-II所合成的吸附剂的吸附、解吸性能明显提高,说明相同反应条件下,SiO2-II更易溶于反应溶液中,最后经过焙烧得到较纯净的Li4SiO4,并且所制得的吸附剂的孔径较大,在CO2吸附脱附动态循环实验中,吸附剂更容易吸收CO2并解吸出来,而SiO2-I 与反应溶液混合不充分,导致所合成吸附剂孔径小,最终导致Li4SiO4吸附解吸性能明显下降。由此可见,SiO2的聚集状态对所合成的锂基硅酸盐的结构有显著的作用。
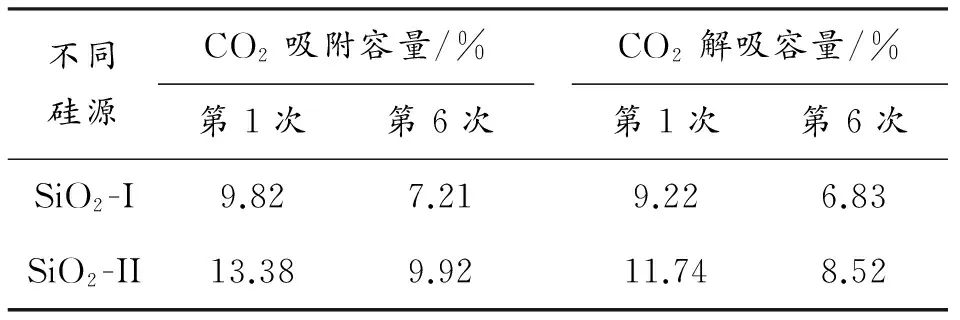
表2 硅源对沉淀法吸附剂变温吸附脱附循环结果影响
3 结论
固相法制备正硅酸锂材料虽然操作简单,但为得到高纯度正硅酸锂,耗能耗时,并且产物粒度不均匀,高温易烧结,比表面积较小,6次CO2捕获模拟试验(VCO2/VHe=1∶5)后,吸附容量下降1.85%,解吸容量下降1.42%,显著制约吸附剂捕获CO2性能。以沉淀法为合成方法,在750 ℃下一步合成的锂基硅酸盐吸附剂,样品成分含有较纯正的Li4SiO4,样品分布均匀,比表面积大,在相同的模拟操作条件下,其吸附-解吸性能较好,6次循环后,SiO2-I所得吸附剂吸附容量由9.82%降到7.21%,解吸容量由9.22%降到6.83%,SiO2-II所得吸附剂吸附容量由13.38%降到9.92%,解吸容量由11.74%降到8.52%,显然,吸附剂解吸容量和吸附容量不平衡,稳定性没有达到预期的效果,对反应物组分改进成为本课题今后的研究方向。
[1] Ida J I, Xiong R T, Lin Y S. Synthesis and CO2sorption properties of pure and modified lithium zirconate[J]. Separation and Purification Technology, 2004, 36(1):41-51.
[2] Ida J I, Lin Y S. Mechanism of high-temperature CO2sorption on lithium zirconate[J]. Environmental Science and Technology, 2003, 37(9):1999-2004.
[3] 王银杰,齐鲁,代克化.Na掺杂对硅酸锂吸收CO2性能的影响[J].物理化学学报,2006,22(7):860-863.
Wang Yinjie, Qi Lu, Dai Kehua. Effect of Na-doping on CO2absorption of Li4SiO4[J]. Acta. Physico-Chimica Sinica., 2006,22(7):860-863.
[4] 王银杰,齐鲁,汪卫军.K的掺杂对硅酸锂吸收CO2性能的影响[J].北京理工大学学报,2006,26(5):458-467.
Wang Yinjie, Qi Lu, Wang Weijun. Effect of doping K element on properties of lithium silicate as CO2-absorbent[J]. Transactions of Beijing Institute of Technology, 2006,26(5):458-467.
[5] 王银杰,齐鲁,汪卫军.高温下硅酸锂吸收CO2的研究[J].无机化学学报,2006,22(2):268-272.
Wang Yinjie, Qi Lu, Wang Weijun. CO2absorption of Li4SiO4at high temperature[J]. Chinese Journal of Inorganic Chemistry, 2006,22(2):268-272.
[6] Bretado M E, Velderrain V G, Gutierrez D L, et al. A new synthesis route to Li4SiO4as CO2catalytic/sorbent[J]. Catalysis Today, 2005, 107-108(44): 863-867.
[7] 汪文哲,赵永椿,郑楚光,等.高温下Ti掺杂对Li4SiO4吸收CO2性能的影响[J].动力工程学报,2010,30(8):623-627.
Wang Wenzhe,Zhao Yongchun,Zhao Chuguang, et al. Influence of Ti-doping on CO2absorption by Li4SiO4at high-temperatures[J]. Journal of Chinese Society of Power Engineering, 2010,30(8):623-627.
[8] 王珂.高温固体吸附剂循环捕获烟道气CO2的实验与动力学研究[D].武汉:华中科技大学,2011.
[9] 汪文哲.氧化锂基吸收剂高温二氧化碳吸收的实验研究[D].武汉:华中科技大学,2011.
[10] 张超武,徐彬,刘昌涛,等.Li4SiO4高温吸碳材料的制备及性能研究[J].陕西科技大学学报,2013,31(1):19-32.
Zhang Chaowu, Xu Bin, Liu Changtao, et al. Preparation and performance investigation of Li4SiO4used as a CO2-absorbent material at high temperature[J]. Journal of Shaanxi University of Science and Technology, 2013,31(1):19-32.
[11] 袁文辉,梁杰,李莉.Li4SiO4的制备表征及CO2吸附与模拟[J].化工进展,2009,28(增刊):306-309.
Yuan Wenhui, Liang Jie, Li Li. The preparation and characterization of Li4SiO4and CO2adsorption-simulation[J]. Chemical Industry and Engineering Progress, 2009,28(Supplement):306-309.
[12] 左臣盛,周思宇,孙成志,等.变温镁基CO2吸附剂的制备及应用I. Na/Mg物质的量比[J].燃料化学学报,2014,42(7):884-889.
Zuo Chensheng, Zhou Siyu, Sun Chengzhi, et al. Preparation and application of magnesium-based CO2sorbent for temperature swing absorption I. Na/Mg mol ratio[J]. Journal of Fuel Chemistry and Technology, 2014, 42(7):884-889.
(编辑 闫玉玲)
Preparation and Performance Investigation of Lithium-Based Silicate Materials
Sun Chengzhi1, Yang Lixia1, Zuo Chensheng1, Li Mingli1, Ren Yongfeng2, Liu Dan3,Liu Daosheng1
(1.DivisionofChemistry,ChemicalEngineeringandEnvironment,LiaoningShihuaUniversity,FushunLiaoning113001,China; 2.ChaoyangResearchInstituteofEnvironmentalSciences,ChaoyangLiaoning122500,China;3.InstituteofEnvironmentandChemicalEngineering,TianjinPolytechnicUniversity,Tianjin300389,China)
The Lithium-based sorbents for high temperature CO2capture were prepared through solid-state reaction method and precipitation method, which were characterized by X-ray diffraction(XRD) and scanning electronic microscopy(SEM). The CO2absorption performance was evaluated by the chemical BET absorption(CHEMBET) method and the impact factors (including synthetic method, calcination temperature, molar ratio of Li to Si and different silica sources) were studied. The results indicated that the particle size of the adsorbents synthesized by the precipitation method distributed more homogeneous than that of the adsorbents synthesized by the solid-state reaction method at 750 ℃. Meanwhile, BET surface area of former was larger than that of latter. After six times CO2(carbon dioxide to helium in a volume ratio of 1∶5) recycles, adsorption capacity of precipitation-method adsorbents using SiO2-II reduced to 9.92% from 13.38%, and desorption amount decreased from 11.74% to 8.52%. However, the amounts of adsorption and desorption of precipitation-method adsorbents using SiO2-I were reduced by 2.61% and 2.39%, those of solid-state-method adsorbents reduced by 1.85% and 1.42%.
Lithium-based sorbent; Carbon dioxide; Solid-state reaction method; Precipitation method
1006-396X(2015)03-0012-05
2014-10-11
2015-03-18
国家自然科学基金项目 (21103077);新世纪优秀人才支持计划(NCET-11-1011)。
孙成志(1987-),男,硕士研究生,从事无机功能材料方向研究;E-mail:czsun11@163.com。
刘道胜(1976-),男,博士,副教授,从事多孔材料及其表面物理化学研究;E-mail:dsliu05@126.com。
TE992.1; TQ174.9
A
10.3969/j.issn.1006-396X.2015.03.003

