云烟87八倍体植株的诱导及其主要生殖特征
赵申清玉,党江波,梁国鲁,向素琼,郭启高,张艳
1西南大学园艺园林学院,重庆北碚,400716;2中国烟草总公司重庆市公司烟草研究所,重庆北碚,400716
云烟87八倍体植株的诱导及其主要生殖特征
赵申清玉1,党江波1,梁国鲁1,向素琼1,郭启高1,张艳2
1西南大学园艺园林学院,重庆北碚,400716;2中国烟草总公司重庆市公司烟草研究所,重庆北碚,400716
通过不同浓度秋水仙素溶液浸泡“云烟87”四倍体无菌苗茎尖72 h,经组织培养,成功获得八倍体植株,其中以0.4%浓度秋水仙素处理检出率最高,为28.57%。与“云烟87”四倍体植株相比,八倍体植株花器官明显较大,叶片较厚、较小,节间较短。八倍体植株花粉量小,花粉大小不均一,可见超大花粉,花粉萌发率低,仅为6.45%。八倍体自交不能结实,但与四倍体烟草品种杂交均可获得大量有活力的种子,发芽率均大于65%,且与同“云烟87”四倍体杂交不能获得种子的野生烟草Nicotianaplumbaginifolia杂交也可获得有活力的种子。可见,通过秋水仙素浸泡结合组织培养获得烟草八倍体是可行的。
云烟87; 八倍体; 六倍体; 种子
部分植物多倍体以其器官巨大、生长快速、无籽、有效成分含量高、对逆境的适应能力强等特性在育种中得到广泛应用[1-3]。其中三倍体、四倍体见较多报道,尤其是在一些能单性结实的果树以及以营养器官为主要产物的植物,如香蕉[4]、柑橘[5]、杨树[6]、甜菜[7-8]、丹参[9]、青蒿[10]中的应用较具前景。部分大面积推广的三倍体甜菜、西瓜即为四倍体与二倍体杂交而成,这种方法近来亦被用于三倍体丹参的培育[11-12]。
烟草为异源四倍体物种,其具明显的二倍化特征[13-14]。因此,烟草八倍体可能具有与普通二倍体物种的四倍体材料相似的特征,其与四倍体烟草杂交可能会获得大量六倍体烟草。由于在烟草生产及研究中,四倍体是主要材料,八倍体的研究仅零星见于少数文献[15-17],其相关特征也不甚明晰。因此,对烟草八倍体的相关特性,特别是生殖相关特性进行研究,一方面有利于拓展烟草研究的范围,另一方面也有利于后续利用烟草八倍体创制烟草六倍体植株。八倍体材料在烟草育种中并不常用,因此染色体加倍在处理四倍体烟草中少见报道[15-17]。植物染色体加倍的方法较多,其中以秋水仙素溶液诱导最为常用[18],在构建烟草DH系材料中经常使用[19]。本试验在组织培养条件下采用秋水仙素诱导获得八倍体烟草植株,并对其主要生殖特征进行了观察与研究。为后续利用烟草八倍体培育烟草六倍体提供参考。
1 材料与方法
1.1 材料
“云烟87”四倍体无菌苗,“云烟87”四倍体、“Florida301”四倍体、“Beinhart1000-1”四倍体、“L-8”四倍体、N.plumbaginifolia二倍体(种子由国家烟草中期库提供)植株。所有材料均种植于西南大学重庆市果树学重点实验室试验基地。
1.2 方法
八倍体诱导:参考刘仁祥等[20]的报道采用秋水仙素浸泡法,于无菌操作台上小心切取“云烟87”四倍体无菌苗茎尖,放入0.0%、0.1%、0.2%、0.4%、0.8%的秋水仙素无菌溶液中,72小时后取出,无菌水清洗5遍,后将其接种于MS+2.0 mg/L 6-BA+0.2 mg/L NAA中,约30 d后将不定芽转入MS+0.5 mg/L 6-BA+0.2 mg/L NAA中,继代3次。
染色体数目鉴定:待第3次继代的幼苗长至5-7叶时取幼嫩叶片,于0.002 mol/L的8-羟基喹啉溶液中处理4 h,去壁低渗火焰干燥法制片[21]。
八倍体形态观察:获得的八倍体植株经组织培养扩繁生根(生根培养基为:1/2MS+2.0mg/L IBA)后种植于田间,观察、测定花器官形态,花粉形态,以“云烟87”四倍体为对照。
花粉活力测定:花粉活力的测定采用离体萌发法。参考谢朝添等的[22]方法配制烟草花粉离体萌发培 养 基:0.01% KH2PO4,0.01% CaCl2,0.01% H3BO3和 15% 蔗糖。25℃培养 4 h 后显微镜下观察,以花粉管长度大于花粉粒直径作为萌发标准,统计花粉萌发率,以“云烟87”四倍体为对照。
杂交:以“云烟87”四倍体、八倍体为母本,与“云烟87”四倍体、“Florida301”四倍体、“Beinhart1000-1”四倍体、“L-8”四倍体、N.plumbaginifolia二倍体进行杂交,每个杂交组合20-50个蒴果,记录坐果率。蒴果成熟后,收集种子,去除杂质,干燥保存。
种子活力测定:将杂交获得的种子分散于湿润滤纸上,置于25℃环境中,保湿,10 d后统计发芽率。
1.3 统计分析
“云烟87”四倍体、八倍体花器官形态、花粉形态数据采用excel软件计算平均值及标准差,t检验检测四倍体与八倍体间的差异水平。
2 结果与分析
2.1 八倍体的诱导
“云烟87”组培苗幼芽经不同浓度的秋水仙素无菌溶液浸泡72 h后,在增殖培养基上均能形成愈伤组织,部分愈伤组织褐化严重。部分材料在25 d后分化出不定芽,待芽长至2.0-2.5 cm时转至壮苗培养基(MS+0.5 mg/L 6-BA+0.2 mg/L NAA)中,经3次继代,取幼叶检测。
检测结果发现,不同浓度秋水仙素溶液浸泡处理后的茎尖分化出的幼苗大部分仍为四倍体;少部分为八倍体(图1,表1);极少部分倍性大于8x,由于染色体数目过多,无法判定其倍性;部分幼苗为4x和8x混倍体。其中,经0.4%秋水仙素溶液诱导并增殖获得的无菌苗中检出8x的比例最大,为28.57%。
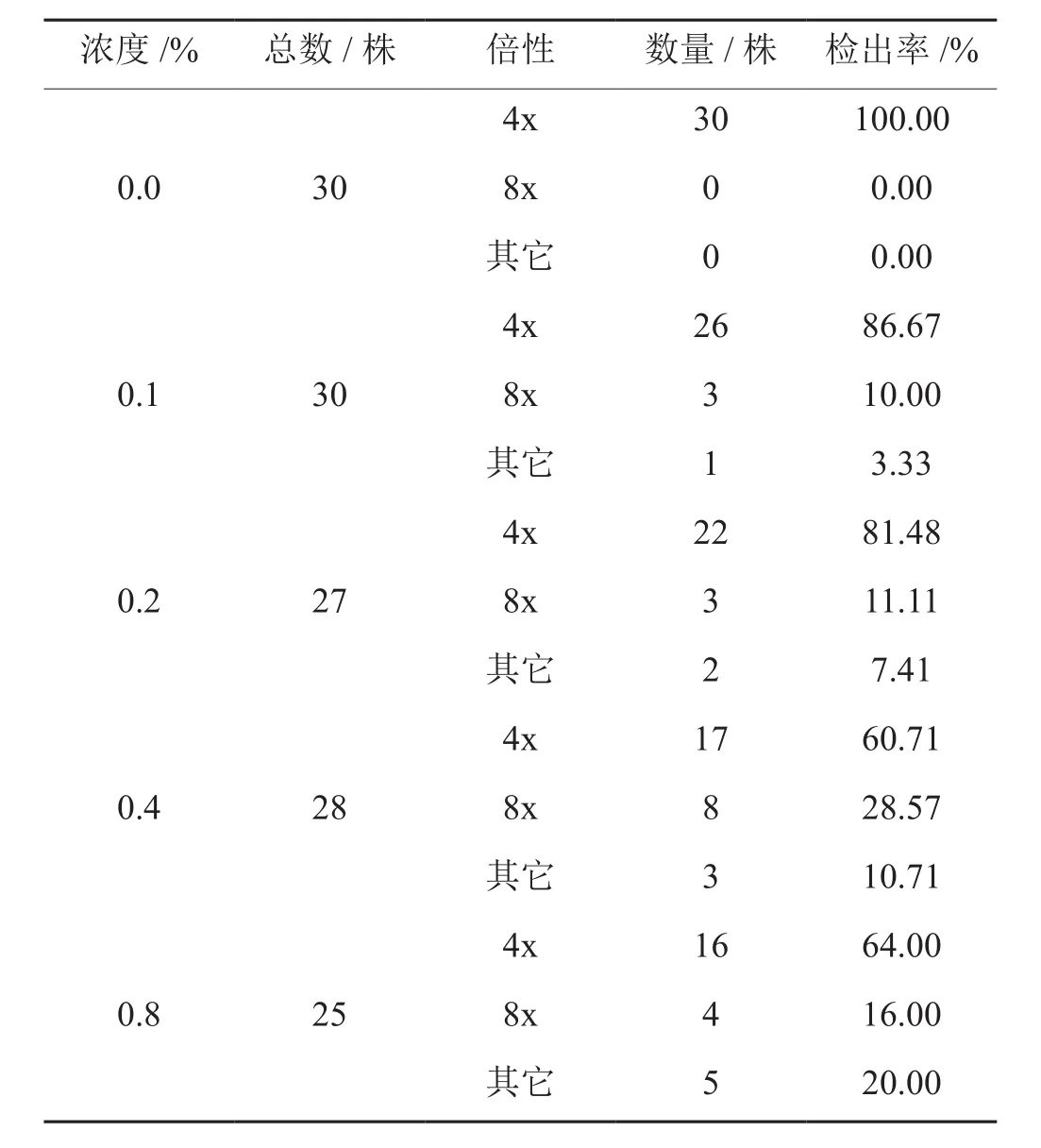
表1 秋水仙素诱导后不同倍性材料检出率Tab.1 Detection rates of plants with different ploidy induced by colchicine
2.2 八倍体形态特征

图1 “云烟87”八倍体植株(A、B)及其染色体数目(2n=8x=96)(C)Fig.1 Yunyan87 octoploid plants (A, B) and chromosomes thereof (2n=8x=96) (C)
八倍体植株较矮、节间较短,叶片较小但肥厚。其发育期明显长于“云烟87”四倍体,2014年统计其现蕾时间较四倍体晚近1个月。八倍体花器官长度、直径,花药长,子房直径、长度,花柱长度以及柱头直径明显大于四倍体(图2,表2)。

图2“云烟87”八倍体(左)与四倍体(右)花器官形态(A,花;B,去部分花冠的花;C,子房、花柱;D,花药)Fig.2 Flower of Yunyan87 octoploid and tetraploid plants (A, fl ower; B, fl ower without corolla; C, ovary and style; D, anther)
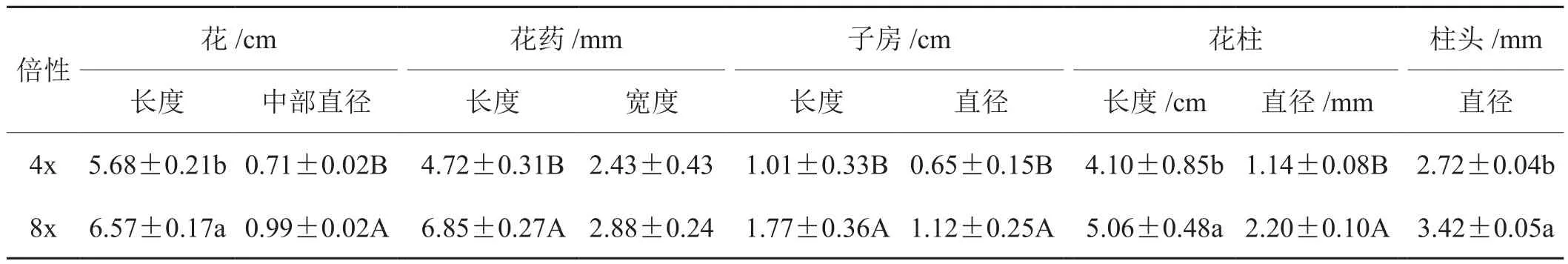
表2 “云烟87”四倍体与八倍体花器官形态对比Tab.2 Comparison between “Yunyan87” tetrploid and octoploid fl owers
八倍体花粉量极少,且不均匀,大部分为空瘪形态(图3)。八倍体花粉平均直径为36.17±10.37 μm,可见超大花粉,其直径最大可达72.53 μm。四倍体花粉则较为均匀,最大花粉直径为45.26 μm,最小花粉直径为28.32 μm,平均直径为35.72±1.57 μm。
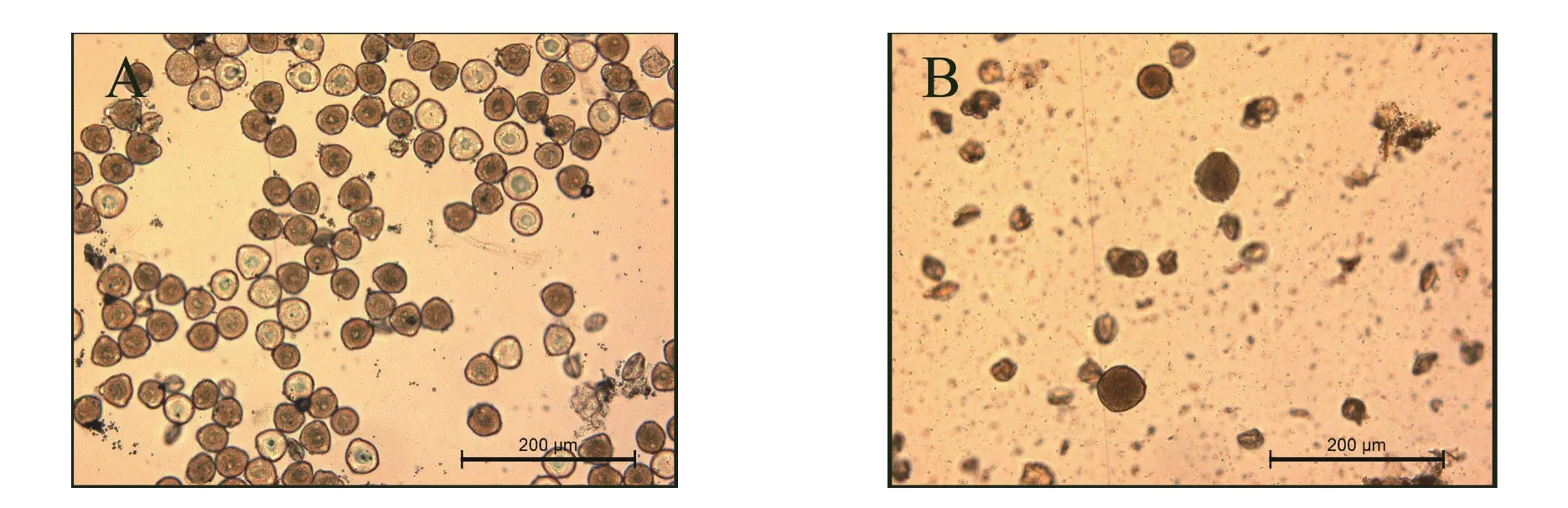
图3 “云烟87”四倍体(A)与八倍体(B)花粉形态(200×)Fig.3 Pollen of Yunyan87 tetraploid (A) and octoploid (B) under optical microscope
2.3 八倍体的花粉活力及结实性
经离体萌发试验显示,“云烟87”四倍体花粉萌发率达58.76%,而八倍体花粉萌发率仅6.45%(图4)。
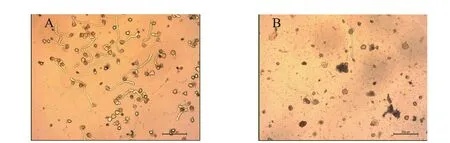
图4 “云烟87”四倍体(A)和八倍体(B)花粉萌发情况(100×)Fig.4 Pollen germination of Yunyan87 tetraploid (A) and octoploid (B)
“云烟87”八倍体作母本与“云烟87”、“Florida301”、“Beinhart1000-1”、“L-8”4个烟草品种的四倍体及野生烟草N.plumbaginifolia二倍体杂交均能正常坐果。除野生烟草杂交坐果率仅为68.00%外,四倍体烟草品种杂交的坐果率均为100.00%,而野生烟草二倍体与“云烟87”四倍体杂交、八倍体自交未能获得成熟蒴果。
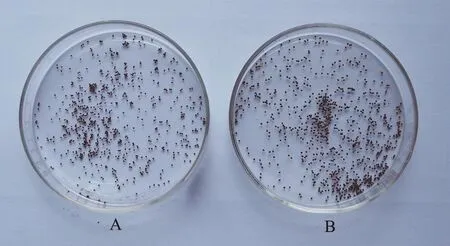
图5“云烟87”四倍体自交(A)种子及云烟87八倍体与四倍体杂交的种子(B)Fig.5 Seeds of Yunyan87 tetraploid sel fi ng and Yunyan87 octoploid cross with tetraploid
八倍体的种子较四倍体种子大(图5),大部分可萌发,萌发率在56.67%-80.17%之间,而“云烟87”四倍体种子的萌发率均在90%以上(表3)。

表3 “云烟87”八倍体杂交坐果率与种子发芽率Tab.3 Fruit setting rates and seeds germination rates of Yunyan87 octoploid's hybridization
3 结论
综上所述,通过秋水仙素溶液浸泡诱导烟草染色体加倍是可行的,“云烟87”八倍体自交不能结实,但作母本可与多个四倍体烟草品种杂交并获得大量有活力的种子,且倍性增加使“云烟87”与野生烟草N.plumbaginifolia的杂交亲和性增加,获得了有活力的种子。这将为后续六倍体烟草及倍半二倍体烟草的培育提供了可能性。
[1]张全美, 张明方.园艺植物多倍体诱导研究进展[J].细胞生物学杂志, 2003, 25(4): 223-228.
[2]张爱民, 常莉, 薛建平.药用植物多倍体诱导研究进展[J].中国中药杂志, 2005, 30(9): 645-649.
[3]谢兆辉, 牟春红.植物多倍化及在育种上的应用[J].中国农学通报, 2002, 18(3): 70-76.
[4]王正询, 林兆平, 潘坤清.蕉类的细胞遗传学研究[J].遗传学报, 1994, 21(6): 453-462.
[5]Aleza P, Cuenca J, Juárez J, et al.“Garbí”Mandarin: A New Late-maturing Triploid Hybrid[J].HortScience, 2010,45(1): 139-141.
[6]朱之悌, 康向阳.毛白杨天然三倍体选种研究[J].林业科学, 1998, 34(4): 22-31.
[7]陶抵辉.植物多倍体的研究与应用[J].生物技术通报,2010, 7: 22-27.
[8]陈登科.繁育多倍体甜菜良种的几点体会[J].中国糖料,1980, 4: 35-36.
[9]陈力, 李秀兰, 陈成彬.药用植物丹参的遗传改良与种质创新研究Ⅲ:三倍体丹参的创制及其优势率分析[C].中国植物学会七十五周年年会论文摘要汇编 (1933-2008), 2008.
[10]穆胜玉.青蒿的组织培养及其四倍体育种[D].西南大学,2007.
[11]Matsumura S, Mochizuki A.Improvement of sugar beet by means of induced triploidy[J].Japanese Journal of Genetics,1953, 28(2): 47-56.;
[12]李秀兰, 陈力.三倍体丹参的培育及其可持续利用研究[J].中草药, 2012, 43(002): 375-379.
[13]Lewis R S.Nicotiana[M]//Wild Crop Relatives: Genomic and Breeding Resources.Springer Berlin Heidelberg, 2011:185-208.
[14]Stines B J, Mann T J.Diploidization in Nicotiana tabacum[J].Journal of Heredity, 1960, 51: 222-27.
[15]Goodspeed T H.Occurrence of triploid and tetraploid individuals in X-ray progenies ofNicotiana tabacum[J].Univiversity of California Publications in Botany, 1930, 11:299-308.
[16]侯丽丽, 施和平, 余武, 等.烟草毛状根多倍体诱导及其植株再生 [J].生物工程学报, 2014, 30(004): 581-594.
[17]Laskowska D, Berbec A.Cytology and fertility of viable hybrids ofNicotiana tabacumL.cv.TB-566 withN.alataLink et Otto[J].Journal of applied genetics, 2005, 46(1):11-18.
[18]郭启高, 宋明.植物多倍体诱导育种研究进展[J].生物学通报, 2000, 35(2): 8-10
[19]朱惠琴, 张宪银, 薛庆中.开发实用的染色体加倍体系构建成烟DH群体[J].分子植物育种, 2004, 2(5): 643-648.
[20]刘仁祥, 黄莺, 蒋光华, 等.秋水仙素对烟草单倍体幼苗加倍及成苗效应研究 [J].西南大学学报: 自然科学版,2009, 31(2): 89-93
[21]陈瑞阳, 宋文芹, 李秀兰.植物染色体标本制备的去壁,低渗法及其在细胞遗传学中的意义 [J].遗传学报, 1982,9(2): 151-159.
[22]谢朝添, 邱义兰, 葛丽丽, 等 .烟草花粉萌发和花粉管生长期间柱头和花柱中的钙分布 [J].植物生理与分子生物学学报, 2005, 31(1): 53-61.
Induction of Yunyan87 octaploid plants and main reproductive characters thereof
ZHAO Shenqingyu1, DANG Jiangbo1, LIANG Guolu1, XIANG Suqiong1, GUO Qigao1, ZHANG Yan2
1 College of Horticulture and Landscape Architecture, Southwest University, Chongqing, 400716, China;2 Tobacco Research Institute of Chongqing Municipal Tobacco Company, Chongqing, 400023, China
Yunyan87 octoploid plants were obtained from stem tips of Yunyan87 tetraploid aseptic seedlings, which were soaked in colchicine of different concentrations for 72h.The highest induction rate was 28.57% which occuredin the concentration of 0.4%.Compared to tetraploid, the octaploid floral organ was bigger with thicker and smaller leaves as well as shorter internodes.Pollens in octoploid plants’ anther had different sizes.Octoploid plants’ pollen germination rate was only 6.45%, and no seed on selfing was found.However, a large number of viable seeds were obtained when octoploid plants crossed with tetrploid tobacco, and germination rate exceeded 65%.Viable seeds in cross of octoploid ×N.plumbaginifoliacould be acquired while those in cross of tetraploid ×N.plumbaginifoliacould not.Results showed that octaploid tobacco can be obtainable from colchicine induction and tissue culture.
Yunyuan87; octaploid tobacco; hexaploid tobacco; seed
赵申清玉,党江波,梁国鲁,等.云烟87八倍体植株的诱导及其主要生殖特征[J].中国烟草学报,2015,21(5)
重庆山地特色优质抗病烤烟新品种选育(2012044)
赵申清玉(1988—),硕士研究生,研究方向:细胞遗传,Email:sophie_zsqy@163.com
梁国鲁(1960—),博士,研究员,研究方向:细胞遗传,Email:lianggl@swu.edu.cn
2014-09-22
:ZHAO Shenqingyu, DANG Jiangbo, LIANG Guolu, et al.Induction of Yunyan87 octaploid plants and main reproductive characters thereof [J].Acta Tabacaria Sinica, 2015, 21(5)

