枯草芽孢杆菌对铜绿微囊藻抑制效果的研究
张 睿,王广军,李志斐,郁二蒙,夏 耘(.中国水产科学研究院珠江水产研究所,农业部热带亚热带水产资源利用与养殖重点实验室,广东 广州 50380;2.上海海洋大学水产与生命学院,上海 20306)
枯草芽孢杆菌对铜绿微囊藻抑制效果的研究
张 睿1,2,王广军1*,李志斐1,郁二蒙1,夏 耘1(1.中国水产科学研究院珠江水产研究所,农业部热带亚热带水产资源利用与养殖重点实验室,广东 广州 510380;2.上海海洋大学水产与生命学院,上海 201306)
为探讨枯草芽孢杆菌(Bacillus subtilis)对铜绿微囊藻(Microcystis aeruginosa)的抑制效果,在实验室条件下,研究了枯草芽孢杆菌不同生长时期(延迟期、对数期、稳定期和衰亡期)无菌滤液对铜绿微囊藻生长的影响、枯草芽孢杆菌抑制铜绿微囊藻生长的作用方式以及无菌滤液影响下铜绿微囊藻丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性和光合色素含量的变化.结果显示:枯草芽孢杆菌对数期、稳定期和衰亡期滤液抑藻效果明显好于延迟期,作用第8d,对铜绿微囊藻的去除率分别达到81.19%、91.41%、91.82%;4个处理组铜绿微囊藻的叶绿素a含量均显著低于对照组.添加稳定期滤液后,铜绿微囊藻MDA含量显著升高,SOD活性先升高后降低;在对光合色素的影响中,类胡萝卜素受到的影响不如叶绿素a显著.结果表明,枯草芽孢杆菌对铜绿微囊藻的抑制效果是通过分泌胞外物质实现的,且分泌物具有很强的热稳定性.推测该胞外分泌物能够破坏光合色素,影响光合作用,抑制藻细胞的生长;同时抑制SOD活性,使细胞膜脂过氧化程度不断加深,进而破坏藻细胞的完整性,表现出对藻很强的抑制效果.
枯草芽孢杆菌;铜绿微囊藻;抑制;叶绿素a;丙二醛(MDA)
藻类是养殖水体的初级生产力,但由于水体内环境失衡,水体富营养化、水温、pH值等因素的异常变化常导致藻类过渡生长引起藻类水华[1].细菌等微生物被认为在维持藻类生物量平衡方面起重要作用[2],因其具有经济、便携、环境友好等特点,在控藻领域的研究应用中受到越来越多的关注[3-4].细菌抑制藻类的作用方式主要是通过接触或进入藻细胞内直接进攻宿主,或者同藻类竞争有限营养、分泌胞外物质间接进攻宿主两大类[5].近年来,一些国内学者针对微囊藻进行了微生物控制的研究,筛选出了一系列具有抑制微囊藻效果的细菌[5],其中芽孢杆菌被多数学者筛选分离,逐渐成为研究热点[6-8].
枯草芽孢杆菌是广泛存在于自然界的一种非致命性细菌.目前,国内对其研究大部分集中于发酵条件的优化[9]、抗菌物质在生物防治领域的应用[10],以及作为动物饲料添加剂[11]、水质净化制剂[12]等方面,而在控藻领域的研究尚未见报道.
本实验选用枯草芽孢杆菌,研究其不同生长时期滤液对铜绿微囊藻的抑制效果和抑藻的作用方式,并结合在无菌滤液影响下藻类MDA含量、SOD活性和光合色素含量的变化,分析其抑藻的作用过程,为枯草芽孢杆菌在藻类防控方面提供理论基础和应用指导.
1 材料与方法
1.1 试验菌、藻种来源及培养条件
枯草芽孢杆菌(Bacillus subtilis,GIM1.372),购于广东省微生物研究所微生物菌种保藏中心,培养基为牛肉膏蛋白胨,高温灭菌后使用.菌种经平板活化后接种于液体培养基,在30℃、150r/min恒温摇床中培养12h,备用.
铜绿微囊藻(Microcystis aeruginosa FACHB315),由中国科学院水生生物研究所藻种保藏中心提供.培养基为BG11,高温灭菌后使用.藻种于25℃、光照强度2000lx、光暗比12h:12h恒温培养箱中扩大培养,实验时按所需藻量接种于BG11.
1.2 细菌生长曲线测定
取1mL培养12h的枯草芽孢杆菌菌液添加至装有100mL牛肉膏蛋白胨的250mL锥形瓶中,在30℃、150r/min恒温摇床中培养,定时取样,参照沈等方法,用分光光度计测定OD600值,以培养时间和细菌吸光值绘制生长曲线[13].由于预实验发现取样量过大细菌液体量减少会加快细菌的生长速度,使同一时间OD600值变高,因此测定细菌生长曲线时,准备9个锥形瓶在摇床中同时培养,每次取样3个平行,取样10次换下一批,以此保证生长曲线的可靠性.
1.3 枯草芽孢杆菌不同生长时期滤液对铜绿微囊藻生长的影响
根据1.2节得到枯草芽孢杆菌生长曲线,设定t=2,12,34,52h代表枯草芽孢杆菌生长的延迟期、对数期、稳定期和衰亡期.分别在设定点取细菌菌液,用0.22μm滤膜过滤得到无菌滤液(经平板划线证明无菌),取各期滤液5mL加入100mL初始生长、藻量为1.0×106cells/mL、叶绿素a含量为141.05μg/L的铜绿微囊藻液中,每天取样,用血球计数板计算藻细胞浓度,绘制生长曲线,周期8d.第8d测各实验组藻叶绿素含量.每个处理组设置3个平行.
1.4 枯草芽孢杆菌抑制铜绿微囊藻生长的作用方式
将细菌培养至稳定期,分别取5mL原菌液、离心菌体(10000r/min,4℃,10min离心,弃上清,无菌水冲洗2次)、5mL细菌滤液(0.22μm滤膜抽滤)、5mL高热处理滤液(121℃高压灭菌锅加热20min)加入100mL初始生长、叶绿素a含量为153.09μg/L的铜绿微囊藻液中,测第4d和第8d叶绿素a含量.每个处理组设置3个平行.
1.5 光合色素含量的测定
叶绿素a提取方法采用反复冻融-浸提法[14],取10mL藻液5000r/min、15min离心后弃上清液,将藻样置-20℃冰箱和室温下反复冻融3次,添加90%丙酮溶液10mL浸提20h,浸提后将藻样4000r/min离心15min,分光光度计测上清液630,645,663,750nm处吸光值,根据以下公式[15]计算叶绿素a含量:

式中:V为样品体积(L),μg/L;
类胡萝卜素的测定参照文献[16],由于蓝藻不含叶绿素b,将公式优化计算其含量:
类胡萝卜素(Car)=(1000D470-3.27Ca)× 10/229V;V为样品体积(L),μg/L.
1.6 丙二醛(MDA)和超氧化物歧化酶(SOD)的测定
MDA测定采用硫代巴比妥酸法[16],待测样品制备参照文献[17],根据预实验用反复冻融取代冰浴研磨破碎藻细胞,具体方法为:取一定量藻液5000r/min、4℃离心15min收集藻细胞,加少量磷酸缓冲液(pH7.8)置-20℃冰箱和室内下反复冻融3次,匀浆液8000r/min、4℃离心20min,收集上清液用作MDA含量测定.
SOD活性测定通过SOD WST-1法测定试剂盒(购买自南京建成生物工程研究所),具体参照培养细胞中SOD活性的测定方法.
1.7 分析方法
菌落计数采用平板涂布计数法.藻细胞计数使用血球计数板.
藻的去除率R定义为:R=(1-Ct/C0)×100%,其中,C0为对照组铜绿微囊藻初始浓度,×105cells/mL;Ct为处理组不同时间的藻细胞浓度,×105cells/mL.
实验数据用平均值±标准差(x±s)表示,数据的统计分析用SPSS18.0软件进行.对各实验组的数据作单因素方差分析(one-way ANOVA)和Duncan’S多重比较分析.
2 结果与分析
2.1 枯草芽孢杆菌生长曲线
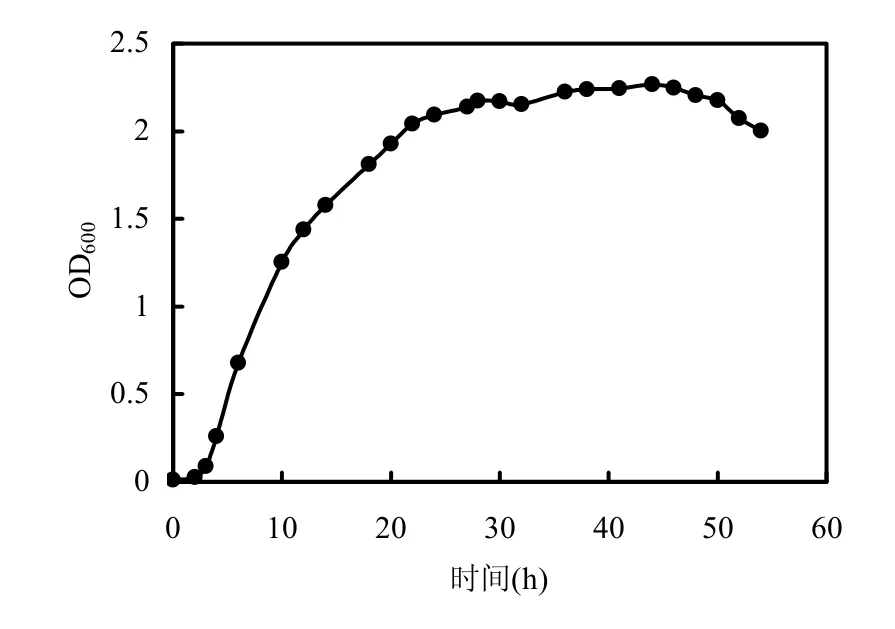
图1 枯草芽孢杆菌生长曲线Fig.1 The growth curve of Bacillus subtilis
由图1可知,枯草芽孢杆菌经过2h左右的延迟期后进入对数期,3~10h生长速率最快,12~22h速率变慢,大约在24h进入稳定期持续至48h,48h后开始衰亡.枯草芽孢杆菌延迟期短,生长速率快,对数期较长,用平板涂布计数法得知细菌在12,34,52h时生物量分别为7.6×108,1.0×109,7.0× 107CFU/cm3.可见,枯草芽孢杆菌能在较短时间达到较大生物量.
2.2 枯草芽孢杆菌不同生长时期滤液对铜绿微囊藻生长的影响
2.2.1 不同生长时期滤液影响下铜绿微囊藻的生长曲线 由图2可知,枯草芽孢杆菌4个生长时期的滤液对铜绿微囊藻的生长均有较好的抑制作用,实验第8d,4个处理组藻量分别为10.30× 105,2.30×105,1.07×105,1.00×105cells/mL,低于对照组的57.50×105cells/mL,差异极显著(P<0.01),推测细菌从延迟期即开始分泌具有抑藻效果的胞外物质.细菌对数期、稳定期和衰亡期处理组的藻量极显著低于延迟期处理组(P<0.01),延迟期处理组藻生长趋势受到滤液影响,藻量变化不大;对数期和稳定期处理组中藻的生长曲线较为接近,实验周期内藻呈现负生长状态,藻量从1.0× 106cells/mL下降到2.30×105cells/mL和1.05× 105cells/mL,对藻有很好的抑制效果,且稳定期处理组藻量极显著低于对数期处理组(P<0.01);衰亡期滤液在加入后的第1d,藻量有所增长,但仍显著低于对照组(P<0.05),第2d藻量开始下降,藻呈现负生长状态,第8d,藻量下降到1.00×105cells/mL,与稳定期处理组无显著差异(P>0.05).衰亡期滤液对藻也有很好的抑制效果.经计算,滤液添加的第1d,延迟期和衰亡期处理组藻量分别增加14%和9.8%,对数期和稳定期处理组藻的去除率分别为2.3%和2%;第4d,4个处理组藻的去除率分别为1.7%、78.7%、69.3%、74.7%;第8d,延迟期处理组藻量增长3%,对数期、稳定期和衰亡期处理组藻的去除率分别为77%、89.5%、90%.延迟期滤液抑藻效果较差,对数期滤液在第4d抑藻效果最好,第8d则不如稳定期和衰亡期.从整体看,稳定期滤液的抑藻效果最稳定.
2.2.2 不同生长时期滤液对藻叶绿素a含量的影响 由图3可知,受到枯草芽孢杆菌滤液的影响,铜绿微囊藻的叶绿素a含量明显降低,且极显著低于对照组中藻叶绿素a含量(P<0.01),说明在滤液的作用下,铜绿微囊藻的光合作用受到严重影响.实验初始叶绿素a含量为141.05μg/L,第8d时,对照组叶绿素a含量为511.07μg/L,延迟期处理组为97.55μg/L,对数期处理组为87.38μg/L,稳定期处理组为69.39μg/L,衰亡期处理组为68.95μg/L.其中,延迟期处理组藻叶绿素a含量与对数期处理组差异不显著(P>0.05),极显著高于稳定期和衰亡期处理组(P<0.01),对数期处理组藻叶绿素a含量显著高于稳定期和衰亡期处理组(P<0.05),稳定期和衰亡期处理组藻叶绿素a含量差异不显著(P>0.05).

图2 枯草芽孢杆菌不同生长时期滤液对铜绿微囊藻生长的影响Fig.2 Effects of B.subtilis filtrate in different growth periods on the growth of M.aeruginosa

图3 枯草芽孢杆菌不同生长时期滤液对铜绿微囊藻叶绿素a含量的影响Fig.3 Effects of B.subtilis filtrate in different growth periods on the Chl a content of M.aeruginosa不同字母代表组间差异显著P<0.05
2.3 枯草芽孢杆菌抑制铜绿微囊藻生长的作用方式
从图4可以看出,枯草芽孢杆菌滤液、原菌液、高热处理的滤液对藻叶绿素a含量影响极显著,3个处理组藻的叶绿素a含量在第4d分别为91.47,135.73,90.82μg/L,第8d分别为59.78,81.73,56.60μg/L,比较实验初始的153.09μg/L,叶绿素a含量明显降低;而对照组在第4d和第8d分别上升至318.03μg/L和604.60μg/L.其中,高热处理滤液和滤液处理组中藻的叶绿素a含量差异不显著(4、8d:P>0.05),并且这两个处理组在第4d时藻的叶绿素a含量均显著低于原菌液处理组(P<0.05).但是实验显示添加枯草芽孢杆菌离心菌体时,铜绿微囊藻第4,8d的叶绿素a含量分别为361.83,959.75μg/L,均显著高于对照组(4d:P<0.05、8d:P<0.01),结合原菌液处理组叶绿素a含量也高于滤液和高热滤液处理组,可以说明枯草芽孢杆菌存在时,铜绿微囊藻的生长确实被促进,但具体原因不明.同时,第8d数据分析显示,原菌液处理组与高热处理滤液、滤液处理组的藻叶绿素a含量并无显著差异(P>0.05),这可能是因为原菌液中含有的抑藻物质作用效果比藻受到的促进作用影响程度更大、持续时间更长.因此,本实验说明,枯草芽孢杆菌的抑藻效果是通过分泌胞外物质实现,且该分泌物具有很强的热稳定性.
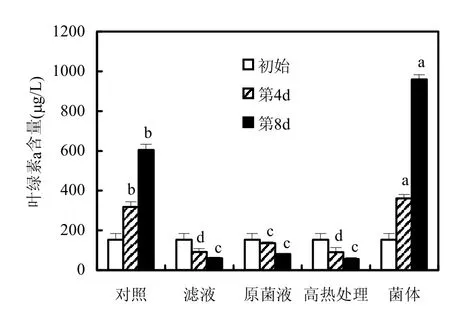
图4 枯草芽孢杆菌培养液不同处理方式对铜绿微囊藻叶绿素a含量的影响Fig.4 Effects of B.subtilis culture liquid with different treated methods on the Chl a content of M.aeruginosa不同字母表示同一天组间比较差异显著P<0.05
2.4 MDA含量的测定
MDA是反映藻细胞膜脂过氧化程度的重要指标[16].图5显示加入枯草芽孢杆菌稳定期滤液后,铜绿微囊藻MDA含量的变化.实验第1d,滤液组铜绿微囊藻的MDA含量比对照组提高59%(P<0.01),实验第8d,比对照组提高918%(P<0.01),滤液组藻的MDA含量显著升高.对照组铜绿微囊藻的MDA含量始终保持在较低水平,但第1d比第8d略高(P<0.05),这可能是因为接种于新的培养基,藻细胞在新环境中发生氧化应激反应造成MDA含量略微升高[18].该实验结果说明枯草芽孢杆菌的胞外分泌物质对铜绿微囊藻的膜脂过氧化作用效果十分明显且过氧化程度不断加深.
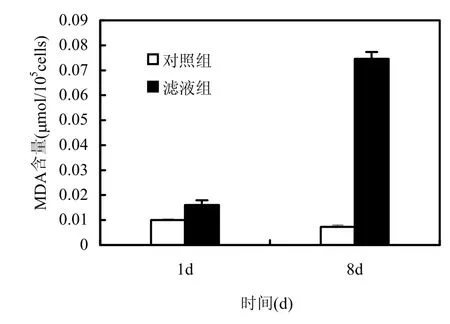
图5 枯草芽孢杆菌滤液对铜绿微囊藻MDA含量的影响Fig.5 Effects of B.subtilis filtrate on the MDA content of M.aeruginosa
2.5 SOD活性的测定
图6显示加入枯草芽孢杆菌稳定期滤液后,铜绿微囊藻SOD活性的变化.SOD是藻细胞为防止过氧化损伤产生的保护性酶[18].实验第1d,滤液组铜绿微囊藻的SOD活性显著升高,比对照组提高159%(P<0.01),实验第8d,其活性相比第1d明显降低,但仍比对照组高63%(P<0.01),对照组藻的SOD活性始终保持在较低水平.该实验结果说明,铜绿微囊藻在受到枯草芽孢杆菌的胞外分泌物质损伤时,会通过提高抗氧化酶活性来增强对活性氧的清除能力,防止藻细胞发生膜脂过氧化.但由于铜绿微囊藻受到的氧化损伤过大,SOD活性在第8d反而比第1d有所降低.
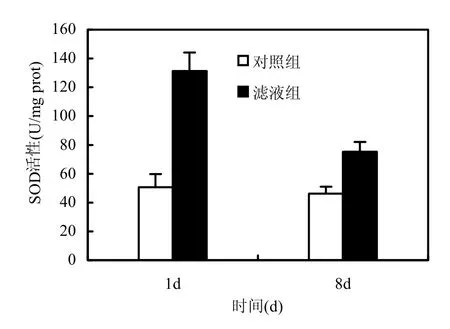
图6 枯草芽孢杆菌滤液对铜绿微囊藻SOD活性的影响Fig.6 Effects of B.subtilis filtrate on the SOD activity of M.aeruginosa
2.6 光合色素含量的变化
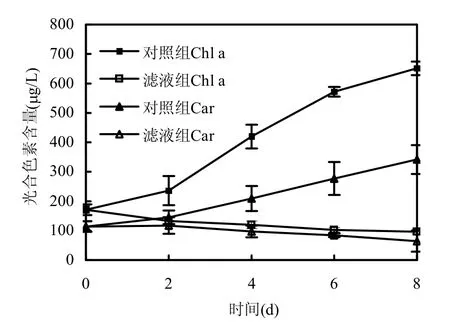
图7 枯草芽孢杆菌滤液对铜绿微囊藻光合色素含量的影响Fig.7 Effects of B.subtilis filtrate on the photosynthetic pigments content of M.aeruginosa
图7显示加入枯草芽孢杆菌稳定期滤液后,藻的叶绿素a和类胡萝卜素含量的变化情况.从图中可以看出,滤液组中铜绿微囊藻两种色素含量均受到严重影响,且影响效果随着时间延长显著增加,类胡萝卜素受到的影响程度小于叶绿素a.数据显示,滤液组中叶绿素a含量从170.69μg/L下降至96.69μg/L,对照组则上升至651.23μg/L,第4,6,8d时,其含量相比对照组分别减少71.48%、82.04%、85.15%,影响效果极显著(P<0.01);类胡萝卜素受到的影响较小,滤液组中其含量从114.01μg/L下降到64.12μg/L,对照组则上升至341.50μg/L,第4,6,8d时,其含量相比对照组分别减少53.56%、69.54%、81.22%,只有第8d的影响效果极显著(P<0.01).
3 讨论
3.1 枯草芽孢杆菌抑藻的作用方式
近年来,有关芽孢杆菌抑藻效果的报道越来越多,宁华等[6]在滇池中分离得到28株芽孢杆菌,发现其中6株有较好的抑藻效果,且抑藻效果都是通过分泌胞外物质实现.Nobuyuki等[19]、马宏瑞等[8]通过实验证明分离得到的芽孢杆菌是通过分泌胞外物质实现抑藻效果.也有报道,蜡样芽胞杆菌是通过直接接触的方式进攻宿主水华束丝藻[20],短小芽孢杆菌能同时通过分泌胞外物质和直接接触藻细胞两种方式抑制微囊藻、束丝藻和鱼腥藻[7].可见不同芽孢杆菌对于不同的水华藻类有不同的作用方式,但就目前的资料来看,芽孢杆菌对于微囊藻属的藻类主要还是通过间接方式抑藻[6].本实验中,枯草芽孢杆菌对铜绿微囊藻的抑制效果也是通过分泌胞外物质间接实现.研究发现,枯草芽孢杆菌在生长代谢过程中,能分泌多种细菌素,而且一般是环肽[21].其中枯草菌素是研究较深的一种细菌素,具有抗酸抗热的特性[22].据报道[23],含有10mg/L的枯草菌脂肽(产生于多种芽孢杆菌的环状脂肽)培养基,可以在2d内去除85%的微囊藻,鱼腥藻也可被去除70%.钱常娣等[24]从枯草芽孢杆菌发酵上清液提取出一种脂肽类化合物,表明其具有热稳定性且耐受较广的pH值范围.此外,本实验发现,延迟期滤液对藻生长虽然有抑制作用,但因为该时期细菌生物量较小且处于生长过渡阶段,细菌代谢活动能力较弱,胞外分泌物浓度较低,所以对藻的生长影响较小;从对数期开始,细菌生物量显著增加,代谢活动能力明显增强,胞外分泌物浓度较高,因此对数期之后滤液对藻的生长影响较大;同时,由于细菌代谢产物的积累,所以稳定期滤液效果好于对数期;而衰亡期滤液与稳定期和对数期有所不同,这可能是因为细菌在衰亡阶段,有毒物质积累,生长环境改变,细菌代谢产物的种类与之前有了较大差异.枯草芽孢杆菌在不同生长时期,代谢能力和代谢产物有所不同,造成了各时期滤液对藻生长的影响不同,因此表现出对藻去除率的差异.该结果与马宏瑞等[8]研究结果一致.
3.2 枯草芽孢杆菌对铜绿微囊藻MDA含量、SOD活性的影响
MDA是细胞膜脂过氧化作用的产物之一,其产生数量的多少代表细胞膜脂过氧化的程度,也间接反映膜系统受氧化损伤程度[16].罗固源等[25]发现铜绿微囊藻在菌株S7无菌滤液的作用下,其MDA含量的升高和藻细胞结构的损伤具有一致性,他们发现随着细胞膜脂过氧化程度加深,藻细胞结构发生变形并伴有膜壁分离现象.本试验中,滤液组铜绿微囊藻MDA含量显著升高,对照组始终保持在较低水平,说明滤液组铜绿微囊藻藻受氧化胁迫细胞膜脂过氧化作用十分明显且过氧化程度不断加深,这一现象与史顺玉[17]研究结果相似,该研究发现加入抑藻细菌能够引起铜绿微囊藻的活性氧积累,并激活藻细胞的抗氧化系统,如果植物细胞不能清除过量的活性氧,则会造成细胞膜脂过氧化程度加剧,进而损伤其膜功能和结构,最终导致一系列生理生化过程的改变.SOD是抗氧化系统中清除活性氧的重要酶类,普遍存在于动植物与微生物体内,能够清除超氧阴离子自由基,防御活性氧或其他过氧化物自由基对细胞膜系统的伤害[16].本试验中,滤液组铜绿微囊藻SOD活性先升高后降低,该结果与牛丹丹等[26]研究结果相似.已有报道[27],植物在轻度环境胁迫下,SOD活性会有所升高,以清除活性氧保护细胞膜系统;但在重度环境胁迫下,SOD活性反而会大幅度下降.这可能是因为SOD受到其歧化反应生成的H2O2和O2的浓度的影响导致活性降低[17].因此,可以推测枯草芽孢杆菌抑制铜绿微囊藻的作用过程为:一方面细菌的胞外分泌物使藻细胞产生大量活性氧,发生膜脂过氧化,藻细胞为清除活性氧表现出提升SOD活性的自我保护能力;另一方面随着时间的延长,细菌的胞外分泌物对藻细胞伤害程度加深、作用时间长,超出了藻细胞的自我保护能力,SOD活性下降,活性氧累积,进一步加深膜脂过氧化程度,最终导致藻细胞的完整性被破坏.
3.3 枯草芽孢杆菌对铜绿微囊藻光合色素含量的影响
光合色素是藻类进行光合作用的物质基础,其含量变化能较好的反映藻各阶段生长发育情况正常与否,也间接反映出藻生物量的多少[28].叶绿素是植物进行光合作用主要色素,由于蓝藻不含叶绿素b,本实验统一用叶绿素a作为显示藻量和藻光合作用能力的指标.而类胡萝卜素除参与光传递过程外,还可以吸收剩余光能、猝灭活性氧,保护叶绿素和光合机能[29].从本实验的结果可以看出,枯草芽孢杆菌滤液对铜绿微囊藻光合作用影响显著,其原因可能是细菌的胞外分泌物使藻产生大量活性氧,在促使藻细胞发生膜脂过氧化的同时,也极易进攻光合色素及与之结合的类囊体膜[30].并且,大量存在的活性氧会改变光合电子传递链的氧化还原态,影响相关核基因的表达,使叶绿素定位受到干扰,导致自由状态的叶绿素被降解,最终降低光合效率和叶绿素含量[31].这一过程中,由于类胡萝卜素的保护机制,受到滤液的影响更不显著.该结果与相关研究[32-33]结果类似.另一方面,由于藻细胞膜脂过氧化程度不断加深,藻细胞的完整性被破坏,导致叶绿素被破坏.这一过程则直接表现为藻生物量的降低.本实验发现,延迟期处理组铜绿微囊藻的叶绿素a含量从初始141.05μg/L降低至97.55μg/L,而藻量变化不大,说明在滤液的作用下,铜绿微囊藻的光合作用受到抑制,这一作用比藻细胞数量的变化更明显.原因可能是细菌的胞外分泌物浓度还不足以完全破坏藻细胞,藻细胞叶绿素a有所降解,但保留一定的光合作用功能.相关研究[34]也有类似发现.所以,延迟期处理组藻量虽然大于对数期处理组,但叶绿素a含量的比较并无显著差异;而对数期、稳定期和衰亡期3个处理组之间叶绿素a含量的比较和藻量的比较则具有一致性.
此外,本实验在探讨枯草芽孢杆菌抑藻的作用方式时,出现离心菌体处理组铜绿微囊藻生长受到促进的情况.实验发现,将等量的枯草芽孢杆菌离心菌体加入BG11培养基时,其生物量从1.0×107CFU/cm3到第8d依次递减为:5.5×106,3.0×106,1.8×106,6.2×105,4.6×105,3.2×105,1.3×105,1.1×103CFU/cm3,可以看出枯草芽孢杆菌在铜绿微囊藻适应的环境中因无法正常生长而大量死亡,但是否由于细菌死亡裂解释放物质导致藻生长的促进,本实验无法定论.所以,本实验可证明枯草芽孢杆菌能通过分泌胞外物质抑制铜绿微囊藻生长,但有关细菌与藻存在的其它作用关系,还有待进一步研究.
4 结论
4.1 枯草芽孢杆菌不同生长时期滤液对铜绿微囊藻的生长均有抑制效果,其中稳定期滤液对藻的去除效果最佳;细菌滤液严重影响铜绿微囊藻光合作用,使其光合色素含量降低.
4.2 枯草芽孢杆菌对铜绿微囊藻的抑制效果是通过分泌胞外物质实现的,且该物质具有很强的热稳定性.
4.3 枯草芽孢杆菌滤液添加后,铜绿微囊藻MDA含量明显升高,说明藻受滤液影响发生膜脂过氧化;铜绿微囊藻SOD活性先升高后降低,是由于藻细胞的氧化损伤过大,SOD受到其歧化反应生成物浓度的影响,导活性降低.
[1]Steinberg C E W,Hartmann H M.Planktonic bloom-forming cyanobacteria and the eutrophication of lakes and rivers[J].Freshwater Biology,1988,20(2):279-287.
[2]赵以军,刘永定.有害藻类及其微生物防治的基础——藻菌关系的研究动态[J].水生生物学报,1996,20(2):173-181.
[3]汪 辉,刘兆普,魏 巍,等.一株溶藻菌的分离、鉴定及其溶藻物质的研究[J].中国环镜科学,2008,28(5):461-465.
[4]Fu L,An X L,Li D,et al.Isolation and alga-inhibiting characterization of Vibrio sp.BS02 against Alexandrium tamarense[J].World J.Microbiol.Biotechnol.,2011,27:2949-2956.
[5]邓建明,陶 勇,李大平,等.溶藻细菌及其分子生物学研究进展[J].应用与环境生物学报,2009,15(6):895-900.
[6]宁 华,张荣先,陈 浩,等.滇池中芽孢杆菌的ARDRA分类及溶藻特性[J].湖泊科学,2008,20(5):675-680.
[7]卢兰兰,李根保,沈银武,等.溶藻细菌DC-L5的分离、鉴定及其溶藻特性[J].水生生物学报,2009,33(5):860-865.
[8]马宏瑞,章 欣,王晓蓉,等.芽孢杆菌Z5溶铜绿微囊藻特性研究[J].中国环境科学,2011,31(5):825-833.
[9]代 阳,魏 利,王继华,等.枯草芽孢杆菌发酵条件优化及其破乳效能[J].微生物学通报,2010,37(4):580-585.
[10]黄 曦,许兰兰,黄荣韶,等.枯草芽孢杆菌在抑制植物病原菌中的研究进展[J].生物技术通报,2010(1):24-29.
[11]沈斌乾,陈建明,郭建林,等.饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响[J].水生生物学报,2013,37(1):48-53.
[12]张峰峰,谢凤行,赵玉洁,等.枯草芽孢杆菌水质净化作用的研究[J].华北农学报,2009,24(4):218-221.
[13]沈 萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,2002.
[14]林少君,贺立静,黄沛生,等.浮游植物中叶绿素a提取方法的比较与改进[J].生态科学,2005,24(1):9-11.
[15]国家环境保护总局.水和废水监测分析方法[M].北京:中国环境科学出版社,2006.
[16]张蜀秋.植物生理学实验技术教程[M].北京:科学出版社,2011.
[17]史顺玉.溶藻细菌对藻类的生理生态效应及作用机理研究[D].武汉:中国科学院水生生物研究所,2006.
[18]Shi Shunyu,Tang Dongshan,Liu Yongding.Effects of an algicidal bacterium Pseudomomas mendocina on the growth and antioxidant system of Aphanizomenon flos-aquae[J].Current Microbiology,2009,59(2):107-122.
[19]Nobuyuki Nakamura,Kazunori Nakano,Norio Sugiura,et al.A novel Cyanobacteriolytic Bacterium,Bacillus cereus,Isolated from a Europhic Lake[J].Bioscience and Bioengineering,2003,95(2):179-184.
[20]Shi Shunyu,Liu Yongding,Shen Yinwu,et al.Lysis of Aphanizomenon flos-aquae(Cyanobacterium)by a bacterium bacillus cereus[J].Biological Control,2006,(39):345-351.
[21]刘 雪,穆常青,蒋细良,等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J].中国生物防治,2006,22(增刊):179-184.
[22]罗秀针.枯草芽抱杆菌FB123产生的枯草菌素的研究[D].福州,福建师范大学,2008.
[23]Ahn Chi-Yong,Joung Seung-Hyun,Jeon Jong-Woon,et al.Selective control of cyanobacteria by surfactin-containing culture broth of Bacillus subtilis C1[J].Biotechnology Letters,2003,25(14):1137-1142.
[24]钱常娣,李宝庆,赵 添,等.枯草芽孢杆菌BAB21脂肽类化合物的分离及稳定性分析[J].中国农业科技导报,2009,11(6):69-74.
[25]罗固源,刘 静,王金霞,等.一株溶藻细菌对铜绿微囊藻的溶藻机理初探[J].生态环境学报,2010,19(11):2647-2651.
[26]牛丹丹,郑青松,刘兆普,等.溶藻细菌YZ对铜绿微囊藻的溶藻特性研究[J].中国环境科学,2011,31(2):321-326.
[27]唐学玺,李永祺.久效磷对海洋微藻毒性机理的初步研究III.超氧化物歧化酶和过氧化物酶活性的变化[J].环境科学学报,1998,18(2):204-207.
[28]陈柳芳.三种喹诺酮类抗生素对斜生栅藻的毒性效应[D].长春:东北师范大学,2010.
[29]刘碧云,周培疆,吴振斌,等.焦酚对蓝藻和绿藻生长、光合色素及微量元素的作用[J].武汉大学学报,2008,54(6):719-724.
[30]刘碧云,周培疆,李佳洁,等.丙体六六六对斜生栅藻生长及光合色素和膜脂过氧化影响的研究[J].农业环境科学学报.2006,25(1):204-207.
[31]Koussevitzky S,Nott A,Mockler T C,et al.Signals from chloroplasts converge to regulate nuclear gene expression[J].Science Signalling,2007,316(5825):715-719.
[32]杨弯弯,武氏秋贤,吴亦潇,等.恩诺沙星和硫氰酸红霉素对铜绿微囊藻的毒性研究[J].中国环境科学,2013,33(10):1829-1834.
[33]陈 群.溶藻细菌L7对铜绿微囊藻的溶藻效应及机理[D].广州:华南理工大学,2010.
[34]赵 玲,陈淼银,尹平河,等.细菌B1胞外活性物质对球形棕囊藻的溶藻机制初探[J].环境科学学报,2013,33(5):1286-1291.
Inhibition of Microcystis aeruginosa by Bacillus subtilis.
ZHANG Rui1,2,WANG Guang-jun1*,LI Zhi-fei1,YU Er-meng1,XIA Yun1(1.Key Laboratory of Tropical and Subtropical Fishery Resource Application and Cultivation,Ministry of Agriculture,Pearl River Fishery Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510380,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China).China Environmental Science,2015,35(6):1814~1821
To investigate the inhibition of Bacillus subtilis against Microcystis aeruginosa,the bacterium-free filtrate of B.subtilis culture from different growth periods(delayed,log,stable and decline phase)were used to study its inhibition and mode of action against M.aeruginosa.The MDA,SOD activity and the photosynthetic pigments content in M.aeruginosa were measured.The results showed that the inhibition of M.aeruginosa by the B.subtilis filtrate was greater in log phase,stable phase and decline phase than that in delayed phase with removing efficiency of 81.19%,91.41%and 91.82%,respectively on day 8.The chlorophyll a contents of M.aeruginosa in treated groups were significantly lower than that in the control group.The MDA contents increased obviously in treated group and the SOD activity increased first and then decreased when M.aeruginosa was cultured in the filtrate-containing medium.Carotenoids were not affected as much as chlorophyll a.Results showed that B.subtilis inhibited the growth of the algae by secreting extracellular substances.And these substances were highly thermal-stable.It was speculate that the substances can hinder the photosynthesis by destroying the photosynthetic pigments and increase the membrane lipid peroxidation by inhibiting the SOD activity at the same time,resulting in inhibition of M.aeruginosa.
Bacillus subtilis;Microcystis aeruginosa;inhibition;chlorophyll a;MDA
S946.3,X17
A
1000-6923(2015)06-1814-08
张 睿(1991-),男,福建清流人,上海海洋大学硕士研究生,主要从事水产动物健康养殖研究.
2014-10-20
“十二五”农村领域国家科技计划课题(2012BAD25B01)
* 责任作者,副研究员,wgj5810@163.com

