花色素对白血病K562细胞增殖和凋亡影响的研究
朱文慧冯欣桐孙唯秀李述杨磊张冰兵侯毅鞠
(1.吉林医药学院检验学院,吉林吉林 132013;2. 吉林医药学院检验学院血液检验教研室,吉林吉林 132013)
花色素对白血病K562细胞增殖和凋亡影响的研究
朱文慧1冯欣桐1孙唯秀1李述1杨磊1张冰兵1侯毅鞠2*
(1.吉林医药学院检验学院,吉林吉林 132013;2. 吉林医药学院检验学院血液检验教研室,吉林吉林 132013)
目的:研究花色素对K562细胞增殖及凋亡的影响。方法:采用细胞体外培养技术,台盼蓝拒染、MTT法检测细胞增殖抑制率;显微镜观察细胞形态学变化;AnnexinV/PI双标记流式检测细胞凋亡的特征。结果:台盼蓝拒染、MTT检测显示花色素对K562细胞具有增殖抑制作用,并且与时间、浓度呈正相关;显微镜下直接观察到花色素高浓度组细胞分散,胞体减小,凋亡细胞明显增多;流式细胞仪检测到高浓度花色素组K562细胞凋亡率高于对照组。结论:花色素对K562细胞具有增殖抑制作用,并且能够促进K562细胞凋亡。
花色素 K562细胞 增殖 凋亡
白血病是一种造血系统的恶性肿瘤,我国白血病发病率约为2.76/ 10万。白血病的发生是由于血细胞增殖失控,分化成熟受阻,正常凋亡程序失调,导致异常分化细胞大量增殖所引起[1]。花色素是植物中广泛存在的多酚类化合物的总称,是一种天然食用色素,安全无毒,而且具有一定营养和药理作用,有研究表明花色素对人乳腺癌、前列腺癌、结肠癌等肿瘤细胞具有生长抑制作用[2-4],且对机体无明显不良反应。近年来有研究发现花色素能抑制白血病细胞增殖、促进白血病细胞凋亡,能增加化疗药物的敏感性和逆转耐药等[5]。K562细胞是一种分化极差、恶性程度较高的人红白血病细胞株,在体外可被多种诱导剂诱导发生凋亡、分化和增殖抑制[6-8],是临床和基础领域中筛选新的抗肿瘤药物的常用模型。在此研究背景下,本课题采用不同浓度的花色素对K562细胞作用,分别检测其对K562细胞增殖、凋亡的作用,为临床应用花色素抗白血病治疗提供可靠的理论依据。
1 材料和方法
1.1 材料限公司;台盼蓝染液购于上海碧云天生物技术有限公司;MTT试剂盒购于武汉博士生物工程有限公司;annexin V/PI试剂盒购于上海碧云天生物技术有限公司;SM-3型酶标分析仪(北京天石天力医疗器械技术开发中心);倒置相差显微镜(Olympus公司);流式细胞仪EPICS XL(美国Beckman Coulter公司);CO2细胞培养恒温箱

表1 花色素作用48h后台盼蓝染色法计数活细胞数(n=4)
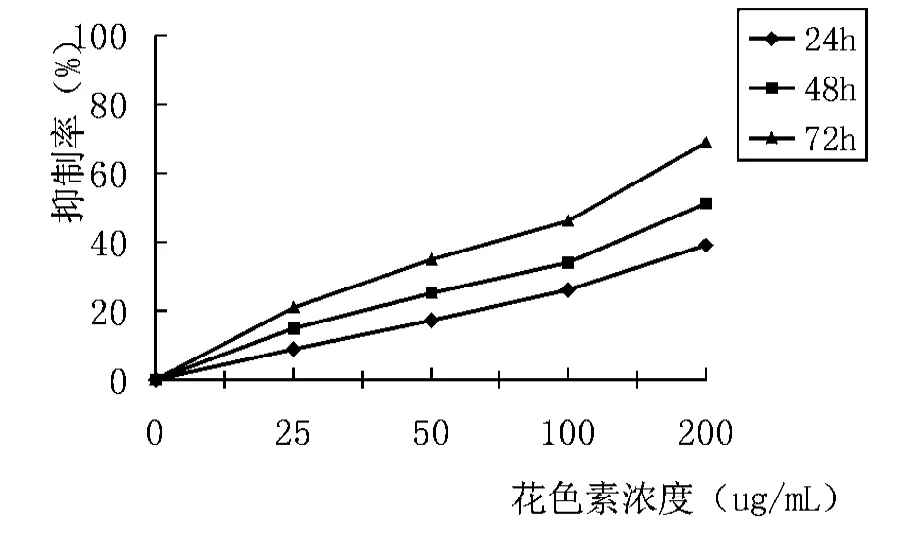
图1 不同浓度的花色素对K562细胞的抑制率
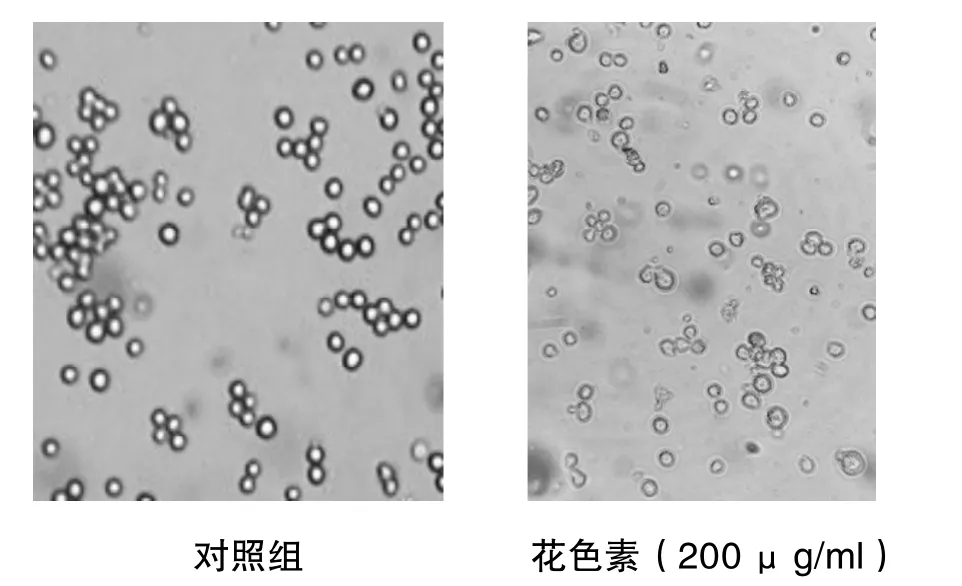
图2 K562细胞生长状态

图3 对照组与高浓度药物组K562细胞各期细胞数
花色素购于长春德尔塔生物技术有限公司;RPMI-1640培养基购于美国GIBCO公司;新生牛血清购于杭州四季青生物工程材料有(美国 Forma Scientific公司); K562细胞为吉林医药学院检验学院冻存细胞。
1.2 方法
1.2.1 台盼蓝染色实验
取对数生长期的K562细胞,以每孔9×108/L密度接种于24孔板中,将其分成5组,每组平行设置4个复孔,分别加入不同浓度的花色素,终浓度分别为0μg/mL、25μg/mL、50μg/mL、100μg/mL、200μg/mL(后续试验药物处理均依照此浓度分组),培养48h后采用台盼蓝拒染法计数活细胞数。
1.2.2 MTT法检测
取对数生长期的K562细胞,以每孔9×108/L密度接种于24孔板中,分别在加药24h、48h、72h后加入MTT溶液10μL,37 ℃继续培养4h,终止培养,离心1000 r/min,5 min,弃去孔内培养液,每孔加入100μL Formazan 溶解液,振荡10 min,用酶标分析仪在570nm波长下测各孔吸光度,按下列公式计算抑制率,IR% = (1-试验组平均A值/对照组平均A值)×100%。
1.2.3 显微镜观察细胞形态变化
取对数生长期的K562细胞,以每孔9×108/L密度接种于24孔板中,将其分成5组,每组平行设置4个复孔,药物处理48h后,于倒置显微镜下观察细胞状态并拍照。
1.2.4 用流式细胞仪检测细胞凋亡
取对数生长期的K562细胞,以每孔9×108/L密度接种于24孔板中,药物处理48h后,经PBS洗涤,收集细胞。加人FITC标记的AnnexinV室温避光30 min,再加入PI,避光反应5 min,加入适量Bufer处理细胞后,流式细胞仪进行检测(具体步骤参照试剂盒说明书)。
2 结果
2.1 台盼蓝染色实验
随着花色素浓度的增高,细胞生长抑制率也逐渐增加,提示花色素在体外对K562细胞有明确的增殖抑制作用(见表1)。
2.2 MTT法检测
MTT结果进一步证实,花色素能够抑制K562细胞生长,随着浓度从25μg/mL增加到200μg/mL,细胞生长抑制率也逐渐增加(见图1)。
2.3 显微镜观察凋亡细胞形态
对照组:细胞胞体大,呈圆形,聚集成团如葡萄串样,胞浆内未见颗粒。药物组:细胞分散,胞体皱缩,体积减小,凋亡细胞增多且明显,提示花色素对K562细胞有增殖抑制和促进凋亡的作用(见图2)。
2.4 流式细胞仪检测细胞凋亡
流式结果显示,药物处理后的细胞表现为随着药物浓度的增加,凋亡细胞也有相应增多,其中与对照组比较,差异最为显著的是200μg/mL花色素组。该结果进一步验证了花色素对K562细胞促进凋亡的作用(见图3)。
3 讨论
白血病是源自多能造血干细胞水平的血液系统恶性肿瘤,严重危害人类生命健康。根据各种类型白血病的分子学特点,白血病治疗的有效方法在于抑制细胞增殖,促进异常细胞凋亡[9]。因此,寻找既能抑制白血病细胞增殖又能促进白血病细胞凋亡的药物已成为白血病研究的热点之一。
研究表明花色素具有抗肿瘤作用,在抗血液肿瘤治疗中的作用也逐渐引起人们重视[10-11]。本实验作者用不同浓度的花色素诱导
K562细胞,对其增殖抑制情况、形态学、诱导凋亡等方面进行了初步研究。所得到的实验结果如下:台盼蓝拒染和MTT比色实验表明,花色素对 K562细胞有明显的增殖抑制作用,且随着加入花色素浓度的增高和培养时间的延长,细胞增殖抑制越明显;显微镜下观察,细胞形态学显示,花色素高浓度组细胞分散,胞体减小,凋亡细胞明显增多;在流式细胞仪上采用AnnexinV/PI双标记法检测到花色素高浓度组K562细胞凋亡率高于对照组,结果提示花色素可以在体外促进K562细胞凋亡。在以上实验结果的基础上,我们认为花色素可以成为抑制白血病细胞异常增殖和促进白血病细胞凋亡的新药物。综上,花色素通过抑制K562细胞生长,促进K562细胞凋亡而改变白血病细胞异常增殖的肿瘤细胞的生物学特性,具备多项调控功能。随着花色素在抗血液肿瘤治疗中的深入研究,花色素将成为既能抑制白血病细胞增殖,并能促进白血病细胞凋亡的新药物,成为临床理想的非杀伤性治疗血液肿瘤的药物,为白血病治疗方案提供更多、更新的选择。
[1]雷翠蓉,姜蓉,王红宁,等.人参总皂苷对K562细胞的增殖抑制及诱导分化作用[J].激光杂志,2011,32(2):69-73.
[2]Luo LP,Han B,Yu XP,et al.Anti-metastasis activity of black rice anthocyanins against breast cancer:analyses using an ErbB2 positive breast cancer cell line and tumoral xenograft model[J]. Asian Pac J Cancer Prev,2014,15(15):6219-25.
[3]Fan MJ,Wang IC,Hsiao YT,et al.Anthocyanins from black rice(Oryza sativa L.) demonstrate antimetastatic properties by reducing MMPs and NF-κB expressions in human oral cancer CAL 27 cells[J].Nutr Cancer,2015,67(2):327-38.
[4]KAUSAR H,JEYABALAN J,AQIL F,et al.Berry anthocyanidins synergistically suppress growth and invasive potential of human non-small-cell lung cancer cells[J].Cancer Letter,2012,325(1):54-62.
[5]崔建,李晓岩.花青素抗肿瘤作用机制研究进展[J].食品科学,2014,35(13):310-315.
[6]李慧,石华月,储婷,等.丹参酮ⅡA与丹参酮ⅡA磺酸钠对K562细胞的增殖抑制与诱导分化作用[J].华西药学杂志,2011,26(3):226-229.
[7]陈夏静,田吉,何兵,等.复方维甲酸注射液诱导K562分化及凋亡作用[J].中国药理与临床,2011,27(2):64-67.
[8]王一,张玎,连小云,等.曼宋酮E对白血病K562细胞增殖和凋亡的影响[J].中草药Chinese Traditional and Herbal Drugs,2009,40(9):1440-1443.
[9]柯大智,王红宁,陈地龙,等.人参皂苷 Rg1抑制白血病细胞K562增殖并诱导分化的分子机制[J].第三军医大学学报,2014,36(2):125-129.
[10]Li-Shu Wang,Gary D.Stoner. Anthocyanins and their role in cancer prevention[J].Cancer Lett,2008,269(2):281-290.
[11]Lee SH,Park SM,Park SM,et al. Induction of apoptosis in human leukemia U937 cells by anthocyanins through down-regulation of Bcl-2 and activation of caspases[J].Int J Oncol,2009,34(4):1077-83.
吉林省教育厅科学技术研究项目(No. 2012489);2013年吉林省大学生创新创业训练项目
朱文慧(1991—),女(汉族),江苏徐州人,在读本科。
⋆通讯作者:侯毅鞠(1974—),女(汉族),吉林吉林人,副教授,硕士学位,主要从事血液肿瘤相关的研究工作。

