一株携带EGFP基因的重组伪狂犬病毒变异株的构建
童 武,郑 浩,梁 超,刘 飞,曹艳云,李 林,田 青,郑旭晨,单同领,李国新,童光志
(中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
一株携带EGFP基因的重组伪狂犬病毒变异株的构建
童 武,郑 浩,梁 超,刘 飞,曹艳云,李 林,田 青,郑旭晨,单同领,李国新,童光志
(中国农业科学院上海兽医研究所,上海 200241)
本研究运用同源重组的方法,在伪狂犬病毒 (Pseudorabies virus, PRV)变异株 PRV JS-2012 基础上,构建了一株携带增强型绿色荧光蛋白基因的标记重组伪狂犬病毒,命名为rPRV JS-2012-EGFP。经PCR方法鉴定及荧光显微镜观察分析,结果表明重组病毒构建成功,并能在感染细胞中稳定表达绿色荧光蛋白。生长曲线和空斑试验结果显示,rPRV JS-2012-EGFP与亲本株 PRV JS-2012在体外具有相似的生长特性。将 rPRV JS-2012-EGFP 毒接种14日龄PRV阴性仔猪,能使实验猪100%发病,病死率高达40%,表明rPRV JS-2012-EGFP是一株具有强致病力的标记伪狂犬病毒变异株,在伪狂犬病毒变异株致病机制研究中具有一定的使用价值。
伪狂犬病毒;同源重组;重组病毒;绿色荧光蛋白
伪狂犬病是由伪狂犬病毒(Pseudorabies virus,PRV)引起的以发热、奇痒、脑脊髓炎为主要特征的一种烈性传染病[1]。PRV属于疱疹病毒科、α疱疹病毒亚科水痘病毒属,其基因组为线状双链DNA,长约150 kb,由长独特区(UL)、短独特区(US)及US两侧的内部重复序列与末端重复序列组成,编码70多种蛋白[2-5]。伪狂犬病最早发现于美国,中国20世纪60年代初猪群中也出现了PRV流行。猪是PRV的天然宿主、贮存者和传播者[1,6],PRV可感染各个年龄段的猪,主要引起妊娠母猪流产、死胎、木乃伊胎,哺乳仔猪高死亡率[7],种猪不育,严重影响着我国养猪业的健康发展。自2011年以来,我国猪群中出现了PRV变异株,且该变异株毒力较经典PRV毒力明显增强[8-12]。
PRV变异株对仔猪的致病机制,特别是其在猪体内的传播途径和组织分布,至今并不清楚。本研究利用同源重组技术构建了一株携带增强型绿色荧光蛋白(enhanced green fluorescent profei,EGFP)标记的重组伪狂犬病毒,便于直接通过荧光显微镜观察绿色荧光蛋白来判定病毒的存在。
1 材料与方法
1.1 病毒、细胞 伪狂犬病毒变异株(PRV JS-2012)、BHK-21 细胞、Vero 细胞均由上海兽医研究所猪病实验室保存。
1.2 试剂、实验猪 LA Taq DNA 聚合酶、dNTP mix,2×GC Buffer I、 DNA Marker DL-2000 等购自宝生物工程(大连)有限公司;pEGFP-N1、pEGFP-C3和pBluescript SK(+) 购自上海基音生物技术有限公司;大肠杆菌DH5α 感受态购自天根化科技(北京)有限公司;胎牛血清、MEM 和DMEN为Invitrogen 公司产品;AseI、SacI、XhoI、ScaI 和 T4 DNA 连接酶为NEB公司产品;Fugene HD 转染试剂为Promega 公司产品;胶回收试剂盒购自OMEGA 公司;阴性实验猪购自南京某猪场。
1.3 引物 参照 PRV JS-2012 的基因序列,设计了分别用于扩增重组左臂和重组右臂的两对引物:JS+EGFP-LF/JS+EGFP-LR和JS+EGFP-RF/ JS+EGFP-RR。同时,设计一对引物 JS gG 鉴定 up / JS gG 鉴定down ,用于鉴定绿色荧光蛋白是否插入。引物均由上海捷瑞生物科技有限公司合成,序列如表1。

表 1 用于重组臂的扩增和重组病毒鉴定的引物Table 1 The primers for amplifying the reorganization arms and identifying the recombinant virus
1.4 转移载体的构建 通过PCR扩增出位于PRVJS-2012基因组中121 118至122 624位碱基和122 634至124 143位碱基的两条片段,用作同源重组的左、右重组臂,分别位于插入位置两侧(图1)。同时,通过内切酶酶切,从pEGFP-C3质粒中切出CMV启动子-EGFP基因片段,从pEGFP-N1质粒中切出SV40 polyA信号序列片段,并将左重组臂-CMV启动子-EGFP基因-SV40 polyA信号序列-右重组臂依序组装于pBluescript SK(+) 载体中,获得重组转移载体pBG-EGFP。
1.5 病毒核酸的提取 将PRV JS-2012株接种融合单层的BHK-21细胞,待70%~80%的细胞产生病变,将细胞刮下,并将细胞液移入50 mL离心管,1500×g离心 5 min,弃上清,用 TNE 溶液将沉淀细胞重悬。以酚-氯仿法从感染细胞中提取总DNA ,并溶于TE中,于 -30℃保存备用。
1.6 重组病毒的构建 生长于35 mm培养皿中的BHK-21细胞,其密度达到70%~85%时,参照说明书,用Fugene HD 转染试剂将 1.5 提取的 DNA 和1.4中构建的转移载体 pBG-EGFP 共转染至BHK-21细胞中。转染后的细胞置于37℃、CO2培养箱中培养,36 h后出现细胞病变,收获上清。将收集的病毒稀释后,接种融合单层的 Vero 细胞。感染后1 h,吸去感染液,在细胞上铺加含 1% 琼脂糖和 2% FBS 的 MEM 培养基,室温凝固。将接种细胞移入 CO2培养箱中培养,60 h后置于荧光显微镜下观察,标记并挑取有绿色荧光的蚀斑,置于DMEM中。将冻融的蚀斑液接种Vero细胞,进行下一轮蚀斑纯化,直至所有蚀斑均有绿色荧光。
1.7 重组病毒的PCR鉴定 利用 DNA 提取试剂盒提取已纯化的重组病毒 DNA,以该DNA作为模板,用 JS gG 鉴定 up / JS gG 鉴定 down 引物进行 PCR 鉴定。PCR 体系为20μL:2×GC BufferⅡ 10μL、dNTP Mix ( 2.5mmol/mL each) 2 μL、JS gG 鉴定 up0.5μL(10pmol/μ L)、JS gG 鉴定 down 0.5μL(10pmol/μL)、LA-Taq 0.5μ L、ddH2O 4.5 μL、 DNA2 μL。PCR 反应条件: 94℃预变性 5min;94℃变性 30s,66℃退火 30 s,72℃延伸 2 min,循环 35 次;最后72℃延伸 10 min。PCR产物进行 1% 琼脂糖电泳后,在凝胶成像仪中观察。1.8 重组病毒的生物学特性分析 将重组病毒液稀释成10-1~10-10,分别接种至 96孔培养板中长成融合单层的 Vero 上,每个稀释度接种 8 孔,培养板最后两列孔接种稀释液作对照,置37℃、5%CO2的细胞培养箱中培养,96 h后观察细胞病变,按照Reed-Muench法计算病毒的TCID50[12]。重组病毒和其亲本毒均以0.01MOI的毒量接种Vero 细胞,分别在接毒后不同的时间点 (12、24、36、48、60、72、84、96 h) 收取细胞上清液,分别进行病毒的TCID50测定,根据测定结果绘制生长曲线。
将重组病毒和亲本毒均以103TCID50/ mL 分别感染 六 孔板中的1孔细胞,于37℃、5% CO2培养箱中吸附2h,分别加入等体积的琼脂糖和2×MEM,充分混合至温度适合时每孔加入混合液2mL;置于4℃待覆盖层完全凝固,将之倒扣,37℃、5% CO2培养箱中培养4d;经甲醛固定,结晶紫染色后在合适的病毒感染量时即可见典型的空斑形成。
1.9 重组病毒的毒力测定 14日龄阴性仔猪 15 头,随机分为3组,每组5头。第1组分别接种PRV JS-2012强毒 106.0个 TCID502 mL;第2组分别接种重组病毒106.0个 TCID502 mL;第3组分别接种DMEM 2mL。攻毒后每天监测试验猪的体温,并观察临床症状。
2 结果
2.1 转移载体活性验证 将1.4中构建好的转移载pBG-EGFP转染至BHK-21细胞24h后,置于荧光显微镜下观察。结果显示,转移载体中的绿色荧光蛋白在BHK-21细胞中高效表达,结果见图2。

图1 增强型绿色荧光蛋白基因插入位置示意图Fig. 1 Insert sketch map of enhanced green fluorescent protein ( EGFP )
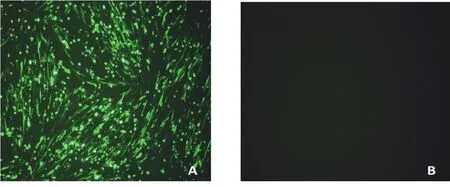
图2 转移载体 pBG-EGFP 活性验证Fig. 2 The validation activity of transfer vector pBG - EGFP
2.2 重组病毒的构建 将1.5中提取的DNA和1.4中构建的转移载体 pBG-EGFP 共转染至生长良好的BHK-21细胞中,置37℃、CO2培养箱中培养,36h后出现细胞病变,收获上清。将病毒上清稀释后,接种融合单层的Vero 细胞做蚀斑纯化。经过4轮蚀斑纯化后得到了较纯的重组病毒,该重组病毒所形成的蚀斑在荧光显微镜下均可见绿色荧光(图3)。将该重组病毒命名为rPRV JS-2012-EGFP。

图3 rPRV JS-2012-EGFP 病毒的蚀斑纯化Fig.3 Plaque purification of rPRV JS-2012-EGFP
2.3 rPRVJS-2012-EGFP病毒的PCR鉴定 利用DNA提取试剂盒提取rPRV JS-2012-EGFP毒及亲本毒 PRV JS-2012 的 DNA,参照 1.7 中的方法进行PCR 扩增。结果显示 PRV JS-2012 毒扩增出 819bp的特异性条带,rPRV JS-2012-EGFP扩增出 2300bp左右的条带(图4)。rPRV JS-2012-EGFP 插入的绿色荧光蛋白的大小为1500 bp左右,与上述PCR结果相符,证实rPRV JS-2012-EGFP构建成功。
2.4 rPRV JS-2012-EGFP 病毒的生物学特性分析 将rPRV JS-2012-EGFP 毒液稀释为10-1~10-10,参照1.8中的方法测定病毒的TCID50,结果表明rPRV JS-2012-EGFP的TCID50为107.5/mL。将rPRV JS-2012-EGFP 毒和其亲本毒 PRV JS-2012 都以 0.01MOI 的毒量接种Vero 细胞,在接毒后每隔 12 h 分别收取细胞上清液,并测定TCID50,根据测定结果绘制生长曲线。结果显示 rPRV JS-2012-EGFPE 毒和亲本毒PRV JS-2012 的生长曲线基本一致(见图5)。空斑形成结果显示, rPRV JS-2012-EGFP 毒和其亲本毒PRV JS-2012 在 Vero 细胞上所形成的蚀斑大小与形态完全一致(见图6)。

图4 rPRV JS-2012-EGFP 的 PCR 鉴定结果Fig.4 PCR detection result of rPRV JS-2012-EGFP
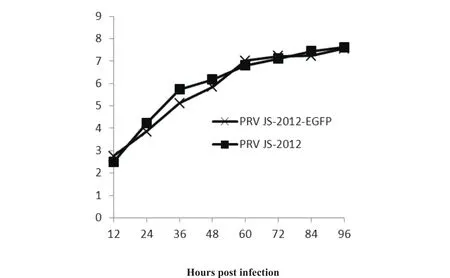
图5 重组病毒 rPRV JS-2012-EGFP 及其亲本毒在Vero 细胞上的多步生长曲线Fig.5 Growth curve of rPRV JS-2012-EGFP and its parental viruses on Vero cells

图6 rPRV JS-2012-EGFP 及亲本毒的蚀斑形态Fig.6 Plaque morphology of rPRV JS-2012-EGFP and its parental viruses
2.5 rPRV JS-2012-EGFP病毒的毒力测定 PRV JS-2012接种组实验猪在攻毒后d 2体温升至 41℃ 以上,攻毒后d 4出现死亡,d 5全部死亡。rPRV JS 2012-EGFP接种组在攻毒后d2体温均升至41℃以上,持续 41℃高烧 4d后体温开始下降,攻毒后d8和d9各死亡1头猪(图7和图8)。

图7 rPRV JS-2012-EGFP和 PRVJS-2012攻毒后猪的体温变化Fig.7 Body temperature changes of piglets post infection with rPRV JS-2012-EGFP and PRV JS-2012

图8 攻毒后各组猪不同时间的存活情况Fig.8 Mortality of piglets post infection with rPRV JS-2012-EGFP and PRV JS-2012
3 讨论
同源重组技术是一项很经典的基因工程技术,在伪狂犬病毒上应用的非常成熟。国内很多科研工作者通过该方法均可有效的在病毒基因组中插入,替换缺失目的基因[13-15]。
本研究在伪狂犬病毒变异株PRV JS-2012的基础上,利用同源重组技术,构建了一株含绿色荧光标记的重组伪狂犬病毒变异株rPRV JS-2012-EGFP。为了保持PRV原有的特性,本研究将绿色EGEP插在gG基因后面。gG蛋白是PRV的非结构蛋白,成熟的PRV病毒粒子中不含gG蛋白,gG蛋白主要分布于感染细胞的培养基中。gG蛋白对于病毒的毒力、吸附、穿入以及细胞间的扩散均是非必需的[16]。本研究中插入的绿色荧光蛋白携有独立的CMV启动子及SV40 polyA终止序列,尽可能的不影响其他基因的功能。经生物学特性验证rPRV JS-2012-EGFP 毒与亲本毒PRV JS-2012基本一致,且动物实验结果表明rPRV JS-2012-EGFP毒仍然是一株强毒,对仔猪仍具有很强的致病力。
病毒感染仔猪后用rPRV JS-2012-EGFP ,定期剖杀,取组织脏器涂片后,通过荧光显微镜观察即可了解组织脏器的病毒感染情况。本研究结果为PRV变异株感染仔猪的机制及病毒在猪体内的感染途径,提供了直观、简便、快捷的手段。
[1]殷震, 刘景华. 动物病毒学[M]. 2版. 北京: 科学出版社,1997: 700-713.
[2]Ben-Porat T, Kaplan A S. Molecular biology of pseudorabies virus [M] // Roizman B. The Herpesviruses, Plenum press. 1985: 105-173.
[3]Klupp, B G, Hengartner C J, Mettenleiter T C, et al. Complete, annotated sequence of the pseudorabies virus genom[J]. J Virol, 2004,78(1): 424 - 440.
[4]Granzow H, Klupp B G, Fuchs W, et al. Egress of alphaherpesviruses: comparative ultrastructural study[J]. J Virol 2001,75(8): 3675-3684.
[5]Mettenleiter T C. Aujeszky's disease (pseudorabies) virus: the virus and molecular pathogenesis - state of the art, June 1999[J] Vet Res, 2000, 31(1): 99-115.
[6]斯特劳 B E, 阿莱尔 S D , 蒙加林 W L, 等. 猪病学[M]. 8版.北京:中国农业大学出版社, 2000: 195-196.
[7]童武, 郑浩, 单同领, 等.伪狂犬病毒变异株(JS-2012)对仔猪的致病性研究[J].中国动物传染病学报,2014,22(5): 10-14.
[8]彭金美, 安同庆, 赵鸿远, 等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报, 2013,35(1):1-4.
[9]An T Q, Peng J M, Tian Z J, et al. Pseudorabies Virus Variant in Bartha-K61-Vaccinated Pigs, China, 2012[J]. Emerging Infects Dis, 2013, 19(11):1749-1755.
[10]Wu R , Bai C H J Z Sun J Z, et al. Emergence of virulent pseudorabies virus infection in Northern China[J]. J Vet Sci 2013, 14(3): 363-365.
[11]Yu XI Zhou , Hu D, et al. Pathogenic Pseudorabies Virus,China, 2012[J]. Emerg Infectious Dis, 2014, 20(1):102-104.
[12]童武, 张青占, 郑浩, 等.免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J].中国动物传染病学报,2013, 21(3): 1-7.
[13]周复春, 陈焕春, 方六荣, 等.伪狂犬病病毒鄂A 株gG- / LacZ+ 突变株的构建[J]. 畜牧兽医学报,2001, 32(2)129- 133.
[14]方六荣, 周复春, 陈焕春, 等.伪狂犬病病毒鄂A株TK- / LacZ+ 突变株的构建[J].畜牧兽医学报, 2001, 32: (3): 244-248.
[15]张辉, 方六荣, 赵骞, 等.伪狂犬病毒UL14基因缺失突变株的构建及其生物学特性研究[J].畜牧兽医学报, 2007, 38(4): 369-375.
[16]韦平, 秦爱建.重要动物病毒分子生物学[M]. 北京: 科学出版社, 2008: 501-516.
CONSTRUCTION OF A RECOMBINANT PSEUDORABIES VIRUS VARIANT EXPRESSING EGFP
TONG Wu, ZHENG Hao, LiANG Chao, LIU Fei, CAO Yan-yun, LI Lin, TIAN Qing,
ZHENG Xu-chen, SHAN Tong-ling, LI Guo-xin, TONG Guang-zhi(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241,China)
An enhanced green fluorescent protein (EGFP) expression cassette was homologously recombined into the genome of a virulent Pseudorabies virus (PRV) variant strain PRV JS-2012, generating a recombinant PRV strain rPRV JS-2012-EGFP. The insert of EGFP gene were confirmed by PCR, and green fluorescence proteins were stably expressed in the cultured cells infected with rPRV JS-2012-EGFP by green fluorescence microscopy analysis. The assays of growth curve and plaque morphology revealed that rPRV JS-2012-EGFP showed similar virological properties to its parent strain PRV JS-2012. 14-day old piglets free of PRV antibodies were inoculated with rPRV JS-2012-EGFP. The morbidity of the infected piglets reached 100%, and the mortality reached 40%. These results showed that rPRV JS-2012-EGFP was a virulent marker PRV and could be utilized to study pathogenic characterization of PRV variant.
Pseudorablies virus; homologous recombination; recombinant virus; green fluorescent protein
S852.659.1
A
1674-6422(2015)04-0001-07
2015-05-15
上海市自然科学基金项目(14ZR1448900);上海市科技兴农重点攻关项目(沪农科攻字(2015)第1-7号);中央科研院所公益性基础科研业务费项目(2014JB02);国家生猪现代产业技术体系项目(CARS-36)
童武,男,硕士,实习研究员,主要从事猪病研究
童光志,E-mail:gztong@shvri.ac.cn

