MAE在线GPC-GC-MS/MS法测定板栗中20种有机磷农药残留
席 慧, 杨振兴,2, 张 帆,3*
(1.长沙环境保护职业技术学院, 湖南 长沙 410004; 2.湖南农业大学食品学院, 湖南 长沙 410004;3.湖南省检验检疫科学技术研究院, 湖南 长沙 410004)
MAE在线GPC-GC-MS/MS法测定板栗中20种有机磷农药残留
席 慧1, 杨振兴1,2, 张 帆1,3*
(1.长沙环境保护职业技术学院, 湖南 长沙 410004; 2.湖南农业大学食品学院, 湖南 长沙 410004;3.湖南省检验检疫科学技术研究院, 湖南 长沙 410004)
先以乙腈为提取溶剂,采用微波辅助萃取技术(MAE)对板栗样品中20种有机磷农药进行萃取(前处理),然后将提取液经分散固相萃取净化,除去样品中大部分的脂肪和甾醇等干扰基质,再经在线GPC/GC — MS — MS在多反应监测模式(MRM)下进行检测和确证,建立了板栗中20种有机磷农药残留量的在线GPC — GC — MS/MS快速测定方法。测定结果表明: 20种有机磷农药在0.01~0.20mg/kg 范围内的加标平均回收率为71.5%(104.0%,相对标准偏差为3.4%~9.4%。该方法准确、快速、净化效果好。
微波萃取; 在线凝胶渗透色谱 — 气相色谱/质谱; 板栗; 有机磷农药
板栗是我国一种富含高营养价值和药用价值的重要食用林产品,同时也是我国重要的出口坚果产品[1-2]。随着板栗的栽培面积和总产量迅速扩大,在板栗种植生产过程中,病虫害频频发生[3-5]。林农为了保证板栗质量和产量,施用了大量的农药,从而产生了农药残留污染,进而对人们的身体健康造成危害[6-7]。其中,有机磷类农药是目前农业生产中较为重要的一类有机农药,不少有机磷农药品种对人、畜的急性毒性很强,且易被植物吸收蓄积,对消费者健康安全造成潜在的威胁[8]。正因如此,欧盟、美国等发达国家对板栗等食品中该类农药残留的限量制定了更为严格的标准,使得我国板栗出口遭受了巨大的冲击和考验[9]。目前我国有关板栗中有机磷农药残留检测的文献报道不多,主要分析方法有气相色谱法[10]和气相色谱-质谱法[11-12]。由于板栗样品基质较为复杂,含有较高含量的蛋白质、糖类和油脂等杂质,基体干扰较大,易污染色谱柱和影响仪器的使用寿命,因此,样品的前处理不仅步骤繁冗,消耗的试剂耗材成本也较高。本研究采用微波辅助萃取技术(MAE)对板栗中残留的农药进行提取,该方法操作简单快速、提取效率高[13]。提取溶液经分散固相萃取净化后,再经在线凝胶渗透色谱 — 气相色谱 — 三重四级杆串联质谱联用仪进行测定,实现了净化过程的自动化,有效地弥补了分散固相萃取净化对大分子杂质去除不彻底的问题,进一步降低了背景干扰[14]。方法检测限低,定性准确度更高,为我国板栗产品质量安全和出口提供技术参考。
1 材料与方法
1.1 材料与试剂
乙腈(色谱纯,美国Tedia公司);正己烷(色谱纯,美国Tedia公司);敌敌畏、久效磷、乐果、二嗪磷、异稻瘟净、甲基毒死蜱、马拉氧磷、甲基嘧啶磷、杀螟硫磷、马拉硫磷、毒死蜱、倍硫磷、对硫磷、反式 — 毒虫畏、顺式 — 毒虫畏、喹硫磷、杀扑磷、丙溴磷、三唑磷、伏杀硫磷等有机磷农药标准品纯度均大于90%,购于德国Dr.Ehrenstorfer公司。硅胶键合十八烷基(C18)粉和乙二胺-N-丙基硅烷(PSA)粉购于美国Agilent公司。实验用水为超纯水(美国Millipore公司)。
1.2 仪器与设备
在线凝胶色谱串联三重四极杆气质联用仪(GPC — GC — MS TQ8030,日本岛津公司);MARS — 5型微波萃取仪(美国CEM公司);TurboVap II 自动氮气浓缩仪器(美国Caliper公司);SK — 1型快速混匀器(常州澳华仪器有限公司)。
1.3 标准储备液的配制
标准储备液:准确称取50.0mg(精确至0.1mg)各有机磷农药标准品于50mL棕色容量瓶中,用丙酮溶解后并准确定容到刻度线,摇匀,配制浓度为1.0mg/mL标准储备液,于4℃冰箱避光保存。
混合标准储备液:分别准确吸取1.0mL各标准储备溶液于100mL棕色容量瓶中,用丙酮溶解并定容到刻度线,配制成浓度为10μg/mL混合标准储备液,于4℃冰箱中避光保存。
混合标准工作液:根据实际检测需要准确吸取一定体积的混合标准储备液用乙腈逐级稀释成浓度分别为0.01、0.02、0.05、0.10、0.25和0.50mg/L的系列标准工作溶液,标准工作溶液现用现配。
1.4 样品处理方法
1.4.1 以微波辅助萃取技术(MAE)提取板栗中残留农药 准确称取粉碎均匀的板栗样品5.00g(精确至0.01g)于微波萃取罐内,然后加入20mL乙腈和磁力搅拌转子。微波萃取罐最大功率400W,微波压力1.33MPa,温度程序升温由室温在10min内升至80℃,然后在该温度下继续保持10min。萃取完成后,待微波萃取罐冷却至室温,取出萃取罐。萃取液经布氏漏斗抽滤,然后用约4~6mL乙腈分3次冲洗漏斗,将抽滤液转移至旋转蒸发瓶中,然后于40℃下将溶剂旋转浓缩至近干,最后用0.1%乙酸 — 乙腈混合溶液溶解残渣并定容至2.0mL,待净化。
1.4.2 分散固相萃取净化 准确称取300mg (精确至0.1g)PSA粉,50mg (精确至0.1g)C18粉于高速离心管中,加入“1.4.1”条件中的0.1%乙酸 — 乙腈提取液,于混匀器上涡旋振荡2min,然后以10000r/min离心5min,准确吸取上清液1.0mL,混匀,过0.2 μm滤膜于进样瓶中,供GPC — GC/MS/MS分析。
1.5 仪器分析条件
1.5.1 在线GPC条件 色谱柱:Shodex CLNpak EV — 200(2.1mm×150mm);流动相:丙酮+环己烷(3+7,V/V);流速:0.1mL/min;柱温:40℃;进样量:10 μL 。
1.5.2 GC — MS/MS条件 色谱柱:惰性石英管: 5m×0.53mm;预柱:Rtx — 5MS, 5m×0.25mm×0.25μm;分析柱: Rtx — 5MS, 25m×0.25mm×0.25μm;色谱柱升温程序: 82℃(5min)_8℃/min_300℃(7.75min);PTV进样口温度程序: 120℃(5min)_100℃/min_250℃(33.7min);PTV进样口压力程序: 120kPa_100kPa/min_180kPa(4.4min)_( — 49.8kPa/min)_ 120kPa(33. 8min);离子源温度: 200 ℃;色谱质谱接口温度: 300℃;检测器电压: 调谐电压+0.6kV;电子能量70eV,扫描开始时间10.2min,结束时间40min,扫描范围为 86~500m/z,数据采集方式: MRM,扫描间隔0.3s;溶剂延迟时间: 8min;选择离子(m/z)及丰度比见表1。

表1 20种农药保留时间、MRM条件参数Tab.1 Retentiontime(tR),MRMconditionparametersof20pesticides序号农药名称保留时间(min)定量离子对碰撞能量(CE)定性离子对1碰撞能量(CE)定性离子对2碰撞能量(CE)1敌敌畏(Dichlorvos)10.635109.00>79.0010185.00>93.0015185.00>109.00202久效磷(Monocrotophos)17.406127.00>109.1015127.00>95.001597.00>82.00103乐果(Dimethoate)17.93093.00>63.0010125.00>79.001087.00>72.10254二嗪磷(Diazinone)18.773152.00>137.1010137.00>84.1015137.00>54.10255异稻瘟净(Iprobenfos)19.39391.00>65.1020204.00>91.1010204.00>121.10306甲基毒死蜱(Chloropyriphos-methyl)19.971125.00>79.0010286.00>93.0025288.00>93.10257马拉氧磷(Malaoxon)20.133127.00>99.0010109.00>79.1010125.00>79.00108甲基嘧啶磷(Pirimiphosmethyl)20.776290.00>125.0030276.00>125.1020290.00>151.00259杀螟硫磷(Fenitrothion)20.836125.00>79.0010109.00>79.0010277.00>109.102010马拉硫磷(Malathion)21.07393.00>63.0010173.00>99.0015173.00>127.10511毒死蜱(Chlorpyrifos)21.229197.00>169.0015199.00>171.001597.00>65.002012倍硫磷(Fenthion)21.329278.00>109.1020125.00>79.0010109.00>79.101013对硫磷(Parathion)21.428109.00>81.001097.00>65.0020139.00>109.101014反式—毒虫畏(trans-Chlorfenvin-phos)22.068267.00>159.2020269.00>161.0010269.00>81.003515顺式—毒虫畏(cis-Chlorfenvinphos)22.353267.00>159.0020269.00>161.0025267.00>81.002516喹硫磷(Quinalphos)22.494146.00>118.1015146.00>91.1025157.00>102.102517杀扑磷(Methidathion)22.844145.00>85.1010145.00>58.102093.00>63.001018丙溴磷(Profenofos)23.672139.00>97.00597.00>65.0020139.00>121.00519三唑磷(Triazophos)25.181161.00>134.1010161.00>106.1015162.00>119.101520伏杀硫磷(Phosalone)27.698182.00>111.0020121.00>93.005121.00>65.0010
2 结果与分析
2.1 微波辅助萃取条件的优化
微波辅助萃取主要是利用微波来强化溶剂萃取效果,选择不同的萃取溶剂往往对萃取效率有很大的影响[15]。实验比较了丙酮、乙腈、乙酸乙酯、丙酮-乙酸乙酯(1+1,V/V)等常见的萃取溶剂的提取效果,四种不同萃取溶剂对萃取效率的影响如图1。实验结果表明:乙腈、乙酸乙酯、丙酮-乙酸乙酯和丙酮对所有目标物的提取效率均能达到70%~120%,满足多农残检测的要求。但是采用丙酮、乙酸乙酯和丙酮-乙酸乙酯三种萃取溶剂的提取液中色素、脂肪等杂质较多,影响样品的净化效果,基质干扰明显。对于多糖高油脂脂质的板栗样品而言,乙腈对于样品基质渗透能力强,且大多数有机磷农药在乙腈中的溶解度高,既能得到高的提取效率,又能降低基质干扰。因此,本实验采用乙腈作为板栗样品中有机磷农药多残留的提取溶剂。
2.2 在线GPC净化条件的选择
提取溶液经分散固相萃取净化后可以除去一部分杂质,但净化还不完全,需进一步净化以达到除去残留的色素、蛋白、油脂等杂质的目的。GPC能很好地弥补分散固相萃取方法去除干扰物质不彻底的问题,进而减少基质效应、降低背景干扰。本实验选择在线GPC — GC — MS/MS检测系统,样品在进入质谱分析前先过在线GPC净化,同时结合PTV大体积进样,克服了常规GPC消耗溶剂量大、分析时间长等问题,减少了人工操作带来的分析偏差,提高了实验效率。

图1 不同提取试剂对回收率的影响Fig. 1 Effect of different extraction reagent on the recovery
2.3 气相色谱 — 质谱条件的优化
在选定的色谱条件下,首先用Q3 SCAN全扫描方式得到各待测农药的质谱图,然后选取2~3个相对丰度较高、质荷比较大及相同扫描时间段其他农药及无背景干扰的离子作为母离子、子离子,将各农药成分的扫描分时间段,进行product ion 模式测定,进一步优化碰撞能量和离子对,以保证检测的灵敏度和准确性,选定2~3对定量离子对、定性离子对和最优碰撞能量,20种农药的保留时间和MRM离子参数见表1。
2.4 方法的线性范围和检出限
分别移取适量体积的农药标准混合溶液,制备得到浓度分别为10、20、50、100、250、500μg/L的混合标准溶液按照上述优化的仪器条件进行测定,以各自定量离子对的峰面积(y)对质量浓度(x,mg/L), 建立校准曲线,得到各目标组分的线性方程和相关系数,结果见表2。从表2可见,在0.01 ~0.50mg/L浓度范围内,20种有机磷农药各自的基质匹配校准曲线的线性相关系数r2均大于0.99,表明线性关系良好。用板栗空白基质样液逐级稀释混合标准溶液,以信噪比(S/N=10)确定各待测组分的测定低限(LOQ)为0.02~0.25 mg/kg。该方法的灵敏度能够满足目前国内外食品标准对板栗农药最大残留限量。

表2 20种农药的线性回归方程和相关系数及测定低限Tab.2 Linearregressionequations,correlationcoefficientsandLODof20pesticides农药名称线性方程相关系数r2测定低限(mg/kg)敌敌畏Y=51429.99X-50114.650.99950.020久效磷Y=24502.96X-145306.40.99970.200乐果Y=31126.31X-30188.280.99760.050二嗪磷Y=4334.983X-11789.970.99970.025异稻瘟净Y=38278.45X-71546.680.99630.020甲基毒死蜱Y=8134.819X-7271.6220.99790.025马拉氧磷Y=59112.74X+41225.780.99980.050甲基嘧啶磷Y=71154.37X-88855.920.99970.020杀螟硫磷Y=53858.2X-91027.50.99960.050马拉硫磷Y=31039.22X-45774.940.99970.020

续表2 20种农药的线性回归方程和相关系数及测定低限ContinuedTab.2 Linearregressionequations,correlationcoefficientsandLODof20pesticides农药名称线性方程相关系数r2测定低限(mg/kg)毒死蜱Y=42940.29X-252383.20.99750.025倍硫磷Y=4554.858X-4178.3670.99810.050对硫磷Y=73612.41X-110393.20.99860.020反式—毒虫畏Y=34209.8X-43706.590.99960.040顺式—毒虫畏Y=29334.88X-259593.10.99790.040喹硫磷Y=8450.837X-35508.650.99780.020杀扑磷Y=49965.53X-25875.580.99570.250丙溴磷Y=51834.9X-111046.80.99560.050三唑磷Y=254315.2X+11450240.99870.080伏杀硫磷Y=12727.35X-5464.910.99960.100
2.5 方法的回收率和精密度
本试验采用标准加入法,对经检测不含待测组分的空白板栗样品分别添加0.01、0.05、0.10和 0.2mg/kg 4个浓度水平的混合标准溶液进行加标回收试验,每个水平重复测定6次,实验结果见表3。结果表明:20种有机磷农药的平均加标回收率为71.5%~104.0%,相对标准偏差(RSD,n=6)为3.6%~9.4%,满足农药残留分析的要求。

表3 20种有机磷农药的回收率及相对标准偏差(n=6)Tab.3 Recoveriesandrelativestandarddeviationsof20pesticides(n=6)农药名称加标量(mg/kg)平均回收率(%)RSD(%)农药名称加标量(mg/kg)平均回收率(%)RSD(%)农药名称加标量(mg/kg)平均回收率(%)RSD(%)0.0187.77.5敌敌畏0.0590.86.40.1096.97.50.2092.85.20.0175.57.7久效磷0.0582.66.10.1085.75.60.2086.57.40.0185.99.3乐果0.0586.77.30.1090.86.90.2093.73.40.0192.88.8二嗪磷0.0586.77.10.1089.75.40.2091.85.90.0181.69.4异稻瘟净0.0584.74.10.1088.76.60.2085.75.70.0192.85.5甲基毒死蜱0.0595.97.50.1091.85.30.2090.94.90.0182.67.9马拉氧磷0.0583.65.40.1087.76.50.2082.65.30.0193.85.7甲基嘧啶磷0.05102.05.30.1091.84.60.2096.94.50.0188.75.1杀螟硫磷0.0590.87.50.1094.97.50.2091.87.10.01102.87.9马拉硫磷0.0590.87.50.1092.86.60.2096.95.30.0190.86.7毒死蜱0.0595.95.30.1093.87.10.2094.94.50.01104.07.8倍硫磷0.0593.85.80.1096.95.30.20100.03.60.01101.08.6对硫磷0.0590.08.10.1095.97.50.2091.15.20.0184.78.6反式-毒虫畏0.0590.87.50.1088.76.30.2091.85.80.0181.67.5顺式-毒虫畏0.0584.76.10.1086.75.40.2087.75.50.0189.87.0喹硫磷0.0594.98.50.1091.97.10.2097.96.20.0171.55.7杀扑磷0.0575.57.10.1077.18.50.2081.66.00.0181.66.2丙溴磷0.0584.77.10.1091.86.50.2087.75.5
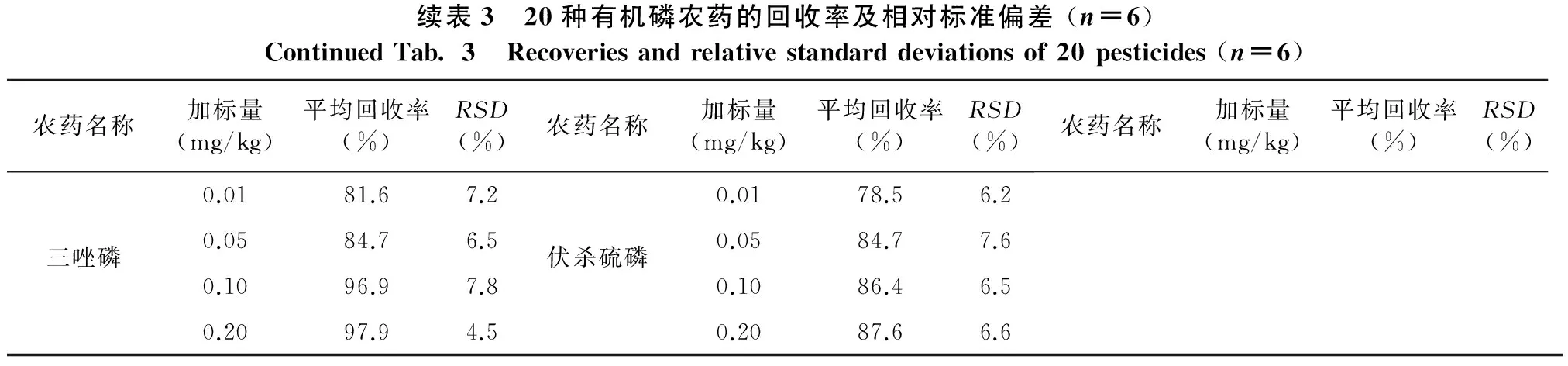
续表3 20种有机磷农药的回收率及相对标准偏差(n=6)ContinuedTab.3 Recoveriesandrelativestandarddeviationsof20pesticides(n=6)农药名称加标量(mg/kg)平均回收率(%)RSD(%)农药名称加标量(mg/kg)平均回收率(%)RSD(%)农药名称加标量(mg/kg)平均回收率(%)RSD(%)0.0181.67.2三唑磷0.0584.76.50.1096.97.80.2097.94.50.0178.56.2伏杀硫磷0.0584.77.60.1086.46.50.2087.66.6
3 结论与讨论
采用微波辅助萃取和分散固相萃取净化等前处理手段对板栗样品进行预处理,并进一步通过在线GPC — GC — MS/MS联用弥补了分散固相萃取净化方法去除杂质不彻底的问题,提高了方法的灵敏度,降低了试验成本,简化了前处理过程,建立了板栗中20种有机磷农药残留量的在线GPC — GC — MS/MS快速测定方法。该方法测定结果显示,20种有机磷农药在0.01~0.20 mg/kg 范围内的加标平均回收率为71.5%~104.0%,相对标准偏差为3.4%~9.4%。该方法准确、快速、净化效果好。
该方法有效地解决了板栗样品复杂基质前处理比较繁琐的现状,试验的回收率和相对标准偏差结果都比较理想,能够达到农药残留的检测要求,可用于板栗中多种有机磷农药残留的快速筛查与检测,为板栗的质量安全和出口提供技术参考。
[1] 高海生,常学东,蔡金星,等. 我国板栗加工产业的现状与发展趋势[J].中国食品学报,2006,6(1): 429-436.
[2] 王向红,桑建新,张子德,等. 不同品种板栗的营养价值和品质分析[J].食品科技,2004(3):95-97.
[3] 董易之,陈炳旭,陆恒,等.小蛀果斑螟对板栗品种的选择性 [J].果树学报,2010,27(3):449-452.
[4] 王晓勤,温晓蕾,路常宽.我国板栗害虫防治研究进展[J].河北科技师范学院学报,2010,24 (1): 39-43.
[5] 贺伟,尹伟伦,沈瑞祥.板栗实腐病潜伏侵染和发病机理的研究.[J].林业科学,2004,40(2): 96-102.
[6] 廖新福, 袁谭慧,林袁,等.农药残留对农产品的污染及控制对策[J].农产品加工(学刊),2006(2):80-82.
[7] 罗亮,岳永德,汤锋,等. 我国食用林产品的质量安全问题简述[J].安徽农学通报,2008,14(14): 25-26,32.
[8] 李垚辛,董全.有机磷农药残留检测技术的研究进展[J].中国食物与营养,2010(4):12-15.
[9] 王霓霓.主要贸易国家和地区食品中农兽药残留限量标准[M].北京: 中国标准出版社,2010.
[10] 李昌春,孙明娜,王梅,等. 板栗中的农药残留分析[J].果树学报,2004,21(5):496-498.
[11] 吴岩,康庆贺,高凯扬,等. 固相萃取-在线凝胶渗透色谱-气相色谱/质谱法测定板栗中44种有机磷农药残留[J].分析化学,2009,37(5):753-757.
[12] 程志,张蓉,刘韦华,等. 气相色谱-串联质谱法快速筛查测定中药材中144种农药残留[J].色谱,2014,32(1):57-68.
[13] 阿旺顿珠. 食品中农药残留检测前处理技术研究进展[J]. 中国新技术新产品,2014,8(上):175.
[14] 贾伟,凌云,郝静,等. 在线凝胶渗透色谱串联气相色谱- 质谱快速测定粮谷及油料作物中29 种农药残留[J]. 分析测试学报,2012,31(10):1217-1222.
[15] 颜鸿飞,李拥军,王美玲,等. 微波辅助萃取-分散固相萃取-气相色谱质谱法测定茶叶中23种农药残留[J].分析测试技术与仪器,2013,19(4):206-213.
(文字编校:杨 骏)
Determinationof20organophosphorouspesticideresiduesinchestnutbyon-lineGPC-GC-MS/MSusingMAE
XI Hui1, YANG Zhenxing1,2, ZHANG Fan1,3*
(1.Changsha Environmental Protection College, Changsha 410004, China;2.College of Food Science and Technology, Hunan Agricultural University, Changsha 410004, China;3.Hunan Academy of Inspection and Quarantine, Changsha 410004, China)
In this study, an analytical method has been developed for the determination of 20 organophosphorous pesticides in chestnut. Chestnut were extracted with acetonitrile using microwave-assisted extraction technique (MAE) and cleaned up using dispersive solid phase extraction (DSPE) to remove most fats and sterols in samples, after cleaned using online gel permeation chromatography(GPC),the 20 target organophosphorous pesticides were rapidly detected by gas chromatography-tandem mass spectrometry(GC-MS/MS). The average recoveries of 20 target pesticides in spiked chestnut(from 0.01 to 0.20 mg/kg)ranged from 71.5% to 104.0% with the relative standard deviation ranged from 3.4 % to 9.4 %. The developed method is accurate, quick, and with high purifying efficiency, it provided technical reference for the quality and export of the chestnut.
microwave-assisted extraction; on-line gel permeation chromatography /gas chromatography-mass spectrometry; chestnut; organophosphorous pesticides
2015-06-01
“十二五”国家科技支撑计划(2012BAK08B01)
席 慧(1984-),女,山西省五台市人,硕士研究生,研究方向:食品安全及检测。
*为通讯作者。
O 652.62,S 481+8
A
1003 — 5710(2015)04 — 0056 — 06
10. 3969/j. issn. 1003 — 5710. 2015. 04. 013

