无血清培养基干粉的生产工艺优化
翁志兵,邵春花,胡 辉
(1.上海中信国健药业股份有限公司,上海 201203;2.抗体药物国家工程研究中心,上海 201203;3.上海生物制造技术协同创新中心,上海 200237)
无血清培养基干粉的生产工艺优化
翁志兵1,邵春花1,胡 辉2,3
(1.上海中信国健药业股份有限公司,上海 201203;2.抗体药物国家工程研究中心,上海 201203;3.上海生物制造技术协同创新中心,上海 200237)
为了研究瞬时温度的提高对培养基加工的影响,通过不同的固定温度处理培养基,考察不同温度长时间处理后的培养基对CHO细胞的生长和表达的影响。结果表明,40℃处理后的效果最佳,处理工序与对照工艺相比,大大简化,产能有很大提升,为大规模生产培养基设备的选型和生产参数设置提供理论依据,且提高了设备的生产效率。
无血清培养基;温度;针磨
动物细胞培养多采用无血清培养基,无血清培养基长期被国外供应商垄断,国内生产无血清培养基的公司寥寥无几。由于培养基所需的大部分原料容易受潮,若不进行干燥处理,会对培养基的最终品质以及用量造成不利影响。因此,在培养基生产中,首先需要在一定温度下对原料进行干燥处理。在处理过程中,不同成分对温度的敏感程度各不相同,需要在不同的温度下进行处理,然后混合在一起,经过碾磨最终制成培养基干粉。国内现有的企业都是采用传统球磨方式,球磨虽然结构简单,但钢珠的清洗及搬运费时费力,效率低下,工作噪音大,占地面积大,增加了生产成本和生产时间。另外,球磨工艺采用的是批次生产,造成单批产能有限[1-2]。
国内抗体产业不断发展,规模越来愈大。如上海中信国健药业股份有限公司投资的亚洲最大30 000 L抗体项目将于2015年年底投产,必将增大对无血清培养基的需求。如果继续采用球磨方式会很大程度降低培养基的年产能。目前国际上已经有培养基公司采用先进针磨工艺,其优势在于能实现无血清培养基的连续生产,一台体量很小的针磨设备就可以与大型球磨机产能相当。但针磨工艺的缺点是设备高速旋转,产热量大;热交换面积小,导致传热效率低,对培养基的品质也会造成不利影响。同时,不同的工作温度对设备的产能影响很大[3-8]。因此,找到一个绩效比最高的生产温度就显得非常重要。目前,国内对培养基干粉温度处理的研究较少,对于针磨的使用缺乏实际经验。
针对针磨工艺导致瞬间温度提高影响培养基质量问题,笔者研究不同温度长时间处理的培养基干粉对CHO细胞培养和蛋白表达的影响,以确定绩效最高的处理温度。
1 材料与方法
1.1 材料
表达抗人源化抗血管内皮生长因子单克隆抗体的CHO细胞由上海中信国健药业股份有限公司提供,培养基生产原料由上海抗体药物国家工程研究中心有限公司提供。
1.2 培养基处理方法
设定4个温度点,分别为40、60、80和100℃,处理时间4 h(针磨设备物料接触极限值),以原方法处理的作为对照实验(RT)。每个温度点加2个平行试验,以消除实验误差可能带来的影响。
1.3 细胞培养方法
将细胞以1×106个/mL的初始细胞密度接种于1 L摇瓶中,载液量为400mL,培养时间为10 d,pH低于6.8补碱,每天补糖至3 g/L,温度为37℃,CO2体积分数为5%,转速为125r/min。每天取样计数,并将培养液于10 000r/min离心5min,保存上清液于-20℃冰箱,用于理化参数分析。
1.4 分析方法
1.4.1 细胞计数
每天取样利用台盼蓝拒染法染色,使用上海睿钰生物科技有限公司的Countstar自动细胞计数仪读取活细胞密度和细胞活率,每样计数3次,取平均值。
1.4.2 葡萄糖-乳酸测定方法
采用德国Labo公司全自动TRACE葡萄糖-乳酸分析仪检测乳酸和葡萄糖浓度,每一样品重复检测1次,取平均值。
1.4.3 蛋白表达量测定方法
色谱柱采用AB公司POROS®A20 Columns,2.1 mm×30 mm,系统采用Agilent1260 HPLC。流动相A:50 mmol/L磷酸缓冲液,0.1 mol/L NaCl,流动相B:0.1%HCl,0.1 mol/L NaCl,流动相A和流动相B的比例为3∶7;流速1mL/min;检测波长280nm;进样温度(5±3)℃;柱温(25±5)℃;进样量100μL。
1.5 统计方法
采用SPSS 19软件进行数据的统计分析。
2 结果与讨论
2.1 不同温度处理的培养基对活细胞密度的影响
研究不同温度处理的培养基对活细胞密度的影响,结果如图1所示。
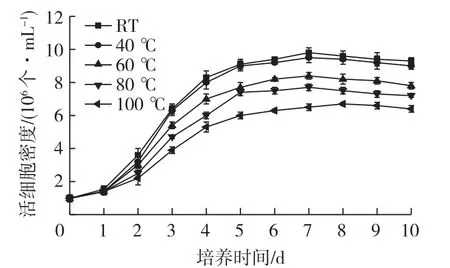
图1 不同温度处理的培养基对活细胞密度的影响Fig.1 Effects of medium treated with different temperature on cell density
从图1可以发现,100℃时的活细胞密度最低,可能是由于培养基中的某些成分经过100℃高温处理后,会有部分损失,营养成分的减少影响了细胞的生长繁殖,造成了活细胞密度较低。在培养基磨制过程中,实际针磨工艺瞬时高温可达80℃以上,对热敏感物质有很大破坏,例如PF68(一种非离子型乙烯和环氧丙烷共聚物,被用作消泡剂和抗击细胞培养中剪切力的细胞膜稳定剂)就会熔化并结块。针磨处理培养基原料时间受设备处理能力和筛网大小影响,一般接触时间约为10~30min,因此,控制针磨腔体内部温度尤为重要,一般使用干冰或液氮降温。合理控温点可在节约成本的同时提高产能。从活细胞密度来看,40℃和对照组差异较小,基本相同,细胞活力较高。
2.2 不同温度处理的培养基对乳酸的影响
研究不同温度处理的培养基对乳酸的影响,结果如图2所示。
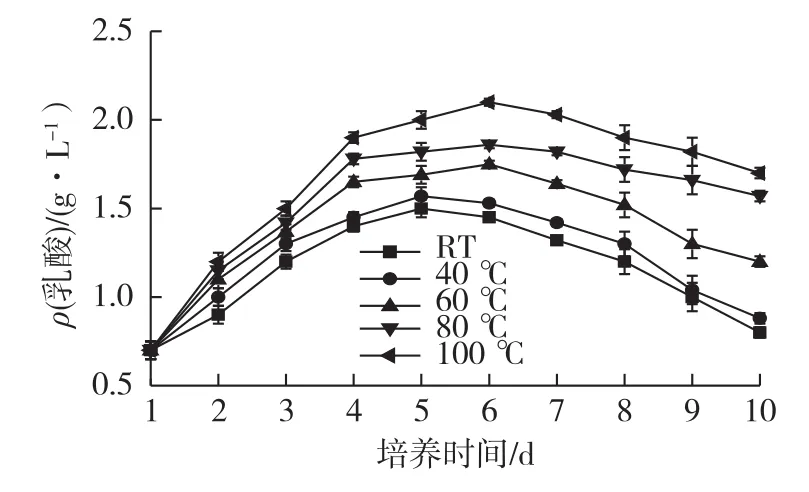
图2 不同温度处理的培养基对乳酸的影响Fig.2 Effects of medium treated with different temperatures on lactate concentration
从图2可以发现,100、80℃时的乳酸质量浓度较高,达到1.75 g/L以上,60℃时的乳酸浓度居中,40℃和对照组的乳酸浓度最低。乳酸浓度较高会抑制细胞的生长和表达,对比图1和图2可以看出,乳酸浓度较高的,活细胞密度相对较低。
培养基干粉处理温度较高时会对培养基成分造成一定影响,比如谷氨酰胺和转铁蛋白等[9-10],这些成分与细胞生长和代谢相关,有可能是影响了三羧酸循环(TCA循环),能量代谢进入了糖酵解途径或者己糖磷酸支路(HMP)途径,乳酸浓度升高。乳酸浓度越低,说明能量代谢越彻底,释放的ATP越多,越有利于细胞生长和代谢,乳酸浓度高影响细胞能量代谢,进而抑制细胞生长和表达。因此,从乳酸浓度来看,40℃和对照组最优。
2.3 不同温度处理的培养基对目的蛋白表达量的影响
研究不同温度处理的培养基对目的蛋白表达量的影响,结果如图3所示。
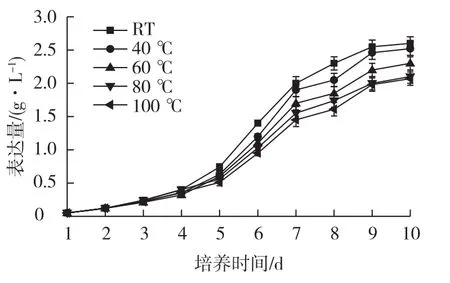
图3 不同温度处理的培养基对表达量的影响Fig.3 Effects of medium treated with different temperatures on protein epression
从图3可以看出,100℃处理下的蛋白表达量最低,仅有2.06 g/L;40℃处理后的蛋白表达量和对照组蛋白表达量最高,分别达到2.45和2.53 g/L。其他温度处理下的蛋白表达量均低于40℃下的表达量。100℃时的蛋白表达量最低,可能是由于培养基中的部分成分经过100℃高温处理后,会有部分损耗,营养成分的减少影响了细胞代谢,造成了蛋白表达量较低。
2.4 单因素实验结果及方差分析
比较不同培养基培养10 d后活细胞密度、乳酸及其目的蛋白表达量,并进行方差分析,结果如表1和2所示。
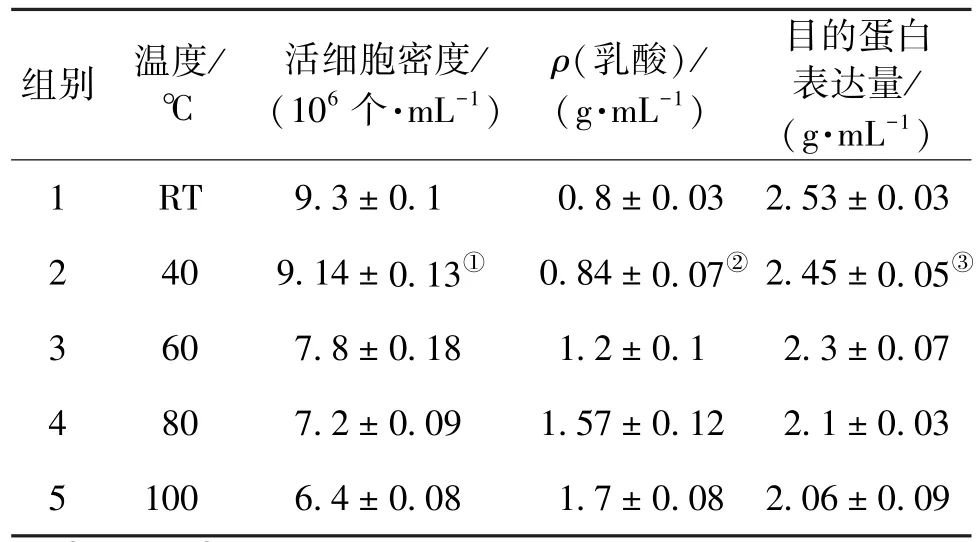
表1 各组培养10 d后的活细胞密度、乳酸及其目的蛋白表达量的比较Table 1 Comparison of live cell density,lactate concentrate and the epression level of aim protein in different groups after 10 d′s culture(x±s)
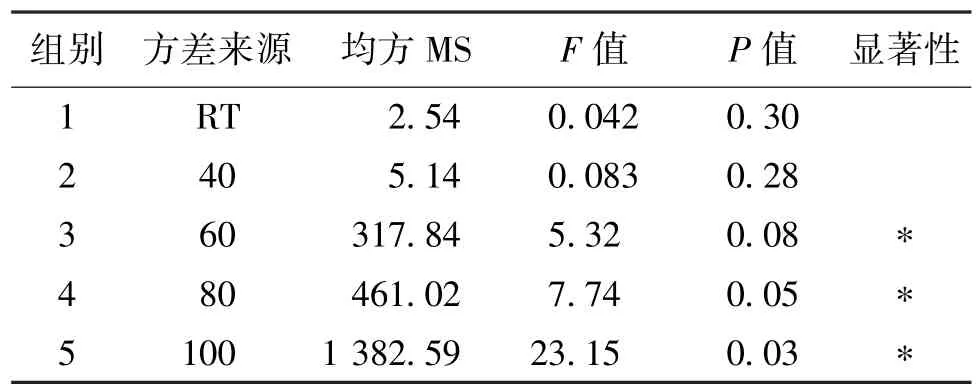
表2 单因素实验方差分析Table 2 One-was analysis of variance
由表1和表2可知:100℃处理下的活细胞密度最低,40℃处理下的活细胞密度最高,其他温度处理下的活细胞密度与对照组比较均为显著性差异。40℃时,P>0.05,为非显著性差异。40℃和对照组的乳酸浓度最低,浓度相差较小,非显著性差异,较为接近。从蛋白表达量来看,40℃和对照组为非显著性差异,其他组与对照组为显著性差异,明显高于其他处理温度时的蛋白表达量,因此,40℃和对照组最优。
3 结论
针对针磨工艺导致瞬间温度提高影响培养基质量问题,笔者研究不同温度长时间处理的培养基干粉对CHO细胞培养和蛋白表达的影响,以确定绩效最高的处理温度。综合乳酸浓度、活细胞密度和蛋白表达量来看,40℃和对照组的均优于其他组,其中对照组的乳酸浓度最低,蛋白表达量最高,但对照组的培养基干粉处理工序较为繁琐,生产效率较低。而40℃处理后细胞的生长状况和对照组为非显著性差异,但是处理工序却大大减少,生产效率得到大幅提高。综合考虑,40℃的培养基干粉针磨处理工序是最佳的处理温度。
[1]苏晓蕊,岳华,汤承.Vero细胞无血清培养基研究进展[J].动物医学进展,2012,33(2):87-90.
[2]Jayme D,Fike R,Radominski R,et al.A novel application of granulation technology to improve physicalproperties and biological performance of powdered serum-free culture media[M]//Animal Cell Technology:Basic& Applied Aspects. Netherlands:Springer,2002:155-159.
[3]Chase L G,Lakshmipathy U,Solchaga L A,et al.A novel serumfree medium for the expansion of human mesenchymal stem cells[J].Stem Cell Research&Therapy,2010,1(1):8.
[4]Li Y,Powell S,Brunette E,et al.Expansion of human embryonic stem cells in defined serum-free medium devoid of animal-derived products[J].Biotechnology and Bioengineering,2005,91(6):688-698.
[5]Jung S,Sen A,Rosenberg L,et al.Human mesenchymal stem cell culture:rapid and efficient isolation and expansion in a defined serum-free medium[J].Journal of Tissue Engineering and Regenerative Medicine,2012,6(5):391-403.
[6]Brunner D,Frank J,Appl H,et al.Serum-free cell culture:the serum-free media interactive online database[J].Altex,2010,27(1):53.
[7]Kanatsu-Shinohara M,Inoue K,Ogonuki N,et al.Serum-and feeder-free culture of mouse germline stem cells[J].Biology of Reproduction,2011,84(1):97-105.
[8]Konno M,HamazakiT S,Fukuda S,etal.Efficiently differentiating vascular endothelial cells from adipose tissuederived mesenchymal stem cells in serum-free culture[J]. Biochemical and Biophysical Research Communications,2010,400(4):461-465.
[9]马洪龙,韩飞,李爱科,等.谷氨酰胺及其结合肽的研究进展[J].粮油食品科技,2014,22(3):76-81.
[10]龙华,曾勇,郑英,等.转铁蛋白的研究与发展[J].生物工程进展,2001,21(2):32-39.
(责任编辑 管 珺)
Optimization of production process of serum-free medium
WENG Zhibing1,SHAO Chunhua1,HU Hui2,3
(1.Shanghai CP Guojian Pharmaceutical Ltd.,Shanghai 201203,China;2.National Engineering Research Center of antibody Medicine,Shanghai 201203,China;3.Shanghai Collaborative Innovation Center of Bio-Manufacturing Technology,Shanghai 200237,China)
In order to study instantaneous temperature's effects on serum-free medium,following limit experiments are designed,keeping the serum-free medium under different temperature for a long time to study the effects of medium under different temperature on the growth of CHO cells.The results show that 40℃ was the best temperature,it also reduces the procedure of medium manufacturing.It will provide a theoretical basis for the selection of medium producing equipment and production parameters,and improves production efficiency of the equipment.
serum-free medium;temperature;pin grinding
Q813
A
1672-3678(2015)05-0057-04
10.3969/j.issn.1672-3678.2015.05.011
2014-08-25
上海市科学技术委员会科技支撑项目(12431901402)
翁志兵(1980—),男,江苏泰兴人,工程师,研究方向:无血清培养基及大规模动物细胞培养,E-mail:weng1980@sina.com

