大孔树脂纯化黄秋葵黄酮及其体外抗氧化活性研究
刘爱敬,廖争争,郭 琳,赵 旭,毕开顺,贾 英,*
(1.沈阳药科大学中药学院,沈阳市中药药效物质基础筛选与评价重点实验室,辽宁沈阳110016;2.沈阳药科大学药学院,中药质量控制关键技术国家地方联合工程实验室,辽宁沈阳110016)
大孔树脂纯化黄秋葵黄酮及其体外抗氧化活性研究
刘爱敬1,廖争争1,郭琳1,赵旭1,毕开顺2,贾英1,*
(1.沈阳药科大学中药学院,沈阳市中药药效物质基础筛选与评价重点实验室,辽宁沈阳110016;2.沈阳药科大学药学院,中药质量控制关键技术国家地方联合工程实验室,辽宁沈阳110016)
以黄秋葵为原料,以总黄酮为研究对象,开展了总黄酮提取、分离纯化及抗氧化活性的研究。采用静态和动态吸附-解吸实验对8种不同型号大孔树脂进行筛选,以吸附、解析效果为指标,考察大孔树脂纯化黄酮的工艺参数,并利用DPPH、ABTS、Fe3+法测定黄秋葵黄酮体外抗氧化活性。结果表明AB-8型大孔吸附树脂纯化效果最好,最佳工艺条件如下:上样液质量浓度为0.927 mg/mL,上样量为50 mL,用5 BV的30%乙醇作为解吸剂,以1.0 mL/min的洗脱速度进行解吸。抗氧化结果显示黄酮提取物对DPPH、ABTS自由基有明显的清除能力(IC50值分别为0.440 mg/mL和0.256 mg/mL),并对Fe3+表现出了较高的还原能力。
黄秋葵,黄酮,大孔树脂,最佳工艺,抗氧化
黄秋葵(Abelmoschus esculentus(L.)Moench),锦葵科秋葵属一年生草本植物,又名羊角豆咖啡黄葵等,起源于非洲,20世纪90年代初引入我国内陆。黄秋葵为“药食同源”的营养保健蔬菜,嫩果含有丰富的不饱和脂肪酸、蛋白质、多糖、黄酮类化合物以及多种游离氨基酸。味淡,性寒,具有抗疲劳、抗溃疡、抗氧化、滋阴补阳、保护胃粘膜、增强机体抵抗力等作用[1-2]。
抗氧化剂具有延缓人体衰老,降低多种疾病产生,增强人体免疫能力等多种功能。生物类黄酮是具有较强清除自由基和抗氧化能力的一种物质,其抗氧化作用甚至高于维生素C、维生素E,因此,研究开发广谱高效安全的天然抗氧化剂已成为当今研究的热点之一。目前,关于黄秋葵活性物质的研究大多集中于不同极性成分的分析上,徐天姿等[3]探究了黄秋葵黄酮的抗疲劳作用及机制,李加兴等[4]采用超声方法提取黄秋葵黄酮,提取率为4.85%,并进行了抗氧化活性研究。黄秋葵是一种富含黄酮的植物,同时还含有多糖、维生素等抗氧化活性物质。因此提高黄秋葵黄酮含量,确定其抗氧化活性成分是否与黄酮有关是至关重要的。大孔吸附树脂是一类有机高聚物吸附剂,它具有比表面积较大、交换速度较快、热稳定好等特点。与其他分离技术相比,它具有提高有效成分的相对含量、生产周期短、树脂再生方便、可重复使用等优点,因而近几年在天然产物的分离纯化中被广泛应用,尤其适用于黄酮类化合物的纯化。本文采用8种大孔树脂对黄秋葵总黄酮进行分离纯化,确定其分离纯化条件,并采用DPPH·、ABTS+·、Fe3+三种模型对黄秋葵粗黄酮进行抗氧化体外活性研究,为进一步研究黄秋葵的抗氧活性及资源开发利用提供依据。
1 材料与方法
1.1材料与仪器
黄秋葵购自山东莱阳经沈阳药科大学中药学院贾英教授鉴定为正品;DPPH、ABTS大连美仑科技有限公司,纯度98.0%;芦丁标准品、没食子酸标准品大连美仑科技有限公司,纯度96.3%;福临酚(Folin-CiocaLteu,FC)上海荔达生物科技有限公司,纯度99.0%;其余试剂均为分析纯。
RE-52A型旋转蒸发仪上海亚荣生化仪器厂;HH-4型数显电热恒温水浴锅国华电器有限公司;Varioskan Flash酶标仪赛默飞世尔科技公司。
1.2实验方法
1.2.1总黄酮含量测定精密称取经120℃恒温干燥至恒重的芦丁对照品10 mg,置50 mL的容量瓶中,用无水乙醇溶解定容,得到浓度为0.2 mg/mL的芦丁标准溶液。准确移取标准溶液0、1、2、3、4、5、6 mL于25 mL的容量瓶中,分别补充6、5、4、3、2、1、0 mL蒸馏水使体积至6 mL,再加入5%NaNO2溶液1mL,摇匀,放置6 min;再加入10%Al(NO3)3溶液1 mL,摇匀,放置6 min;再加入4%NaOH溶液10 mL,定容,放置15 min,在510 nm下测定其吸光值,以芦丁的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线[5]。标准曲线为A=6.4107C+0.0396,R2=0.9992。
1.2.2黄秋葵粗黄酮的制备1 kg黄秋葵干燥果实,粉碎,10倍量的60%乙醇回流提取3次,每次2 h,合并滤液得黄秋葵总提物,浸膏共280 g,实验前用蒸馏水溶解,经正丁醇反复萃取,浓缩得粗黄酮粗品6.2 g。
1.2.3大孔树脂的选择
1.2.3.1静态吸附-洗脱性能实验精密称取已处理的各型号树脂2 g(见表1),置100 mL锥形瓶中,精密加入已知质量浓度为0.943 mg/mL的粗黄酮溶液50 mL,在28℃温恒速振荡器振荡吸附24 h,过滤,定容。将过滤后的树脂另置100 mL锥形瓶中,精密加入50%乙醇50 mL,振荡6 h,定容。按“1.2.1”项下方法分别测定黄酮的含量,并按下式计算吸附量、吸附率及解析率,每个大孔树脂做3个平行,取其平均值[6-7]。

式中:C0为吸附液起始质量浓度(mg/mL);C1为吸附后溶液质量浓度(mg/mL);C2为解吸液质量浓度(mg/mL);M为干树脂的吸附量(g);V为吸附液体积(mL);
1.2.3.2动态吸附-洗脱性能实验精密称取AB-8、HPD722、D3520型树脂各5 g上柱(直径:1.5 mm;高:100 cm),精密吸取样品液50 mL,以流速1 mL/min上柱,预吸附2 h,过柱液重吸附1次,放置12 h,用50 mL水冲洗,用量筒收集过柱液和水洗液,加50%乙醇洗脱至不再有黄酮流出,用量筒收集洗脱液,按“1.2.1”项下方法测定黄酮含量并计算吸附率及解析率,每种大孔树脂做3个平行,取其平均值。
1.2.4黄酮的纯化工艺优选
1.2.4.1上样量的考察精密称取处理好的AB-8大孔树脂5.0 g(保留体积约为8 mL)进行动态吸附,样品液质量浓度为0.8448 mg/mL,流速为0.5 mL/min,分段收集流出液,每份5 mL,收集30份,以编号为横坐标,以黄酮含量为纵指标,绘制泄漏曲线,流出液中黄酮浓度达到上柱液浓度的10%时,称为泄漏点。
1.2.4.2洗脱剂浓度的选择精密称取处理好的AB-8大孔树脂5.0 g,取已知质量浓度的样品一定体积进行动态吸附,吸附完全后,先用200 mL水冲洗,再依次以30%、50%、95%乙醇各100 mL进行梯度洗脱(每个梯度收集5管,水为每管40 mL,乙醇为每管20 mL),测定每管黄酮的含量,以管号为横坐标,黄酮浓度为纵坐标,绘制洗脱曲线[8]。
1.2.4.3洗脱剂用量考察精密称取处理好的AB-8大孔树脂5.0 g,取已知质量浓度的样品一定体积进行动态吸附,吸附完全后用200 mL水洗,用30%乙醇以1 mL/min的流速进行解吸,每8 mL流出液收集一份(约1 BV),以保留体积数量为横坐标,黄酮质量浓度为纵坐标绘制曲线[9]。
1.2.4.4样品液质量浓度精密称取处理好的AB-8大孔树脂5.0 g,4份,装柱。将质量浓度分别为1.867、0.927、0.471、0.245 mg/mL的药液15、30、60、120 mL,以相同流速通过树脂柱,完全吸附后测定吸附后溶液中黄酮的浓度,计算树脂的吸附率。
1.2.4.5洗脱流速考察精密称取处理好的AB-8大孔树脂5.0 g,3份,装柱。选取质量浓度为0.927 mg/mL的药液50 mL上柱,先用100 mL蒸馏水洗脱,再用100 mL 30%乙醇分别以0.5、1、2 mL/min的速度解吸,计算回收率。
1.2.4.6验证实验精密称取处理好的AB-8大孔树脂5.0 g,3份,分别装柱,按各项下优选药液30 mL上柱,按上述纯化工艺进行3次验证实验,收集30%乙醇洗脱液,蒸干后测定浸膏质量,分别测定回收率。
1.2.5黄秋葵总黄酮抗氧化活性评估
1.2.5.1供试样品溶液制备经上述工艺纯化后的黄酮提取物,分别配制0.05、0.1、0.2、0.5、1.0、2.0、4.0 mg/mL的样品溶液备用。
1.2.5.2DPPH·清除能力配制2×10-4mol·L-1的DPPH乙醇溶液100 mL,得DPPH·储备液。反应体系中加入0.4 mL样品溶液和4 mL DPPH·储备液,摇匀室温下放置30 min,在517 nm下测定其吸光值Ai;以0.4 mL无水乙醇代替样品溶液测得空白吸光度A0;以4 mL无水乙醇代替DPPH·储备液测得样品本底吸光度Aj;每个浓度做3个平行,取其平均值,以VC做阳性对照,按式(1)计算样品溶液对DPPH·的抑制率,并计算出IC50值[10-11]。
自由基抑制率(SA,%)=[1-(Ai-A)j/A0]×100式(5)
1.2.5.3ABTS+·清除能力将7 mmol·L-1ABTS水溶液10 mL和2.45 mmol·L-1K2S2O8溶液10 mL混合,在室温、避光的条件下静置过夜(12~16 h),形成ABTS自由基(ABTS+·)储备液,实验前用95%乙醇稀释至吸光度为0.700±0.02左右备用。反应体系中加入0.1 mL的样品溶液和5 mL ABTS+·储备液,充分混合后室温放置6 min,在734 nm下测其吸光度Ai;以0.1 mL无水乙醇代替样品溶液测得空白吸光度A0;以5 mL无水乙醇代替ABTS溶液测得样品本底吸光度Aj;每个浓度做3个平行,取其平均值,以VC做阳性对照,按式(5)计算样品对ABTS+·的抑制率,并计算出IC50值[12-13]。
1.2.5.4还原能力测定Fe3+还原法:反应体系中依次加入1.0 mL不同浓度的样品溶液,1.0 mL的磷酸盐缓冲液(0.2mol/L,pH6.6)和1.0 mL 1%的K3Fe(CN)6溶液,在45℃下水浴反应20 min后迅速冷却,然后加入1.0 mL 10%的CCl3COOH溶液。取上述反应液2 mL,加入2 mL蒸馏水和0.1%的FeCl3溶液0.5 mL,摇匀,10 min后在695 nm下测定其吸光值,以VC做阳性对照,每个浓度做3个平行,取其平均值[14]。
1.3数据处理
2 结果与分析
2.1静态吸附-洗脱性能实验
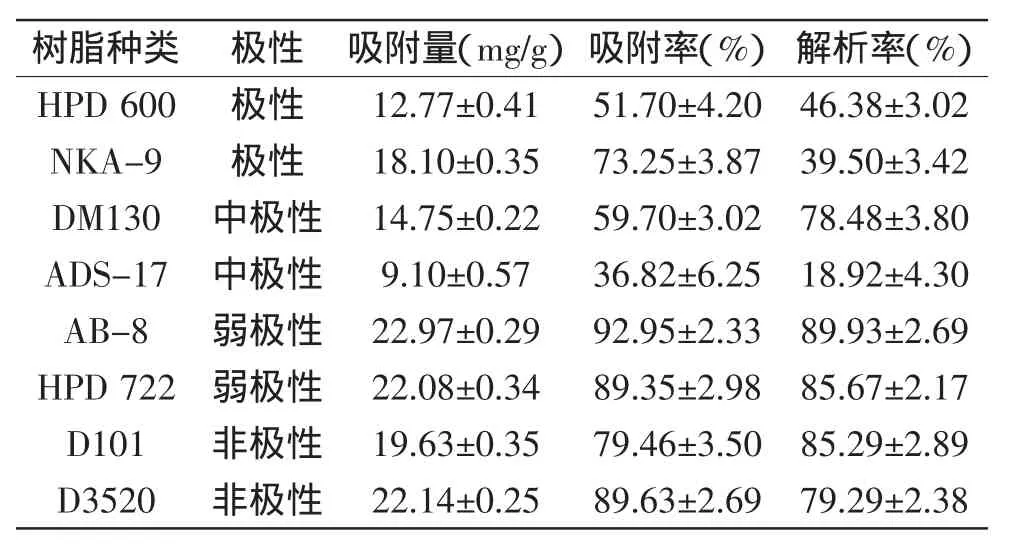
表1 大孔树脂对黄秋葵黄酮的静态吸附与解吸附性能Table 1 Absorption and desorption capabilities of different macroretieular resins to the flavone in Okra in statical
结果如表1所示,8种大孔树脂对黄秋葵黄酮的吸附和解吸性能各不相同,这是由于每种大孔树脂的极性、比表面积和平均孔径不同,对黄酮的吸附解吸强弱就不同。弱极性和非极性的树脂AB-8、HPD722、D3520对黄秋葵黄酮的吸附和解吸附明显高于极性和中极性的树脂,其中AB-8型大孔树脂吸附率和解析率均为最高,说明粗提液中的黄酮主要是弱极性成分。故选用这3种树脂做进一步动态吸附-洗脱性能实验筛选。
2.2动态吸附-洗脱性能实验
结果见图1所示,AB-8、HPD722、D35203型大孔树脂对黄秋葵黄酮的吸附能力及洗脱能力均为AB-8>HPD722>D3520,故综合静态和动态的吸附、洗脱,AB-8型树脂更适宜于对黄秋葵黄酮的分离纯化。

图1 大孔树脂对黄秋葵黄酮的动态吸附与解吸附性能Fig.1 Absorption and desorption capabilities of different macroretieular resins to the flavone in Okra in dynamic
2.3黄酮的纯化工艺优选
2.3.1上样量的考察结果如图2所示,当上柱量为50 mL时,流出液中黄酮浓度达到0.0845 mg/mL以上,为泄漏点,所以上样体积控制在50 mL为宜,此时黄酮吸附量为8.448 mg/g树脂。随流出体积的增加,流出液中黄酮的浓度呈增加的趋势,当流出液体积为125 mL时树脂对黄秋葵黄酮的吸附基本达到饱和。
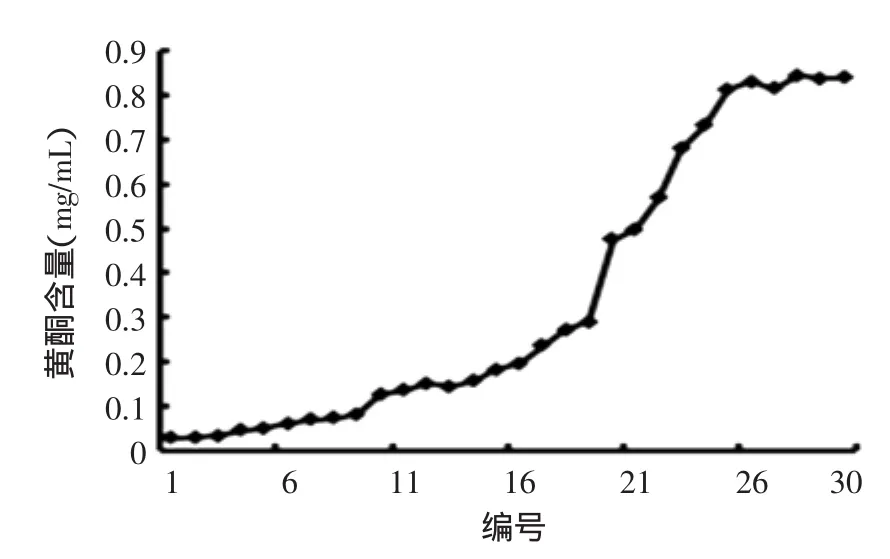
图2 泄漏曲线Fig.2 Leakage curve
2.3.2洗脱剂浓度的选择结果见图3,乙醇浓度对黄秋葵黄酮的洗脱有较大影响。当乙醇浓度为30%时(6~10号),洗脱液中黄酮含量达最大值,乙醇浓度增加,黄酮浓度降低,说明黄酮化合物也基本被30%乙醇洗脱完全,为在实际生产中获得更高的转移率,故选择30%乙醇为洗脱剂。
图3 梯度洗脱曲线Fig.3 Gradient elution curve
2.3.3洗脱剂用量考察由图4可知,洗脱剂为2 BV时,黄秋葵黄酮含量达最大值,随洗脱体积增多,黄酮浓度逐渐降低,至洗脱剂为5 BV时,总黄酮的含量基本降低至最低值,洗脱液中黄酮含量已不足0.01 mg/mL,说明黄酮基本洗脱完全,从节省洗脱剂用量和洗脱时间方面考虑,洗脱剂的用量选择5 BV比较适宜。

图4 洗脱剂用量Fig.4 Volume of eluant
2.3.4样品液质量浓度考察如图5所示,在上样浓度较低时,随着样品浓度的增加,黄酮的吸附率逐渐增加,但当样品浓度超过0.927 mg/mL后,黄酮的吸附率又开始下降。这是因为,浓度的增加意味着溶质与树脂的接触机会的增大,因此会增强树脂对溶质的吸附作用,吸附洗脱的效果也会更好。但样品浓度过高,与之竞争吸附的杂质也相应增多,导致树脂的吸附选择性降低,黄酮在树脂内部的扩散能力降低,所以说适宜的样品浓度能够增加树脂的分离效能,综合考虑,黄酮上样液浓度选择0.927 mg/mL。
2.3.5洗脱流速考察结果如图6所示,洗脱速度越大,回收率越低。当洗脱速度为0.5 mL/min时,回收率最高,但洗脱速度过慢,生产周期也会延长,因此选择1 mL/min为洗脱流速,既提高了回收率又加快了生产周期。
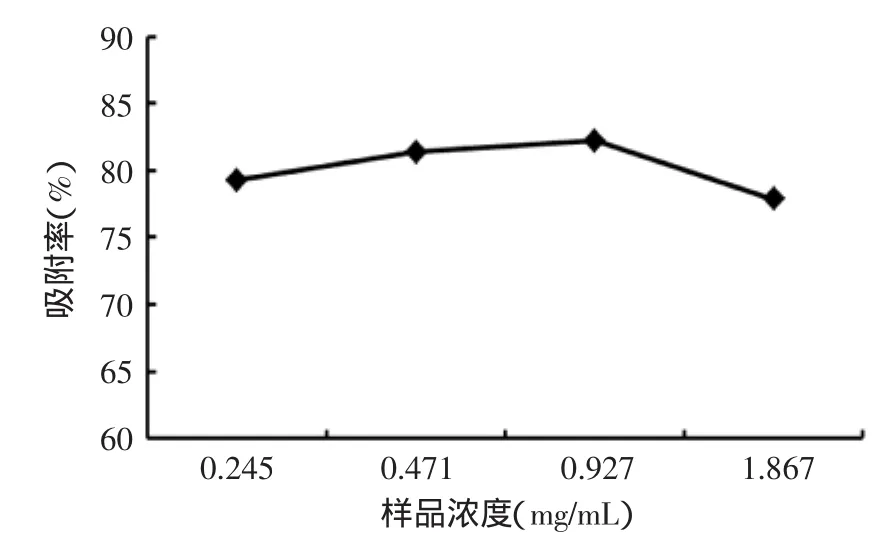
图5 样品浓度的考察Fig.5 Consideration of sample concentration
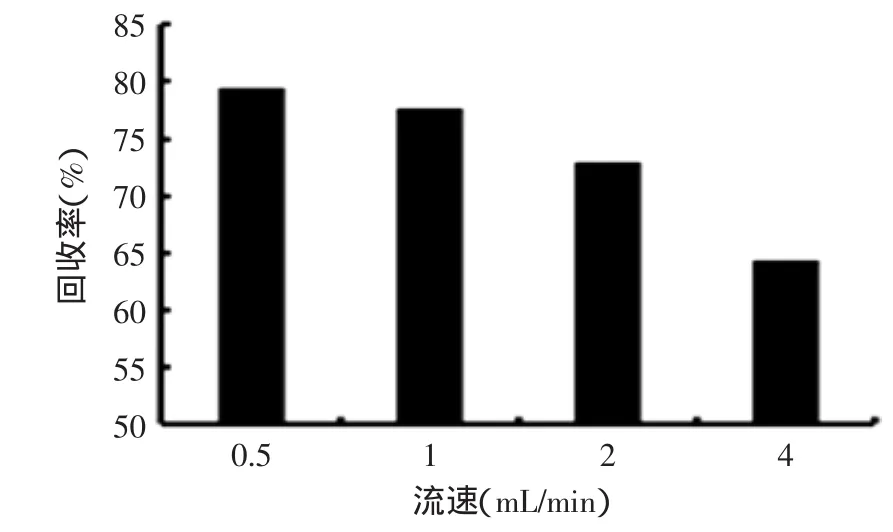
图6 洗脱流速的考察Fig.6 Consideration of elution velocity
2.3.6验证实验粗黄酮浓度为0.927 mg/mL,上样量50 mL,5 BV的30%乙醇为解吸剂,以1.0 mL/min的洗脱速度进行解吸,经AB-8树脂纯化后份样品的回收率分别为80.17%、78.36%、78.97%,均值为79.17%,纯度分别为39.97%、40.19%、42.52%,平均值为40.89%,说明该纯化工艺重复性良好。
2.4黄秋葵总黄酮抗氧化活性评估
2.4.1DPPH·清除能力由图7可见,黄秋葵黄酮提取物对DPPH·表现一定的清除能力,在0.05~4 mg/mL范围内,自由基清除能力随浓度升高而升高。其中样品浓度为1 mg/mL时,黄秋葵黄酮对自由基清除率为82.04%,接近VC水平,黄秋葵黄酮和VC的IC50值分别为0.440、0.101 mg/mL。
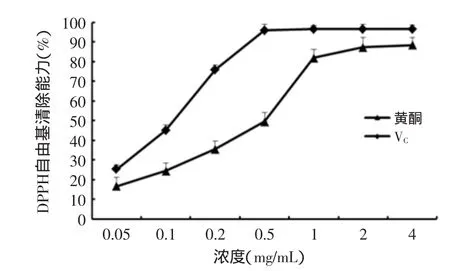
图7 DPPH自由基清除能力测定Fig.7 Determination of DPPH radical scavenging capacity
2.4.2ABTS+·清除能力图8可见,黄秋葵黄酮提取物对ABTS+·表现出良好的清除能力,在0.05~4 mg/mL范围内,清除自由基能力随浓度升高而升高。其中样品浓度为1 mg/mL时,黄秋葵黄酮对自由基清除率为87.34%,接近VC水平,黄秋葵黄酮和VC的IC50值分别为0.256、0.091 mg/mL。

图8 ABTS自由基清除能力测定Fig.8 Determination of ABTS radical scavenging capacity
2.4.3还原能力测定结果如图9可示,黄秋葵黄酮提取物表现出了良好的还原能力,在0.05~2 mg/mL范围内,还原能力随浓度升高而升高。其中样品浓度为1 mg/mL时,黄秋葵黄酮的还原能力接近VC水平。

图9 还原能力测定Fig.9 Determination of reduction capability
3 结论
AB-8型大孔树脂在黄酮的静态和动态吸附实验中,相对于其他类型树脂具有明显优势,用于黄秋葵黄酮的纯化较理想,综合考虑分离纯化黄秋葵黄酮的最佳条件为:上样浓度为0.927 mg/mL,上样量50 mL,5 BV的30%乙醇为解吸剂,以1.0 mL/min的洗脱速度进行解吸,经AB-8树脂纯化后,黄秋葵黄酮可有效去除杂质,纯度约为40%,便于制剂工艺研究,具有一定的应用实用价值。
通过测定DPPH·、ABTS+·清除力和铁氰化钾还原法三种体外抗氧化评价实验,可以发现黄秋葵黄酮具有较强的自由基清除力及还原能力。随着近几年对植物抗氧化成分研究的不断深入,植物性抗氧化物质在食品、化妆品和药品等领域的使用日益增多,因此黄秋葵物质作为一种功能性食品添加剂资源具有广阔的应用开发前景。
[1]Jarrel RL,Wang ML,Levy IJ.Seed oil and fatty acid content in okra(Abelmoschus esculentus)and related species[J].Journal of Agricultural and Food Chemistry,2011,59:4019-4024.
[2]Sabitha V,Panneerselvam K,Ramachandran S.In vitro αglucosidase andα-amylase enzyme inhibitory effects in aqueous extracts of Abelmoscus esculentus(L.)Moench,Asian Pac[J]. Tropical Biomedicine,2012(S):162-S164.
[3]徐天姿,单雪峰,孙炜,等.黄秋葵黄酮抗小鼠运动性疲劳的作用及其机理研究[J].中华中医药学刊,2014,32(4).10.13193/ j.issn.1673-7717.2014.04.059.
[4]李加兴,陈选,邓佳琴,等.黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J].食品科学,2014,35(10):121-125.
[5]韩雅慧,顾赛麒,陶宁萍,等.甘草总黄酮提取工艺及总抗氧化活性研究[J].食品工业科技,2012(2):238-242.
[6]陈沛鑫,高英,李卫民,等.大孔树脂纯化茶梗中茶多酚的工艺优选[J].中国实验方剂学杂志,2012,18(22):65-68.
[7]安晓婷,等.大孔树脂纯化蓝莓果渣多酚及其组成分析[J].食品科学,2013,34(20):1-6.
[8]令博等.葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J].食品科学,2011,32(18):21-29.
[9]李波,包怡红,高锋,等.大孔树脂纯化红松松球鳞片多酚及其抗氧化活性研究[J].食品工业科技,2012,33(22):251-255.
[10]陈智坤,梁呈元,李维林,等.薄荷不同溶剂提取物抗氧化活性的研究[J].食品工业科技,2013,34(3):100-103.
[11]谢超.裨农香菊抗氧化活性及其应用研究[D].湖北:湖北中医药大学,2012.
[12]Zhong XK,Jin X,Lai FY,et al.Chemical analysis and antioxidant activities in vitro of polysaccharide extracted from Opuntia ficus indica Mill cultivated in China[J].Carbohydrate Polymers,2010,82:722-727.
[13]Jayakumar T,Thomas PA,Geraldine P.In-vitro antioxidant activities of an ethanolic extract of the oyster mushroom Pleurotus ostreatus[J].Iinnovative Food Science&Emerging technologies,2009(10):228-234.
[14]Jeony SC,Jeony YT,Yang BK,et al.White button mushroom(Agaricus bisporus)lowers blood glucose and cholesterol levels in diabetic and hypercholesterolemic rats[J].Nutr Res,2010,30:49-56.
Purification technology of flavone from Abelmoschus esculentus(L.)Moench with macroporous resins and research of the antioxidant ability in vitro
LIU Ai-jing1,LIAO Zheng-zheng1,GUO Lin1,ZHAO Xu1,BI Kai-shun2,JIA Ying1,*
(1.School of Traditional Chinese Materia Medica,Shenyang Pharmaceutical University,Shenyang 110016,China;2.School of Pharmacy,Shenyang Pharmaceutical University,National and Local United Engineering Laboratory for Key Technology of Chinese Material Medica Quality Control,Shenyang Pharmaceutical University,Shenyang 110016,China)
In order to optimize purification technology of flavone from Abelmoschus esculentus(L.)Moench by macroporous resin,static and dynamic adsorption-desorption were used to select the best one from 8 different type macroporous resins.With the content of flavone as index,purification technology parameters of flavone were optimized.The flavone was evaluated by three models of antioxidant activity:DPPH·,ABTS+·,Fe3+.AB-8 type resin showed the best purifying profile,its optimum technology conditions were as follows:sample concentration was 0.927 mg/mL,sample volume was 50 mL,desorption rate was 1 mL/min,eluted by 5 BV 30% ethanol.And the flavone extracts had great antioxidant activity.The flavonoid extract exhibit obviously ability of scavenging DPPH,ABTS radical,and also showed a higher reduction capability.This optimized technology was simple and feasible with good purification effect,so it could provide a reference for development of related products of okra.
Abelmoschus esculentus(L.)Moench;flavone;macroporous resin;optimum process;antioxidant
TS255.1
B
1002-0306(2015)16-0284-05
10.13386/j.issn1002-0306.2015.16.049
2014-08-01
刘爱敬(1989-),女,硕士研究生,研究方向:中药质量控制,E-mail:liuaijing1990@163.com。
贾英(1969-),女,教授,研究方向:中药药效物质基础与质量控制,E-mail:jiayingsyphu@163.com。
中药药效物质基础筛选与评价重点实验室(F13-287-1-00);阿尔茨海默病的诊断方法与治疗药物的筛选研究(2011412004-1);五味子镇静安神活性部位的开发研究(F12-153-9-00)。

