赤芝与无柄灵芝担孢子的萌发特性比较
柯斌榕吴小平*
(1.福建农林大学生命科学学院,福州 350002;2.福建农林大学菌物研究中心,福州 350002)
赤芝与无柄灵芝担孢子的萌发特性比较
柯斌榕1,2吴小平1,2*
(1.福建农林大学生命科学学院,福州 350002;2.福建农林大学菌物研究中心,福州 350002)
以赤芝Ganoderma lucidum和无柄灵芝Ganoderma resinaceum担孢子为材料,从担孢子采集方法、萌发条件及保藏时间等方面,比较两种担孢子的萌发特性。结果表明,无柄灵芝担孢子在无菌水中培养24 h即可萌发产生芽管,48 h萌发率为6.77%;而赤芝只有早期弹射的新鲜担孢子可以在麦芽汁培养基中萌发,但萌发率仅有1.13%。赤芝担孢子根据形态大小可分为3类,其中可萌发担孢子的平均长为7.38 μm,宽为4.46 μm,小于成熟担孢子,细胞壁颜色也比成熟担孢子浅。灵芝担孢子萌发时一般在担孢子顶端或脐状处产生一个芽管,极少数两处同时产生芽管。新生菌丝在不适宜继续生长条件下,可进一步形成厚垣孢子;且随着担孢子保藏时间的延长,其萌发率快速降低。
赤芝;无柄灵芝;担孢子;萌发率
灵芝又名赤芝、灵芝草,是我国最著名的药用真菌,因其所具有的独特功效为世人所称颂。早在2 000多年前,我国便有了灵芝的记载,从《山海经》到《白蛇传》,从《神农本草经》到《本草纲目》都有关于灵芝的传说和药效的描述[1]。上世纪70年代,林志彬在对灵芝药理和临床研究过程中提出灵芝有“扶正固本”的作用机制,并在长期的研究中证明并完善了这一理论[2]。随着灵芝的功效不断为人所知,市场逐步扩大,与此同时人们对灵芝产品质量要求也不断提高。我国灵芝新品种主要靠野生采集驯化获得,近年来物理诱变[3],原生质体融合[4]及原生质体单核化[5]等技术被广泛应用于灵芝品种的改良,但因赤芝担孢子萌发比较困难,限制了其担孢子遗传多样性的利用和开发。
本研究比较了国内广泛栽培的赤芝和无柄灵芝担孢子的萌发特性,以期了解灵芝担孢子萌发规律,进而获得由担孢子萌发的单核菌株的方法,为灵芝遗传分析与新品种选育和改良打下基础。
1 材料与方法
1.1 菌株
赤芝、无柄灵芝菌株来源于福建农林大学菌物研究中心。
1.2 培养基
麦芽汁液体培养基:取波美度为4度的麦芽汁200 mL加水定容至1 L,121 ℃下灭菌30 min;马铃薯液体培养基:马铃薯200 g,葡萄糖20 g,水l 000 mL,pH自然,121 ℃下灭菌30 min;袋料栽培培养基:75%杂木屑,20%麸皮,3%玉米粉,1%石膏粉,1%轻质碳酸钙,高压灭菌2 h。
1.3 担孢子采集与观察
栽培包菌丝满袋后,进行岀芝管理,选取分化正常的子实体进行信封套袋收集孢子。套袋前预先放置一张硫酸纸在信封中,并进行灭菌处理。套袋时要注意子实体菌管层不能与硫酸纸接触,留一定的空间以利于子实体弹射孢子。每天查看是否有孢子弹射,如有孢子弹射即可进行萌发处理。以光学显微镜和电子扫描显微镜观察担孢子。
1.4 担孢子萌发处理
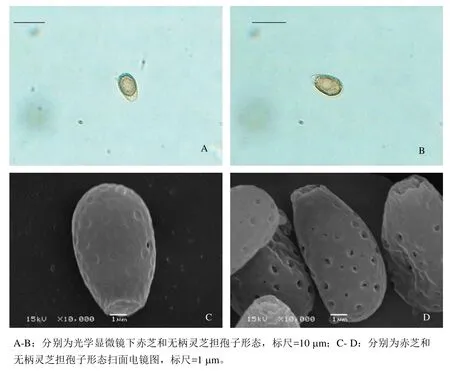
图1 赤芝和无柄灵芝的担孢子形态
将获得的灵芝孢子用装有1 mL无菌水的离心管进行稀释,振荡均匀,形成孢子悬浮液,吸取少许悬浮液于显微镜下观察,控制孢子在10倍物镜视野里面的数量在100~200个之间。最后各取100 μL分别装入含有0.9 mL马铃薯液体的培养基和麦芽汁培养基中,并用无菌水作为对照处理。封口后放在28 ℃的生化培养箱中培养,每隔12 h观察一次。当灵芝孢子萌发出芽管时,即可认为该孢子萌发,并计算萌发率。萌发率=萌发的孢子总数/孢子总数×100%。试验设3个重复。
1.5 孢子大小测定
依据吴晓航的方法[6]加以改进,用显微拍照系统对孢子及镜台测微尺拍照,利用等比例测量原理测定孢子的大小。
2 结果分析
2.1 两种灵芝担孢子形态观察
图1为两种担孢子光学及扫描电子显微镜图片,可以看出赤芝担孢子呈卵圆形或顶端平截,具有双层壁,外壁透明,平滑,内壁淡褐色或近褐色,有小刺,有时中间有油滴状物。扫描电镜下可见担孢子表面有凹陷或少量孔道,孢子基部有脐状附属物,成熟担孢子大小为8.8~9.9×5.0~6.0(μm)。
无柄灵芝担孢子呈卵形,与赤芝孢子相类似,但略大于赤芝孢子,顶部透明塞状结构较赤芝小。具有双层细胞壁,外壁透明,平滑,近无色至淡褐色,中间可见有油滴。扫描电镜下可见孢子表面有明显的孔洞,孢子基部有脐状附属物,成熟担孢子大小为8.5~10.0×6.5~7.0(μm)。
2.2 不同萌发处理对孢子萌发的影响
不同萌发处理试验,赤芝担孢子只在麦芽汁培养基中经培养30 h后,才能观察到有孢子萌发(图2A),48 h后萌发率为1.13%;而无柄灵芝担孢子在无菌水中24 h就可萌发(图2B),在无菌水、马铃薯液体培养基和麦芽汁培养基中48 h的萌发率分别为6.78%、12.07%和23.39%。另还发现,赤芝担孢子只有收集早期新鲜弹射的,才能观察到萌发,子实体成熟期弹射的担孢子未见萌发;而无柄灵芝担孢子,不论收集哪个阶段的担孢子都能够萌发,且萌发率不相上下。
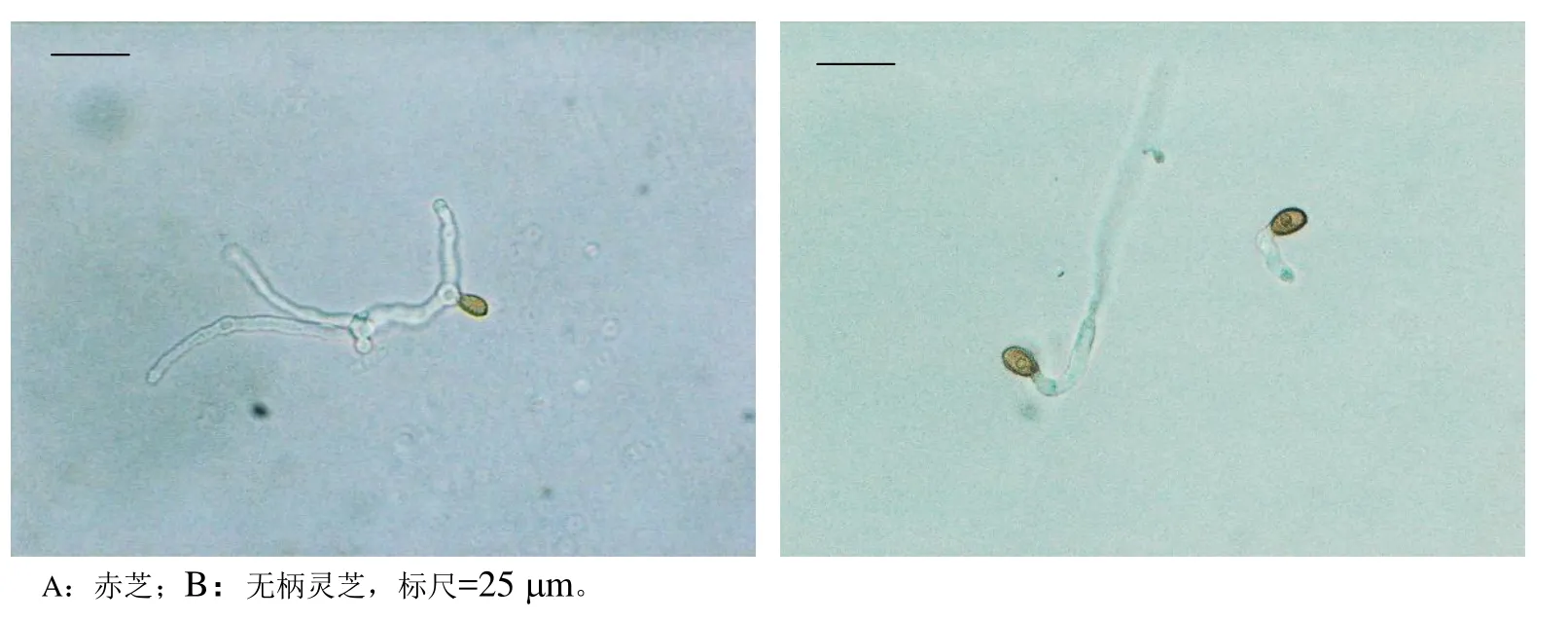
图2 赤芝与无柄灵芝担孢子萌发形态
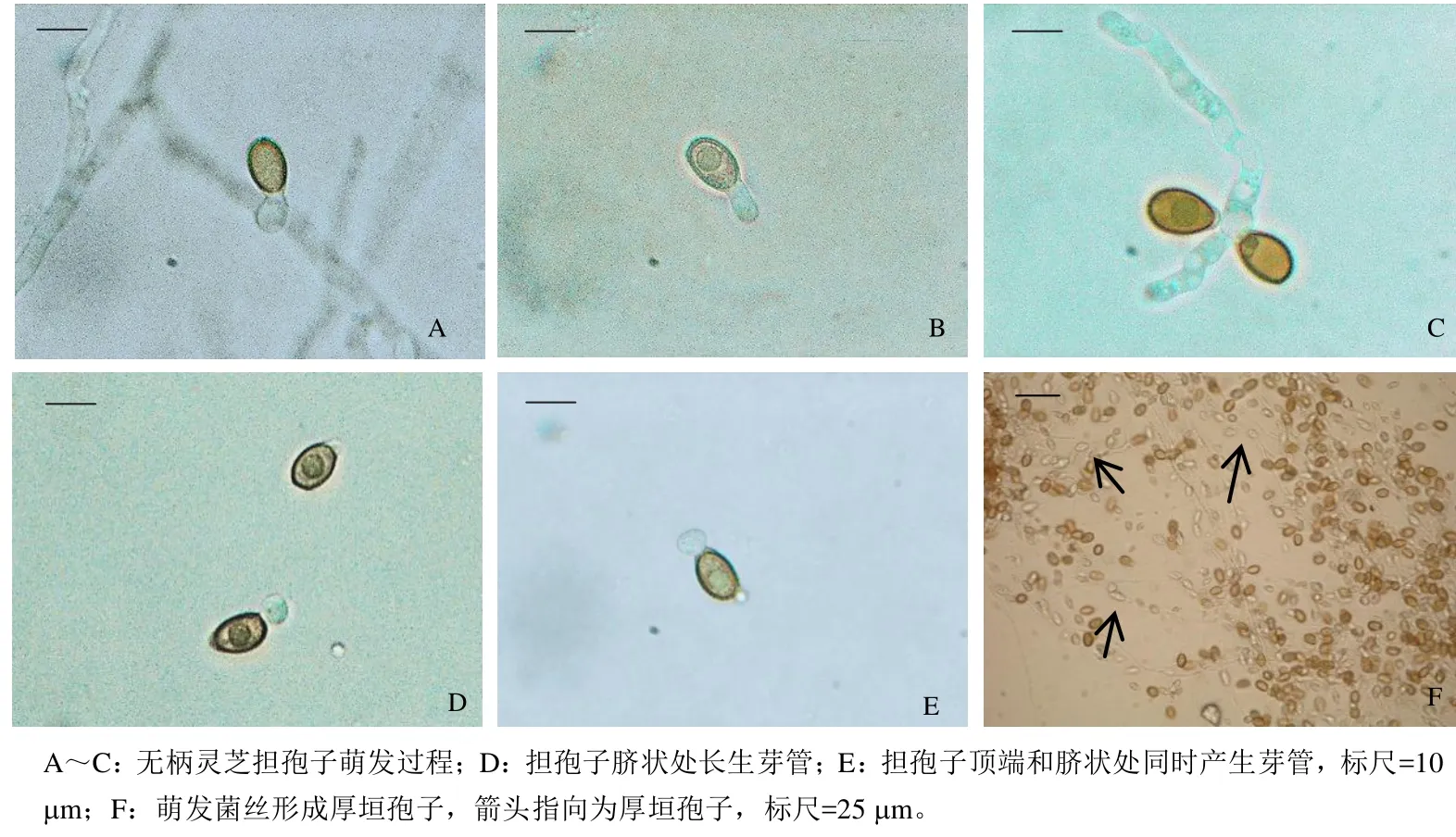
图3 无柄灵芝担孢子萌发过程
2.3 灵芝担孢子萌发特性
赤芝和无柄灵芝担孢子的萌发过程基本相同,大多先在担孢子顶端开始出现芽管或膨大为球状的芽管(图3A),进而形成单根或多根新生菌丝(图3B,C)。也发现少数的芽管在底部脐状处(图3D),或在担孢子顶部和脐状处同时形成(图3E)。萌发过程中担孢子仍保存完整的形态结构,逐渐变为透明中空状态。此外,无柄灵芝担孢子在水中萌发后,菌丝能够利用孢子自身营养物质快速生长,并在后期营养不足时形成大量膨大厚壁的厚垣孢子(图3F)。
2.4 赤芝担孢子大小与萌发率关系
通过比较萌发孢子与未萌发孢子形态,发现赤芝具有萌发能力的孢子颜色较浅且孢子较小,而无柄灵芝未萌发的孢子与萌发的孢子则没有差别。采用显微测量比较未萌发与萌发的赤芝担孢子,可以将早期新鲜弹射的赤芝担孢子分为三类(图4):第Ⅰ类为发育成熟的担孢子,其平均长为9.74μm,宽为5.56 μm,属典型瓜子形(图5B),该类担孢子不能萌发,占总数的80.43%;第Ⅱ类为发育不良的担孢子,其平均长为7.85 μm,宽为3.78 μm,呈细长形(图5C),该类担孢子也不能萌发,占总数的13.87%;第Ⅲ类担孢子平均长为7.38 μm,宽为4.46 μm,呈近椭圆形(图5D),该类担孢子可萌发,占总数的5.70%。此外,随着赤芝子实体不断发育成熟,所弹射的孢子中Ⅰ类孢子所占比重加大,Ⅲ类孢子所占比例下降。
2.5 孢子保藏时间与萌发率的关系
试验过程中发现孢子萌发率与保藏天数关系密切。赤芝担孢子室温避光放置一天就很难观察到孢子萌发,而无柄灵芝担孢子室温保藏4天仍有3.19%的萌发率(图6)。因此赤芝担孢子萌发实验时,应采用当天收集的担孢子。
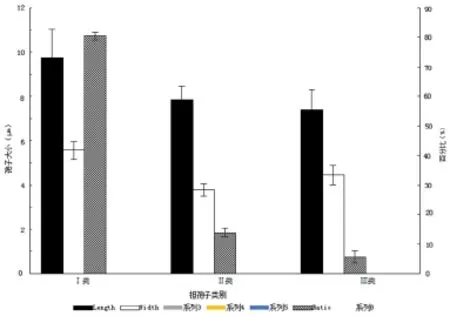
图4 赤芝三类担孢子大小及所占比例
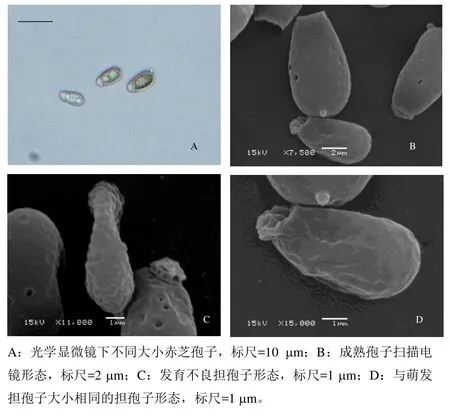
图5 不同大小的赤芝孢子形态
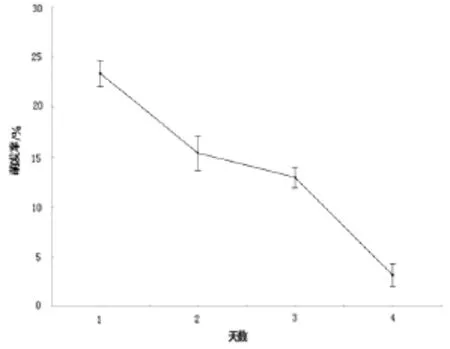
图6 无柄灵芝担孢子不同保藏时间的萌发率
3 讨 论
灵芝担孢子作为灵芝的有性孢子,不仅可以作为一种保健品,而且是灵芝品种改良和遗传分析的重要材料。在光学显微镜下观察无柄灵芝和赤芝的担孢子,其形态相近,如果不加以细致区分有可能造成混淆。扫描电镜可以看见无柄灵芝的细胞壁表面有较多的孔道,明显区别于赤芝担孢子。灵芝属真菌其担孢子都具有双层细胞壁结构,但不同灵芝种间的担孢子形状与构造不尽相同。不同的细胞壁结构与表面孔道和纹饰,可以用于区分不同种的灵芝,同时结构差异也可能影响孢子的萌发率。Leslie在进行灵芝孢子结构研究时指出,孢子的双层厚壁结构可能会阻碍孢子的萌发[7]。
通过比较赤芝和无柄灵芝的担孢子萌发特性,发现二者在担孢子萌发率上差异很大,且萌发处理条件也有区别。赤芝的担孢子不仅萌发率低,且对担孢子收集的时间和处理的方法都有一定要求。在收集担孢子的过程中还发现,与常见伞菌子实体不同,灵芝只有生长中的子实体才能弹射担孢子,而采收下来的子实体则不能通过弹射收集到孢子。尽管在实验条件下很早就观察到赤芝担孢子萌发,并测定萌发率在1%~2%之间[8~10],但也有很多不成功的案例[11,12]。也有研究表明赤芝担孢子萌发率可达到8%~15%或70%[13,14]。由于近年来研究表明灵芝G. lucidum与我国广泛栽培的赤芝并不是相同的种[15],所以前人研究所用的品种是否与本研究相同很难确定。
不同种灵芝担孢子的萌发率差异很大,如本研究中的无柄灵芝孢子的萌发达到23.39%;狭长孢灵芝Ganoderma boninense担孢子在多种培养基中都可以萌发,48 h最大萌发率可达97.5%[16]。因此灵芝间截然不同的担孢子萌发率,可能暗示着它们在担孢子传播上的不同策略。一类是通过高萌发率来保证传播的成功率;另一类是通过采用在特定条件下萌发以克服不利条件,如赤芝成熟担孢子较厚的细胞壁既有利于承受传播过程中不利环境的影响,也能够在通过昆虫消化系统以后仍有较大的存活机率,进而保证担孢子的传播。
实验中发现赤芝担孢子萌发与其孢子大小和孢子颜色有关,很可能是因为萌发的孢子个体小、细胞壁发育还不完全,可以在适合条件下萌发。赤芝担孢子的萌发率与孢子采集的新鲜程度以及萌发处理方式有密切关系,用于萌发实验的孢子最好是灵芝子实体最早弹射的一批孢子。有人认为做萌发实验时应选用后期释放的孢子,认为后期担孢子细胞壁几丁质程度较低有利于担孢子萌发[13]。Nuss通过对灵芝孢子萌发规律的研究指出,前期孢子萌发迅速,而后期弹射的孢子必须先通过昆虫的肠道消化才能萌发[17]。这一点也在橡胶灵芝Ganoderma pseudoferreum担孢子喂养大蚊幼虫的实验中得到证明[18]。借助于本研究能够获得赤芝担孢子萌发的单核菌株,可以用于遗传分析和品种改良工作,而如何打破成熟赤芝担孢子的休眠,提高其萌发率,则还需要作进一步的研究。
[1] 林志彬. 灵芝的现代研究(第三版)[M]. 北京: 北京大学医学出版社, 2007: 1-12.
[2] 林志彬. 中西医结合研究诠释灵芝的扶正固本功效[J]. 福建中医药大学学报, 2010, 20(6): 1-3.
[3] 李刚, 杨凡, 李瑞雪, 等. 原生质体紫外诱变选育灵芝新菌种的研究[J]. 微生物学报, 2001, 41(2): 229-233.
[4] 彭卫红, 郑林用, 甘炳成, 等. 灵芝原生质体融合HH系列菌株的选育研究[J]. 西南农业学报, 2006, 19(3): 498-501.
[5] 吴小平, 刘方, 谢玉荣, 等. 灵芝原生质体单核化杂交育种[J]. 中国农学通报, 2009, 25(23): 64-69.
[6] 吴小航, 吴军. 同倍显微相片测微尺法[J]. 辽宁师范大学自然科学学报, 1991, 14(1): 69-73.
[7] Leslie CC. Structure of spore wall in Ganoderma[J]. Botanical Gazette, 1927, 83(1): 48-60.
[8] Bose SR. Artificial culture of Ganoderma lucidum Leyss from spore to spore[J]. Botanical Gazette, 1929, 87: 665-667.
[9] Subodh KS. Spore-germination of Ganoderma lucidum (Leyss. Ex Fr. ) Karst[J]. Current Science, 1943, 12(2): 59-60.
[10] Anjali S. Nuclear phenomena in the life cycle of Ganoderma lucidum (Leyss. Ex Fr. ) Karst[J]. Canadian Journal of Botany, 1959, 37: 59-64.
[11] Venkatarayan SV. The biology of Ganoderma lucidum on area cocoanut palms[J]. Phytopathology, 1936, 26: 153-175.
[12] 林俊华, 邓优锦, 谢宝贵. 灵芝原生质体单核化杂交子的评价[J]. 福建农林大学学报(自然科学版), 2010, 39(5): 534-537.
[13] 陆文樑, 常永祯. 灵芝子实体人工培养中某些生物学特性研究[J]. 植物学报, 1975, 17(2): 153-159.
[14] 王德芝, 陈琼. 几种因素对灵芝孢子萌发的影响[J]. 中国农学通报, 2009, 25(23): 102-104.
[15] 戴玉成, 曹云, 周丽伟, 等. 中国灵芝学名之管见[J]. 菌物学报, 2013, 32(6): 947-952.
[16] Ho YW, Nawawi A. Germination studies of Ganoderma boninense spores from oil palms in Malaysia[J]. Pertanika, 1986, 9(2): 151-154.
[17] Nuss I. Die bedeutung der proterosporen: schiussfolgerungen aus unter uchungen an Ganoderma (basidiomyeetes) [J]. Plant Systematics and Evolution, 1982, 141: 53-79.
[18] Lim TM. Production germination and dispersal of basidiospores of Ganoderma pseudoferreum on Hevea[J]. Journal of the Rubber Research Institute of Malaysia, 1977, 25(2): 93-99.
Characteristics comparison of basidiospore germination of Ganoderma lucidum and Ganoderma resinaceum
Ke Binrong1,2Wu Xiaoping1,2*
(1. School of Life Sciences of Fujian Agriculture and Forestry University, Fuzhou, 350002, China;2. Mycological Research Center of Fujian Agriculture and Forestry University, Fuzhou, 350002,China)
Based on the materials of the basidiospores of Ganoderma lucidum and Ganoderma resinaceum, the germination characteristics were compared in the aspects of the collecting methods, germination conditions, storage time and etc. The results showed that the basidiospores G. resinaceum germinated germ tubes in 24h in the sterile water, and after 48h the germination rate reached to 6.77%. And only the fresh catapulting basidiospores could germinate in wort medium though the germination rate of G. lucidum was just 1.13%. According to the size and morphology, the basidiospores of G. lucidum can be divided into three categories. The average length and width of germinable G. lucidum basidiospores were 7.38μm and 4.46μm, respectively, smaller than the mature basidiospores. And the color of the cell walls was aslo lighter than that of the mature basidiospores. The germination process was featured with a germ tube on the top of basidiospores or in the hilum, in rare cases one germ tube in each part. If the conditions were not fit for mycelium growth, chlamydospore would take shape. With the storage time goes on, the germination rate will fall rapidly.
Ganoderma lucidum; Ganoderma resinaceum; basidiospore; germination rate
S567.3+1
A
2095-0934(2015)05-282-06
福建省种业创新与产业化工程专项项目“灵芝种业创新及产业化工程”(项目编号:2014S1477-21)
柯斌榕(1986—),男,福建农林大学2010级硕士研究生,现分配福建省农业科学院食用菌研究所工作
吴小平(1965—),博士,教授,主要从事食药用菌教学及科研工作。E-mail:fjwxp@126.com

