异黄酮分子与人血清白蛋白的相互作用
兰玲,袁婧威,赵成新,李起龙,杨大伟,于东声,陈学聪,王雪岭,陈宏博,张秀凤
(华北理工大学 化学工程学院,河北 唐山 063009)
异黄酮分子与人血清白蛋白的相互作用
兰玲,袁婧威,赵成新,李起龙,杨大伟,于东声,陈学聪,王雪岭,陈宏博,张秀凤
(华北理工大学 化学工程学院,河北 唐山 063009)
人血清白蛋白;大豆素;葛根素;荧光猝灭;特异性结合;构象改变
通过紫外光谱法、荧光光谱法和圆二色谱法研究了异黄酮类小分子(大豆素和葛根素)与人血清白蛋白的结合常数、结合位点及结合距离等相互作用机制。结果发现在具有相同结合位点的情况下葛根素与人血清白蛋白的结合能力高于大豆素,主要归因于在相同的母核结构上葛根素比大豆素多一个葡萄吡喃糖基,导致反应的结合能力不同。且经过计算得知,异黄酮分子通过形成不发光复合物和F0··rster能量转移使人血清白蛋白发生静态猝灭。圆二色光谱中葛根素使蛋白质中的α-螺旋含量增加,蛋白结构更加紧密导致蛋白质构象发生变化。研究结果表明:葛根素与人血清白蛋白的特异性结合能力高于大豆素,这对于临床医学、制药学等都具有十分重要的意义。
人血清白蛋白(Human Serum Albumin,简称HSA)是人血浆中的蛋白质,其非糖基化的单链多肽[1],包含585个氨基酸,分子量为66 kD。在体液中HSA可以运输和储存脂肪酸、胆色素、氨基酸、类固醇激素、金属离子及许多内源性和外源性物质[2-4],同时维持血液正常的渗透压。大豆素和葛根素均属于异黄酮类化合物,具有相同的芳香母核结构,两分子主要区别在于葛根素具有一个葡萄吡喃糖基,羟基个数增多,且羟基反应活性较高,羟基数目可能会影响反应结合能力,大豆素和葛根素分子式如图1和图2。大豆异黄酮具有抑制乳腺癌、膀胱癌、前列腺癌、白血病及某些肝癌和胃癌细胞系的生长、增殖及抗促癌和诱导癌细胞分化的作用[5,6];葛根素具有扩张冠状动脉和脑血管,增加心、血流量和降低心肌氧耗量,提高免疫力,抗血小板聚集等作用。由于小分子的结构会影响其与HSA的结合,因此本文采用荧光光谱、紫外可见吸收光谱和圆二色谱(CD)研究大豆素和葛根素与HSA相互作用以及比较二者与HSA结合能力的大小。从而为今后由HSA异常导致的疾病或调节HSA来达到治疗效果提供重要理论依据。
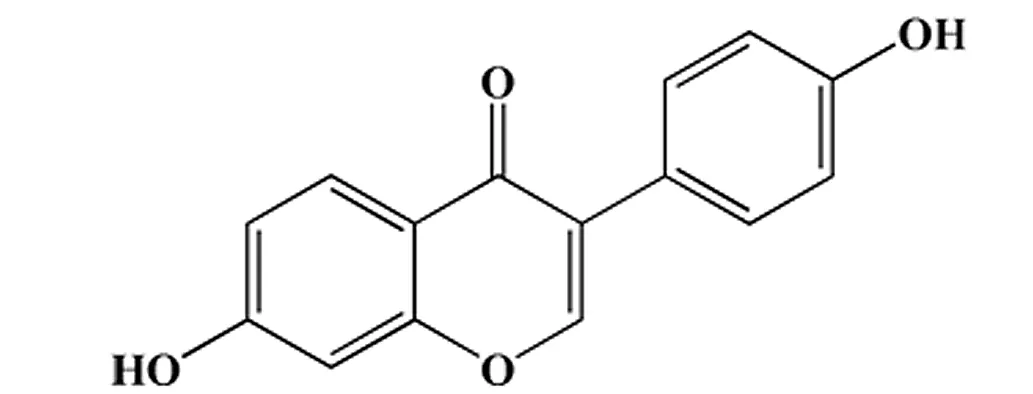
图1 异黄酮大豆素分子式
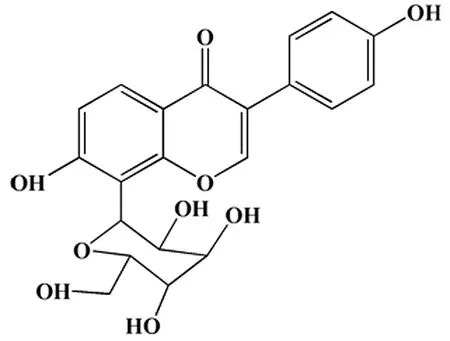
图2 异黄酮葛根素分子式
1试验部分
1.1试验仪器与试剂
F-7000型荧光光谱仪(日本日立公司);Jasco 815圆二色谱仪(日本分光公司);TU-1901型双光束紫外-可见分光光度计(北京普析公司);186QTP型超声清洗器(北京科玺时代科技有限公司)。
人血清蛋白(HSA,A-1653):生物试剂,Sigma公司。
大豆素和葛根素:深圳美荷生物有限公司。
磷酸氢二钠(Na2HPO4·12H2O):天津市天力化学试剂有限公司(分析纯)。
氯化钠(NaCl):天津市光复科技发展有限公司(分析纯)。
磷酸二氢钠(NaH2PO4·2H2O):天津市天力化学试剂有限公司(分析纯)。
试验用水为超纯水。
1.2试验方法
1.2.1样品的制备
分别称取一定量的大豆素和葛根素,用pH7.4的PBS缓冲溶液(7.5 mM NaH2PO4·2H2O, 1.8 mM Na2HPO4·12H2O和1.2 mM NaCl, 用超纯水溶解并定容至250 ml)稀释成大豆素和葛根素母液,准确称量一定量的HSA,用缓冲溶液溶解并稀释成HSA母液,母液避光储存于4 ℃冰箱内。
用移液器按比例分别移取一定体积的大豆素和葛根素、HSA溶液和PBS缓冲液于2 ml离心管配置一系列不同浓度比的药物和HSA混合溶液。样品在室温295 K下避光保存12 h。
荧光光谱和紫外可见吸收光谱测量的样品溶液蛋白质的最终浓度为1×10-5mol/L,圆二色谱实验的样品溶液中蛋白质的终浓度为2.5×10-6mol/L。
1.2.2光谱试验测定
荧光光谱和紫外可见吸收光谱试验中采用的激发光源为氘灯,激发波长为295 nm,发射波长为300~700 nm,扫描速度为120 000 nm/min,激发波长与发射波长的狭缝宽度均为2.5 nm,采集数据前先用PBS缓冲溶液对仪器进行校正。
圆二色谱试验中HSA最终浓度为2.5×10-6mol/L,试验前先用纯N2除氧,且在试验过程中一直用纯N2作保护气,以防臭氧的出现,采集数据前用PBS缓冲溶液进行校正。试验采用的样品池光程为1 cm,扫描速度240 nm/min,扫描间隔为0.5 nm,扫描4次取平均值。
2结果与讨论
2.1大豆素/葛根素对HSA的荧光猝灭
2.1.1荧光猝灭光谱
荧光光谱法能够提供较多的荧光参数如激发光谱、发射光谱以及荧光强度、量子产率、荧光寿命、荧光偏振等,这些参数从各个角度反映了分子的成键和结构情况以及发光特性。通过对这些参数的测定,可得到许多关于蛋白质与小分子作用的信息如结合常数、结合位点数、结合位置、作用力类型以及蛋白质分子在相互作用中结构的变化等有用的信息,从而阐明蛋白质结构与功能的关系。HSA属于内源性荧光物质,分子内含有色氨酸(Trp),酪氨酸(Tyr)以及苯丙氨酸(Phe)3种芳香族氨基酸残基能发射荧光,当激发波长为295 nm时,HSA的内源性荧光主要来自于Trp残基,药物小分子与蛋白质相互作用时,小分子往往能够猝灭蛋白质的内源性荧光,因此荧光猝灭技术最为常用[7]。
图3(a)和图3(b)分别为异黄酮分子大豆素和葛根素与HSA在激发波长为295 nm和pH为7.4时的荧光发射谱图。由图可见,荧光发射峰位置在341 nm附近,随着大豆素和葛根素小分子浓度的增加,HSA的荧光强度明显减弱并伴有红移现象,说明HSA与大豆素和葛根素小分子的结合使色氨酸周围的微环境发生了改变,说明色氨酸的疏水性增强了[8-10],异黄酮小分子的加入使HSA的更多疏水性残基包埋进疏水腔内使其结构更加紧密,肽链伸展程度降低,多肽C=O骨架结构的π-π*电子发生转移使得HSA空间构象发生一定改变。葛根素和大豆素分别在413 nm和416 nm处出现等发射点,说明2种分子均与HSA可能形成复合物,是HSA发生荧光猝灭的原因之一。

(a) HSA在大豆素不同浓度下的荧光猝灭光谱 (b)HSA在葛根素不同浓度下的荧光猝灭光谱
2.1.2荧光猝灭机制
为了进一步明确其猝灭机制进行具体计算分析。荧光猝灭是指由于荧光物质分子与溶剂分子或其它溶质分子的相互作用引起的荧光强度降低的现象,大体上可分为静态猝灭和动态猝灭[11]。静态猝灭是指猝灭剂分子与荧光物质分子之间形成了新的复合物,一般来说所生成的新的复合物是非荧光物质;动态猝灭是猝灭剂分子与荧光分子的激发态分子之间的相互碰撞而导致的荧光猝灭,遵循Stern-Volmer方程[12]。
假设HSA的荧光猝灭是个动态猝灭过程,那么用修正的Stern-Volmer方程分析荧光猝灭:
(1)
计算动态猝灭速率常数。其中F0、F分别表示与小分子作用前后人血清蛋白荧光发射峰的强度,[Q]为小分子的浓度,Ksv为Stern—Volmer猝灭常数,fa为荧光体的荧光被猝灭的分数,Kq为生物大分子的荧光猝灭过程速率常数,τ0为无猝灭剂存在下蛋白质的荧光寿命,HSA的τ0为4.6 ns。经计算可以得到大豆素fa=1.2,Ka=4.612×104M;葛根素fa=0.5,Ka=8.256×103M。而生物大分子的荧光猝灭速率常数Kq,可以用以下公式:
Kq=Ksv/τ0
(2)
因此,大豆素荧光猝灭速率常数Kq=1.002×1013M-1s-1;葛根素荧光猝灭速率常数Kq=1.795×1012M-1s-1。大豆素和葛根素的Kq均远远大于各类猝灭剂对生物大分子的最大动态扩散猝灭常数2×1010M-1s-1,因此动态猝灭不是小分子与HSA荧光猝灭的主要原因,而是以静态猝灭为主的荧光猝灭过程。
2.2结合常数和结合位点的分析
由上述分析可以确定大豆素和葛根素对人血清蛋白的荧光猝灭是一个静态猝灭过程,那么用Logarithmic公式分析大豆素和葛根素与HSA结合常数Ka及结合位点数n[13]:
(3)
以 lg[(F0-F)/F]对lg[Q]作图,得到大豆素—HSA体系和葛根素—HSA体系对数关系图(图4(a)和图4(b)),利用对数曲线的斜率和截距可以得到大豆素和葛根素与HSA之间的结合常数和结合位点数

表1 异黄酮小分子与HAS的结合参数

(a)不同浓度大豆素对HSA荧光猝灭对数曲线

(b)不同浓度葛根素对HSA荧光猝灭对数曲线
从表1 可以看出,大豆素与HSA的结合常数小于葛根素与HSA的结合常数,大豆素和葛根素与HSA的结合位点数约为1,说明大豆素和葛根素在HSA上主要有一个特异性结合位点。在具有相同结合位点的情况下葛根素的结合常数明显大于大豆素,说明葛根素与HSA存在很强的结合能力,这主要归因于大豆素与葛根素结构不同[14]。葛根素的葡萄吡喃糖基使分子含6个羟基,而大豆素分子上仅有2个羟基。推测羟基的活性影响了小分子与HSA的复合物的稳定性,最终羟基的数目影响了大豆素与葛根素的结合能力的差异。综上所述可以看出:在此体系中葛根素在结合过程中具有明显的优势。
2.3大豆素/葛根素与HSA之间非辐射能量转移
如图5(a)和图5(b),大豆素和葛根素的紫外可见吸收光谱与大豆素/葛根素—HSA的荧光发射光谱之间存在很大程度的重叠,因此很有可能存在非辐射能量转移。在很多药物和蛋白质相互作用的过程中都存在着这样的机制[15]。假设药物对蛋白质的荧光猝灭为非辐射能量转移,根据Fo··rster非辐射能量转移理论,转移效率E与给体—受体间距离r及临界距离R0相关,当荧光分子的发射光谱和猝灭剂的吸收光谱发生重叠且结合距离小于8 nm时,就会发生非辐射能量转移。根据Fo··rster非辐射能量转移理论[17],能量转移效率(E)与结体-受体之间的结合距离(r)和能量转移效率为50 %的临界能量转移距离(R0)的关系为:[16,17]
(4)
(5)
(6)
式中F为蛋白质和药物浓度比为1时蛋白质的荧光强度,F0为与药物作用前蛋白质的荧光强度,这里R0为E=50 %时的临界距离,公式(4)中K2为偶极空间取向因子(取蛋白质-药物各向随机分布的平均值K2=2/3),N为介质的折射指数(取水和有机物的平均值N=1.336),Φ为给体的光量子产率(对HSA中色氨酸残基量子效率Φ=0.118)[18],将图5(a)和图5(b)中的重叠部分在310~470 nm范围内求重叠积分,得到大豆素和葛根素的重叠积分J分别为:J1=8.36×10-16cm3·L·mol-1,J2=1.67×10-14cm3·L ·mol-1。计算得大豆素与HSA结合作用的能量转移参数:E=20.83%,R0=1.62 nm,r=2.03 nm;计算得葛根素与HSA结合作用的能量转移参数E=31.37%,R0=2.81 nm,r=3.19 nm。由计算结果可知,大豆素和葛根素与HSA的结合距离均小于8 nm,因此可以推断非辐射能量转移也是大豆素和葛根素引起HSA荧光猝灭的原因之一。
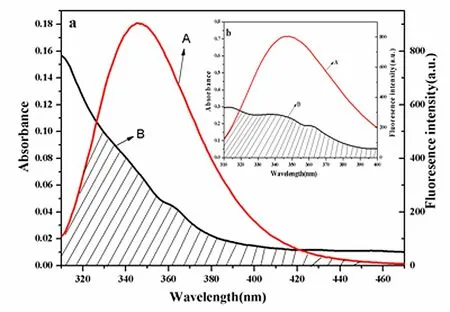
(a)HSA的荧光发射光谱(A)与大豆素的紫外吸收光谱(B)的重叠图;(b)HSA的荧光发射光谱(A)与葛根素的紫外吸收光谱(B)的重叠图
2.4大豆素/葛根素-HSA体系CD光谱分析
由以上分析得出,大豆素和葛根素与HSA有较强的结合能力,在小分子与HSA结合使HSA发生荧光猝灭的同时,发射峰的位置随着小分子浓度的增加发生了红移现象,说明HSA中的色氨酸所处微环境发生了改变,引起蛋白质二级结构发生改变。为了进一步研究小分子对HSA的影响,运用圆二色谱对其进行分析。圆二色光谱法是一种快速简单准确的测蛋白质二级结构的常用方法,利用光学活性物质对组成平面偏振光的左旋和右旋圆偏振光的吸收系数是不相等的性质来进行测定,从而推断有机物的构型和构象。

a:大豆素:HSA=0.5:1,b:葛根素:HSA=0.5:1
从图6可以看出,HSA在212 nm和221 nm处有2个负肩峰,这是典型的α-螺旋结构。加入大豆素后,HSA的2个摩尔椭圆率和峰位没有改变,而加入葛根素后,HSA的摩尔椭圆率明显降低,而其峰位没有改变。利用公式
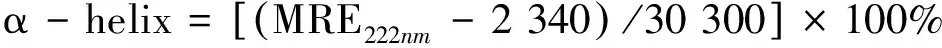
式中θobs为CD谱测得的摩尔椭圆率,n代表HSA中氨基酸的个数为585,l代表所用样品池的光程为1 mm,Cp代表蛋白质的摩尔浓度。计算得知,在加入葛根素后人血清白蛋白的α-螺旋结构含量增加,由31.31%升至37.41%(葛根素和HSA摩尔比为0.5)表明在葛根素与HSA结合后,HSA的二级结构发生了改变,肽链收缩,导致α-螺旋结构含量增加,而造成大豆素和葛根素2种结果的原因是葛根素在结构上比大豆素在结构上多了一个多羟基葡萄吡喃糖基,可能是所含羟基的数量造成的影响。
3结论
通过紫外光谱法、荧光光谱法和圆二色光谱法分析得知大豆素与葛根素同HSA都有较好的结合能力,其中葛根素的结合能力更强。荧光光谱中,在HSA中加入大豆素和葛根素后都出现了明显的荧光猝灭的现象,经过计算可知是静态猝灭过程,且光谱的峰值发生了红移的现象,证明色氨酸的亲水性增加了。大豆素和葛根素的结合位点都为1,但大豆素比葛根素的结合常数小,因此葛根素比大豆素的结合能力强,二者的结合距离均小于8 nm,是非辐射能量转移。圆二色光谱分析表明在加入葛根素后,HSA中的α-螺旋结构增加了6.1%,而同样条件下加入大豆素却没有明显改变,说明葛根素使蛋白质中的二级结构发生了改变,葛根素与HSA之间的相互作用更强。葛根素与HSA结合具有明显优势为研究人血清蛋白与黄酮小分子特异性结合从而研究抗肿瘤等药物提供了理论基础。
[1]易平贵,俞庆森,商志才,等. 氧氟沙星与牛血清白蛋白相互作用机制[J]. 药学学报, 2000, 35(10): 774-777.
[2]KRAGH-HANSEN U. Molecular aspects of ligand binding to serum albumin[J]. Pharmacol Rev, 1981, 33(1): 17-53.
[3]HE X M, CARTER D C. Atomic structure and chemistry of human serum albumin[J]. Nature, 1992, 358: 209-215.
[4]ZHANG X, SHU C, XIE L, et al. Protein conformation changes induced by a novel organophosphate-containing water-soluble derivative of a C60 fullerene nanoparticle[J]. J Phys Chem C, 2007, 111(39): 14327-14333.
[5]白雪,周成合,米佳丽. 三唑类化合物研究与应用[J]. 化学研究与应用, 2008, 19(7): 721-729.
[6]LIU Z, LAROCK R C. Synthesis of carbazoles and dibenzofurans via cross-coupling of o-iodoanilines and o-iodophenols with silylaryl triflates and subsequent Pd-catalyzed cyclization[J]. Tetrahedron, 2007, 63(2): 347-355.
[7]MULLER B G, LEUENBERGER H, KISSEL T. Albumin nanospheres as carriers for passive drug targeting: an optimized manufacturing technique[J]. Pharm Res, 1996, 13(1): 32-37.
[8]DEEPA S, MISHRA A K. Fluorescence spectroscopic study of serum albumin-bromadiolone interaction: fluorimetric determination of bromadiolone[J]. J Pharm Biomed Anal, 2005, 38(3): 556-563.
[9]MALLICK A, MAITI S, HALDAR B, et al. Photophysics of 3-acetyl-4-oxo-6,7-dihydro-12H indolo-[2,3-a] quinolizine: emission from two states[J]. Chem Phys Lett, 2003, 371(5): 688-693.
[10]KUNDU S, MAITY S, BERA S C, et al. Twisted intramolecular charge transfer of dimethylaminobenzonitrile in micellar environments A way to look at the orientation of the probe within the apolar microenvironment[J]. J Mol Struct, 1997, 405(2): 231-238.
[11]ZHANG H R, GUO S Y, LI L, et al. Study on the interaction between sparfloxacin and serum albumins by fluorescence[J]. Spectrosc Spect Anal, 2001, 21(6): 829-832.
[12]LEHRER S. Solute perturbation of protein fluorescence quenching of the tryptophyl fluorescence of model compounds and of lysozyme by iodide ion[J]. Biochemistry, 1971, 10(17): 3254-3263.
[13]KANG J, LIU Y, XIE M X, et al. Interactions of human serum albumin with chlorogenic acid and ferulic acid[J]. Biochim Biophys Acta: General Subjects, 2004, 1674(2): 205-214.
[14]王荣,赵文华,贾风燕,等. 不同羟基数目黄酮类药物与牛血清蛋白间相互作用[J]. 烟台大学学报(自然科学与工程版),2011, 24(1): 34-38.
[15]ZHANG G, KEITA B, BROCHON J C, et al. Molecular interaction and energy transfer between human serum albumin and polyoxometalates[J]. J Phys Chem B, 2007, 111(7): 1809-1814.
[16]LUK C K. Study of the nature of the metal-binding sites and estimate of the distance between the metal-binding sites in transferrin using trivalent lanthanide ions as fluorescent probes[J]. Biochemistry, 1971, 10(15): 2838-2843.
[17]孙洋. 蛋白质标记荧光探针的光谱研究及分析应用[D].西安:西北大学, 2012.
[18]TIAN M Y, ZHANG X F, XIE L,etal. The effect of Cu2+ on the interaction between an antitumor drug-mitoxantrone and human serum albumin[J]. J Mol Struct, 2008, 892: 20-24.
Interaction between Isoflavonoid and Human Serum Albumin
LAN Ling,YUAN Jing-wei,ZHAO Cheng-xin,LI Qi-long, YANG Da-wei,YU Dong-sheng,CHEN Xue-cong,WANG Xue-ling,CHEN Hong-bo,ZHANG Xiu-feng
(College of Chemical Engineering, North China University of Science and Technology, Tangshan Hebei 063009, China)
human serum albumin;daidzein;puerarin;fluorescence quenching;specific binding;conformation changes
The mechanisms and binding sites and binding affinity of interaction between isoflavonoid (daidzein and puerarin) and human serum albumin(HSA), respectively, were investigated by Fluorescence, UV-Vis absorption and Circular Dichroism (CD) spectroscopy under simulative physiological conditions. The results showed that the binding affinity between puerarin and HSA was higher than that of daidzein attributed to a glucopyranosyl located in the core aromatic ring structure of puerarin to increase the reaction activity. And The data of fluorescence spectra displayed that the formation of HSA-isoflavonoid complex is a static quenching process. In addition, puerarin binding induced relatively an increased of α-helix content in HSA than daidzein and make the HSA structure more closely as well as a certain conformation changes, which confirmed by the CD. Our study suggested that puerarin was a ligand for HSA with good affinity and specific binding. The results all has the very vital significance for clinical medicine, pharmaceutics and so on.
2095-2716(2015)04-0045-08
Q51
A

