乙酰化改性对米渣蛋白功能性质的影响
任仙娥,杨 锋,*,黄永春,杨德华,黄 雪(.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室,广西柳州545006;3.广西高校糖资源加工重点实验室,广西柳州545006)
乙酰化改性对米渣蛋白功能性质的影响
任仙娥1,2,3,杨锋1,2,3,*,黄永春1,2,3,杨德华1,黄雪1
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室,广西柳州545006;3.广西高校糖资源加工重点实验室,广西柳州545006)
采用乙酰化对米渣蛋白进行改性,研究了米渣蛋白在乙酰化改性过程中巯基和二硫键含量、表面疏水性、溶解性以及乳化性的变化。结果表明,随改性程度的增加,米渣蛋白中暴露巯基含量逐渐增加,总游离巯基含量逐渐下降,二硫键含量逐渐增加,表面疏水性先下降后升高。乙酰化改性后的米渣蛋白在pH5~10范围内的溶解性、乳化活性和乳化稳定性明显增加,但是pH2~4范围内的溶解性和乳化活性却有所降低。可见,乙酰化改性能改善米渣蛋白的部分功能性质。
乙酰化改性,米渣蛋白,功能性质
对蛋白质进行改性的方法主要有物理改性、化学改性和生物学改性等。笔者曾采用水力空化技术对米渣蛋白进行改性,发现水力空化在一定条件下能改善米渣蛋白的部分功能性质[3]。乙酰化改性是蛋白质化学改性中常用的手段,研究表明乙酰化改性能有效地改善蛋白质的溶解性、乳化性、起泡性等功能性质。如大豆分离蛋白经乙酰化改性后其溶解性、乳化性和起泡性明显提高[4],蚕蛹蛋白经乙酰化改性后溶解性比改性前提高了39.27%[5],乙酰化改性后的面筋蛋白质溶解性、乳化能力和起泡能力均得到了提高[6]。基于此,本文采用乙酰化对米渣蛋白进行改性,研究乙酰化改性对米渣蛋白溶解性和乳化性的影响,以及乙酰化改性过程中米渣蛋白暴露巯基、游离巯基、二硫键含量的变化和表面疏水性的变化情况,为拓宽米渣蛋白的应用提供理论基础。
1 材料与方法
1.1材料与仪器
湿米渣(经测定含水量为49.5%) 广西柳州顺意来生物科技有限公司;福林酚试剂、牛血清白蛋白、5,5-二巯基-2,2-二硝基苯甲酸(DTNB)、8-苯胺-1-萘磺酸(ANSA)上海楷洋生物技术有限公司;其他试剂均为分析纯。
722分光光度计上海精密科学仪器有限公司;100LK高剪切混合乳化头上海威宇机电制造有限公司;Avanti J-26 XPI高速冷冻离心机Beckman Coulter公司;F-320荧光分光光度计天津港东科技发展股份有限公司。
1.2实验方法
1.2.1米渣蛋白的制备采用碱提酸沉法提取米渣蛋白。称取100 g湿米渣,加入2000 mL pH10.0的NaOH溶液,于40℃下搅拌提取4 h,5000 r/min离心分离10 min,取上清液用1 mol/L盐酸溶液调pH至4.5,静置,5000 r/min离心分离10 min取沉淀,用200 mL蒸馏水水洗沉淀2次,再用1 mol/L NaOH调pH至7.0,冷冻干燥,所得产品即为米渣蛋白[3]。经微量凯氏定氮法测定蛋白质含量为70.4%,可能还含有淀粉、糊精等多糖类成分。
1.2.2乙酰化改性米渣蛋白参照文献[7]的方法,稍作修改,具体操作方法如下:称取3 g米渣蛋白分散于100 mL蒸馏水中,配制成浓度为3%(w/v)蛋白分散液,再用2 mol/L NaOH溶液调节pH至8.0,逐渐加入适量乙酸酐,并维持分散液的pH在7.5~8.5,待分散液的pH稳定在8.0后,继续反应1 h,使米渣蛋白与乙酸酐的酰化反应完全,整个过程控制反应温度在40℃。反应结束后,用1 mol/L盐酸溶液调节pH至4~4.5,于5000 r/min离心10 min,弃上清液,取沉淀,沉淀经100 mL蒸馏水水洗2次后冷冻干燥,即得乙酰化米渣蛋白。分别添加0.06、0.15、0.3、0.45、0.6、0.75、0.9 g乙酸酐,使乙酸酐与米渣蛋白配比分别在0.02、0.05、0.1、0.15、0.2、0.25、0.3 g/g,进行乙酰化反应来制备不同改性程度的米渣蛋白。
牢固树立生态文明理念,切实保护土地资源,合理利用土地资源,建设友好型草牧业经济发展生态环境。优化生态环境,科学配置资源,建设和完善草牧业生产防护体系,构筑生态安全屏障,为草地安全生产保驾护航。挖掘草地生产资源,科学规划草地建设,因地制宜,综合措施,变资源优势为经济发展优势。协调草地生产与生态建设关系,建设经济发展与环境保护机制,实现草产业经济可持续发展。
1.2.3米渣蛋白乙酰化改性程度的测定采用茚三酮比色法,参照文献[8]测定米渣蛋白的乙酰化改性程度。具体测定方法为:将米渣蛋白样品用蒸馏水配制成浓度为1%(w/v)的蛋白溶液,取1 mL于10 mL比色管中,加入0.1%的茚三酮溶液,再加入1 mL pH8.0磷酸盐缓冲液,混合后在100℃的沸水浴中加热15 min,冷却,加水至10 mL。以蒸馏水代替蛋白溶液作为空白,测定其在580 nm处的吸光度。以此方法分别测出乙酰化改性前后米渣蛋白样品的吸光度,再按下式计算米渣蛋白乙酰化改性程度。
乙酰化改性程度(%)=(未改性的米渣蛋白吸光度-改性后的米渣蛋白吸光度)/未改性的米渣蛋白吸光度×100
1.2.4米渣蛋白溶解性的测定称取100 mg米渣蛋白样品,溶于10 mL蒸馏水中,再用1 mol/L NaOH或1 mol/L HCl溶液调节pH分别至2~10,然后置于振荡器中振摇30 min,使其充分溶解,再于10000 r/min离心10 min,取上清液以牛血清白蛋白为标准采用福林-酚比色法测定蛋白质含量[9],以上清液中蛋白质含量(mg/mL)来表示米渣蛋白的溶解性。
1.2.5米渣蛋白乳化性的测定配制0.1%(w/v)的米渣蛋白溶液,用1 mol/L NaOH或1 mol/L HCl溶液调节pH分别至2~10,再参照文献[10]采用经典的比浊法,分别测定不同改性程度的米渣蛋白在pH2~10范围内的乳化活性和乳化稳定性。
1.2.6米渣蛋白巯基和二硫键含量的测定参照文献[11],分别测定不同改性程度的米渣蛋白的总游离巯基、暴露巯基和二硫键的含量。
1.2.7米渣蛋白表面疏水性的测定采用ANS荧光探针法测定不同改性程度的米渣蛋白的表面疏水性,参照文献[12],略作修改,具体操作方法如下:将不同改性程度的米渣蛋白样品用0.01 mol/L pH7.0磷酸盐缓冲液分别配制成浓度为0.3、0.6、0.9、1.2 mg/mL的蛋白溶液,取蛋白溶液4 mL,加入10 μL、8 mmol/L的ANSA,混合均匀后静置3 min。在荧光分光光度计下,设定激发波长384 nm、发射波长450 nm,狭缝宽5 nm,测定荧光强度。用荧光强度对蛋白溶液浓度作图并进行线性回归,以线性回归斜率作为表面疏水性指数。
1.3数据处理
采用SPSS 19.0对数据进行统计分析,实验结果以平均值±标准差表示。
2 结果与分析
2.1不同改性程度米渣蛋白的制备
蛋白质的酰化反应主要是蛋白分子中的亲核基团攻击酸酐羰基碳原子所诱发的一类亲核取代反应,赖氨酸的ε-氨基、脂肪族氨基酸的羟基以及巯基均可以参加乙酰化反应,其中赖氨酸的ε-氨基其亲核能力强、空间位阻小,参与乙酰化反应的活性较强[13]。在一定条件下,蛋白质的酰化改性程度与酸酐的种类和用量有关,因此可以通过调节乙酸酐与米渣蛋白的配比来制备不同改性程度的米渣蛋白,结果如图1所示。由图1可知,当乙酸酐与米渣蛋白的配比小于0.1 g/g时,米渣蛋白的乙酰化改性程度随着二者配比的增加而不断增加;当配比达到0.1 g/g时,改性程度达到63.5%;当配比继续增加达到0.2 g/g时,改性程度也继续增加达到84.4%;当配比超过0.2 g/g后,改性程度增加不明显。因此选择配比在0.02、0.05、0.1、0.2 g/g,分别制备乙酰化改性程度为26.4%、48.1%、63.5%和84.4%的米渣蛋白,研究乙酰化改性对米渣蛋白功能性质的影响。
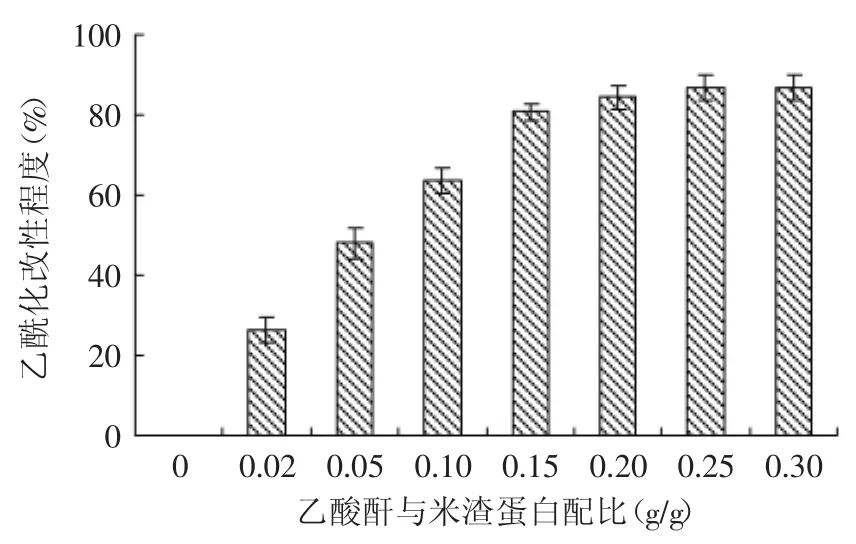
图1 不同改性程度米渣蛋白的制备Fig.1 Preparation of different acetylation extent of rice residue protein
2.2乙酰化改性对米渣蛋白巯基和二硫键含量的影响
通过测定米渣蛋白在乙酰化改性过程中总游离巯基(包括暴露在分子表面和包裹在分子内部的巯基)、暴露巯基(暴露在分子表面的巯基)和二硫键的含量变化,不仅可反映出米渣蛋白中巯基参与酰化反应的情况,还可根据暴露巯基的变化情况反映乙酰化改性对米渣蛋白分子结构的影响。如图2所示,米渣蛋白在改性前暴露巯基含量为2.98 μmol/g,随着改性程度的增加,暴露巯基含量逐渐升高,当改性程度达到84.4%时,暴露巯基含量为5.54 μmol/g,说明乙酰化改性使米渣蛋白分子伸展开来,包埋在分子内部的巯基暴露出来。改性前总游离巯基含量为6.84 μmol/g,随着改性程度的增加,总游离巯基含量逐渐下降,当改性程度达到84.4%时,总游离巯基含量为5.92 μmol/g,说明有部分巯基参与乙酰化反应或被氧化形成二硫键。改性前二硫键含量为11.5 μmol/g,随着改性程度的增加,二硫键含量逐渐增加,当改性程度达到84.4%时,二硫键含量为23.8 μmol/g,说明有部分巯基被氧化形成分子间或分子内的二硫键,使二硫键含量升高。

图2 乙酰化改性对米渣蛋白巯基和二硫键含量的影响Fig.2 Effect of acetylation on sulfhydryl and disulfide bond contents of rice residue protein
2.3乙酰化改性对米渣蛋白表面疏水性的影响
如图3所示,米渣蛋白的表面疏水性随改性程度的增加呈现先下降后增加的趋势,Gruener等[14]在研究油菜籽12S球蛋白乙酰化改性过程中理化性质的变化时发现相同趋势;Kim等[15]在乙酰化大豆蛋白中也观察到类似结果。在改性程度小于48.1%时,米渣蛋白的表面疏水性随改性程度的增加一直下降,其原因可能是在这个阶段,赖氨酸上带正电荷的ε-氨基被中性的乙酰基取代,米渣蛋白表面电荷急剧改变,极性基团出现频数增加而非极性(疏水性)基团频数下降,以及由于极性基团增多的排斥效应使表面的疏水性基团重新定向或翻转指向于内部的疏水性区域[16],表现为表面疏水性下降。当改性程度大于48.1%后,米渣蛋白的表面疏水性随改性程度的增加开始上升,在这个阶段,赖氨酸的ε-氨基乙酰基大量取代,米渣蛋白分子变性伸展开来(图2中暴露巯基的增加也证实这点),蛋白内部的疏水性基团大量暴露出来,表现为米渣蛋白表面疏水性增加。

图3 乙酰化改性对米渣蛋白表面疏水性的影响Fig.3 Effect of acetylation on surface hydrophobicity of rice residue protein
2.4乙酰化改性对米渣蛋白溶解性的影响
米渣蛋白经乙酰化改性后在pH2~10范围内的溶解性如图4所示。未改性的米渣蛋白在pH4~5溶解性最低,其原因可能是此区域处于米渣蛋白的等电点附近,蛋白质在等电点区域时其表面净电荷为零,分子间的静电排斥效应减小,分子之间易形成聚集物,表现为溶解性低,偏离等电点的区域,静电排斥效应增加,溶解性增加。改性后的米渣蛋白pH3~4溶解性最低。尹寿伟等[16]研究酰化对芸豆蛋白功能性质的影响时发现酰化处理诱导芸豆蛋白等电点区域向酸性偏移从4.5~5.0降低到3.0~4.0,与本文研究结果相似,其原因可能是带正电荷的赖氨酸ε-氨基被电中性的乙酰根取代,导致蛋白质表面负电荷增加,等电点向酸性方向偏移。在pH5~10范围内,米渣蛋白的溶解性随着乙酰化改性程度的增加出现先增加后降低的趋势。当改性程度小于63.5%时,溶解性随改性程度的增大而增加,其原因可能是电中性的乙酰根取代了带正电荷的氨基,使米渣蛋白表面的净负电荷增加,静电排斥效应增加,抑制了米渣蛋白分子间的聚集,表现为溶解性增加;当改性程度达到63.5%时,溶解性达到最大;当改性程度继续增加时,溶解性反而降低,结合图3可知,当乙酰化程度高时,米渣蛋白分子伸展开来,内部疏水性基团暴露,表面疏水性大幅增加,使溶解性降低。
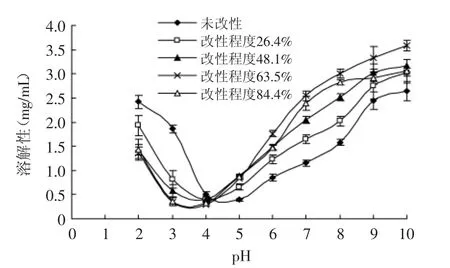
图4 乙酰化改性对米渣蛋白溶解性的影响Fig.4 Effect of acetylation on solubility of rice residue protein
2.5乙酰化改性对米渣蛋白乳化性的影响
蛋白质的乳化性可通过乳化活性和乳化稳定性两个指标来表征。研究表明,蛋白质的乳化性与其溶解性和表面疏水性密切相关,并且当蛋白质的溶解性较低时,乳化性受溶解性的影响很大,当蛋白质的溶解性较高时,乳化性则受表面疏水性的影响较大[13]。乙酰化改性对米渣蛋白乳化活性的影响如图5所示。在pH2~4时,改性后的米渣蛋白乳化活性均低于未改性的蛋白,归因于在此pH范围内改性后的蛋白溶解性低于未改性的蛋白;在pH5~10时,改性后的米渣蛋白乳化活性均高于未改性的蛋白,并且随着改性程度的增加,乳化活性也增加,其原因可能是一方面改性程度低于63.5%的蛋白溶解性比未改性的蛋白高,另一方面结合图2和图3来看,改性程度高于48.1%的米渣蛋白分子结构伸展开来,表面疏水性增加,促使乳化活性增加。
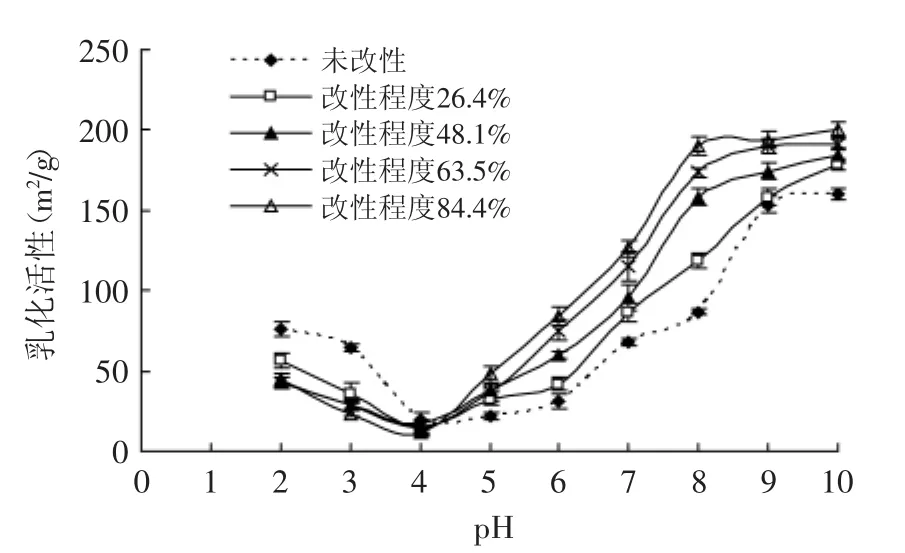
图5 乙酰化改性对米渣蛋白乳化活性的影响Fig.5 Effect of acetylation on emulsifying activity index of rice residue protein
乙酰化改性对米渣蛋白乳化稳定性的影响如图6所示,改性后米渣蛋白的乳化稳定性在所试pH范围内得到明显改善。Lawal[17]研究酰化花生蛋白的乳化性质和Mirmoghtadaie[18]研究酰化燕麦蛋白的乳化性质时都得到相似结果。归因于乙酸酐的加入使蛋白的净负电荷增加,脂肪球周围带电层形成,带电层形成后导致其在界面上与水化层相互排斥,降低了界面能量,阻碍了液滴的聚集,导致乳化稳定性增加。

图6 乙酰化改性对米渣蛋白乳化稳定性的影响Fig.6 Effect of acetylation on emulsion stability index of rice residue protein
3 结论
米渣蛋白的乙酰化改性程度随着乙酸酐与米渣蛋白配比的增加而不断增加,当酸酐蛋白比为0.2 g/g时,乙酰化改性程度可达到84.4%,之后继续增加酸酐蛋白比,改性程度增加不明显。在乙酰化改性过程中,随改性程度的增加,暴露巯基含量逐渐增加,游离巯基含量逐渐下降,二硫键含量逐渐增加,表面疏水性先下降后升高。改性后的米渣蛋白等电点向酸性方向偏移(从pH4~5偏移到pH3~4);溶解性在pH2~4下降、pH5~10明显增加;乳化活性在pH2~4时均低于未改性的蛋白,在pH5~10时均高于未改性的蛋白,并且随着改性程度的增加,乳化活性也增加;乳化稳定性在所测试的pH范围内得到明显改善。由此可见,乙酰化改性在一定条件下能改善米渣蛋白的部分功能性质,但是关于乙酰化改性对米渣蛋白的物化特性如分子量分布、净电荷和结构有什么样的影响以及结构和功能之间的关系如何,还需进一步研究。
[1]刘爱民,冯定山,张园园,等.不同预处理方式对碱法提取米渣蛋白得率的影响[J].食品科学,2014,35(10):103-106.
[2]赵殷勤,张晖,郭晓娜,等.米渣蛋白和大米蛋白的结构及性质比较[J].粮食与饲料工业,2010,9:22-24.
[3]任仙娥,杨锋,黄永春,等.基于涡流的水力空化对米渣蛋白功能性质的影响[J].食品工业科技,2014,35(14):88-90.
[4]桂向东,黄玉玲.大豆分离蛋白乙酰化功能特性研究[J].现代农业科学,2009,16(3):16-17.
[5]贾俊强,乐文俊,韩萌,等.乙酰化改性蚕蛹蛋白条件的优化[J].食品科技,2011,36(3):70-75.
[6]张红印,王兰,席玙芳,等.小麦面筋蛋白质的乙酰化改性[J].无锡轻工大学学报,2002,21(3):239-243.
[7]Yin S W,Tang C H,Wen Q B,et al.The relationships between physicochemicalpropertiesandconformationalfeaturesof succinylated and acetylated kidney bean(Phaseolus vulgaris L.)protein isolates[J].Food research international,2010,43:730-738.
[8]郑优,汪学荣,陈厚荣,等.响应面法优化纳米SiOx/鸡蛋清蛋白可食性膜的琥珀酰化改性工艺[J].食品科学,2014,35(18):32-39.
[9]张水华.食品分析[M].北京:中国轻工业出版社,2004:163-164.
[10]Wang X S,Tang C H,Li B S,et al.Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food hydrocolloids,2008,22:560-567.
[11]Yin S W,Tang C H,Wen Q B,et al.Functional properties and in vitro trypsin digestibility of red kidney bean(Phaseolus vulgaris L.)protein isolate:Effect of high-pressure treatment[J]. Food chemistry,2008,110:938-945.
[12]Tang C H,Peng J,Zhen D W,et al.Physicochemical and antioxidant properties of buckwheat(Fagopyrum esculentum Moench)protein hydrolysates[J].2009,115:672-678.
[13]范静美,魏子淏,徐航,等.琥珀酰化处理对芸豆蛋白乳化性和体外消化性的影响[J].现代食品科技,2012,28(10):1277-1280.
[14]Gruener L,Ismond M A H.Effects of acetylation and succinylation on the physicochemical properties of the canola 12S globulin[J].Food chemistry,1997,60(3):357-363.
[15]Kim K S,Rhee J S.Effects of acetylation on physicochemical properties of 11S soy protein[J].Journal of food biochemistry,1989,13:187-199.
[16]尹寿伟.芸豆蛋白的物化修饰及相关构效机理研究[D].广州:华南理工大学,2009.
[17]Lawal O S,Adebowale K O,Adebowale Y A,et al.Functional properties of native and chemically modified protein concentrates from bambarra groundnut[J].Food research international,2007,40:1003-1011.
[18]Mirmoghtadaie L,Kadivar M,Shahedi M.Effects of succinylation and deamidation on functional properties of oat protein isolate[J].Food chemistry,2009,114:127-131.
Effect of acetylated modification on the functional properties of rice residue proteins
REN Xian-e1,2,3,YANG Feng1,2,3,*,HUANG Yong-chun1,2,3,YANG De-hua1,HUANG Xue1
(1.Department of Biological and Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China;2.Guangxi Key Laboratory of Green Processing of Sugar Resources,Liuzhou 545006,China;3.Key Laboratory for Processing of Sugar Resources of Guangxi Higher Education Institutes,Liuzhou 545006,China)
Acetylation was applied to modify rice residue proteins.Sulfhydryl(SH)and disulfide bond(SS)contents,surface hydrophobicity(H0),protein solubility(PS)and emulsifying activities were evaluated.With increasing of the extent of acetylation,exposed SH content was increased,total free SH content was decreased,SS content was increased,H0was decreased first,and then increased.PS emulsifying activity index(EAI)and emulsion stability index(ESI)of rice residue proteins were improved at pH5~10 by acetylation,but PS and EAI was decreased at pH2~4.The data suggested that some functional properties of rice residue proteins could be improved by acetylation.
acetylation;rice residue protein;functional property
TS201.2
A
1002-0306(2015)20-0116-05
10.13386/j.issn1002-0306.2015.20.015
2015-01-20
任仙娥(1979-),女,硕士,高级实验师,研究方向:食品大分子结构与功能,E-mail:renxiane@126.com。
杨锋(1978-),男,博士,副教授,研究方向:食品加工技术与过程强化,E-mail:yangfeng78@126.com。

