腌制和干燥工艺对咸金线鱼中生物胺的影响
陈玉峰,吴燕燕,邓建朝,黄 卉,李来好,杨贤庆,戚 勃,周婉君(.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东广州50300;2.上海海洋大学食品学院,上海20306)
腌制和干燥工艺对咸金线鱼中生物胺的影响
陈玉峰1,2,吴燕燕1,*,邓建朝1,黄卉1,李来好1,杨贤庆1,戚勃1,周婉君1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东广州510300;2.上海海洋大学食品学院,上海201306)
为探明腌制和干燥工艺对咸鱼产品中生物胺的影响,本文以金线鱼(Nemipterus hexodon)为原料,通过柱前衍生HPLC技术分析金线鱼在不同腌制条件和不同干燥方式下,鱼体中8种生物胺及其相关指标的变化。结果表明:食盐对鱼体中生物胺生成有明显抑制作用(p<0.05),25%食盐腌制的金线鱼总胺量为(50.82±7.18)mg/kg,分别比食盐添加量为0%、8%和15%的总胺量降低了89.7%、45.9%和40.1%;生物胺及其相关指标的含量均随腌制温度的升高、腌制时间的延长而明显增加,0℃腌制时的总胺量为(76.72±0.69)mg/kg比15℃和25℃的总胺量分别降低9.5%、26.1%,15℃腌制时,腌制第4 d比第1 d总胺量增加58.9%;组胺是金线鱼腌制过程最优势的生物胺;干燥方式显著影响咸金线鱼生物胺含量变化,其中日晒方式产品的总胺量为(430.13±3.48)mg/kg,与真空干燥(60℃,-0.1~0.09 MPa)(404.61±9.23)mg/kg相近,30℃冷风干燥较热风干燥有利于抑制咸鱼生物胺的产生,总胺量、生物胺指数(BAI)和质量指数(QI)均最低,最能保证产品的品质和安全性。
咸金线鱼,生物胺,腌制,干燥
生物胺是一类具有生物活性含氮的低分子量有机化合物的总称,按其化学结构可分为脂肪胺、杂环胺和芳香胺,按其组成成分又可分为单胺、二胺和多胺[1]。少量的生物胺是人体内重要的氮源之一,也是体内荷尔蒙、RNA、DNA的合成前体[2];自身合成的生物胺可调节细胞生长,可作为炎症介质等[2],对维持人体正常的生理活动十分重要。然而摄入过量生物胺对人体则会产生巨大的危害,常见的生物胺中毒症状有恶心、腹部痉挛、高血压、红疹等[3-5]。
金线鱼(Nemipterus hexodon)又称红三鱼、瓜三鱼等,为广东、广西、海南等南海省份重要经济鱼类[6],也是南方加工咸鱼的主要品种。随着人们生活水平和食品安全意识的提高,咸鱼目前成为一种“鸡肋”食品:一方面是诱人的风味,另一方面是含有亚硝基盐、生物胺等有害物质。近几年在传统咸鱼方面已经开展了不少研究:李来好等[7]研究了咸鱼中特征挥发性风味成分,张婷等[8]研究了不同贮藏条件咸鱼的品质变化,吴燕燕等[9-10]研究了从咸鱼中分离到具有降解亚硝酸盐的乳酸菌并建立了一种咸鱼加工过程有效降低亚硝酸盐的方法。杨华等[11-13]分析不同加工工艺条件对腌制水产品风味和品质的影响,任中阳等[14]研究了咸鱼在不同干燥温度下动力学参数。但对于工艺条件对传统咸鱼产品中的生物胺等有害物质的影响仍是一个空白。本文以金线鱼为原料,探讨在不同腌制工艺和干燥工艺条件下,鱼肉中生物胺的变化,为探明咸鱼在腌制过程中生物胺的形成机理和控制提供参考依据。
1 材料与方法
1.1材料与仪器
冰鲜金线鱼以眼睛明亮不塌陷,肉质弹性好为标准,购自广州华润万家客村店,体重(180±20)g,体长(25±3)cm,金线鱼于冰藏迅速送回实验室,去鳞、去内脏,用清水清洗鱼体表面以及内部血污,放置一段时间以沥干鱼体表面水分,备用;食盐由台山市李贵记食品有限公司提供;丙酮、三氯乙酸(TCA)、氢氧化钠、碳酸氢钠、25%氨水、乙酸铵国产分析纯;丹磺酰氯(Dns-Cl,≥99%) 美国Sigma公司;乙腈(色谱纯)和甲醇(色谱纯) 上海安谱科学仪器有限公司;生物胺标准品美国Sigma公司;实验用水均为超纯水。
Agilent 1100高效液相色谱仪配有G1311A四元泵、G1313A自动进样器、G1316 A柱温箱、G1315B荧光检测器、G1322A真空脱气机和HP化学工作站,美国Agilent公司;Avanti J-26 XP冷冻离心机美国BECKMAN COULTER公司;GB204电子天平瑞士Mettler公司;均质机德国IKA公司;Milli.Q Biocel超纯水机美国Millipore公司;数显恒温水浴锅常州澳华仪器有限公司;pH试纸广州市基科仪有限公司;DS-1高速组织捣碎机上海精科实业有限公司;LD-Y400A高速万能粉粹机上海顶帅电器有限公司;809 Titrando自动电位滴定仪瑞士Metrohm公司;HG 53水分测定仪瑞士METTLER TOLEDO公司。
1.2实验方法
1.2.1咸金线鱼加工工艺流程冰鲜金线鱼→前处理→食盐腌制→浸泡脱盐→沥水→干燥→咸干鱼
1.2.2腌制工艺对咸金线鱼生物胺的影响
1.2.2.1食盐添加量的影响参考南方传统咸金线鱼加工方法,将冰鲜金线鱼去除内脏和鱼鳞,清洗干净后,分成四组,分别按0%、8%、15%、25%添加食盐,进行腌制,腌制环境温度控制在(15±1)℃,腌制时间为4 d,每天定时取样,测定生物胺的含量,连续测定4 d。
1.2.2.2腌制温度的影响将添加15%食盐的金线鱼置于0、15、25℃下进行腌制,每天定时取样,测定生物胺的含量,连续测定4 d。
1.2.2.3腌制时间的影响将添加15%食盐的金线鱼置于15℃下进行腌制,每天定时取样,测定生物胺的含量,连续测定4 d。
1.2.3干燥工艺对咸金线鱼生物胺的影响添加15%食盐、15℃温度下腌制好的咸金线鱼,浸泡脱盐后,分别采用日晒、冷风干燥、热风干燥、真空干燥进行干燥,以鱼体水分含量达到约30%(水分测定仪测定)为干燥终点,测定咸干鱼中含盐量8%~9%范围内(电位滴定仪测定),咸鱼无异臭味、无酸败、肌肉纤维清晰。其中,日晒时间为56 h。冷风干燥条件分别为:10℃、150 h;20℃、72 h;30℃、35 h。热风干燥条件分别为:40℃、25 h;50℃、17 h;60℃、13 h。真空干燥条件分别设置为:50℃、-0.1~0.09 MPa、12 h;60℃、-0.1~0.09 MPa、9 h。分别测定干燥制得的咸金线鱼产品中8种生物胺含量及其相关指标。
1.2.4生物胺测定生物胺采用柱前衍生反相高效液相色谱法测定,按照陈玉峰等[15]方法略作修改:取鱼肉中间部位进行组织捣碎或粉粹均匀,准确称量5.00 g样品于离心管中,加入15 mL 5%TCA溶液,均质并于10000 r/min离心10 min,取上清液,再加入8 mL TCA溶液重复一次,合并两次上清液并定容至25 mL。取1 mL样液,加入200 μL 2 mol/L NaOH、300 μL饱和碳酸氢以及2 mL丹磺酰氯溶液,于40℃避光衍生反应45 min,加入100 μL 25%氨水避光保存30 min以终止反应,然后用乙腈定容至5 mL于3000 r/min离心5 min,上清液过0.22 μm滤膜,贮藏于4℃,备用。检测条件:柱温为40℃,进样量为10 μL,流速为1 mL/min,荧光激发波长为350 nm,发射波长为520 nm,流动相为0.1 mol/L乙酸铵溶液、乙腈和超纯水,洗脱梯度见表1。采用外标法测定各生物胺的含量,计算总胺量、单胺、二胺、多胺、生物胺指数、质量指数,公式如下。

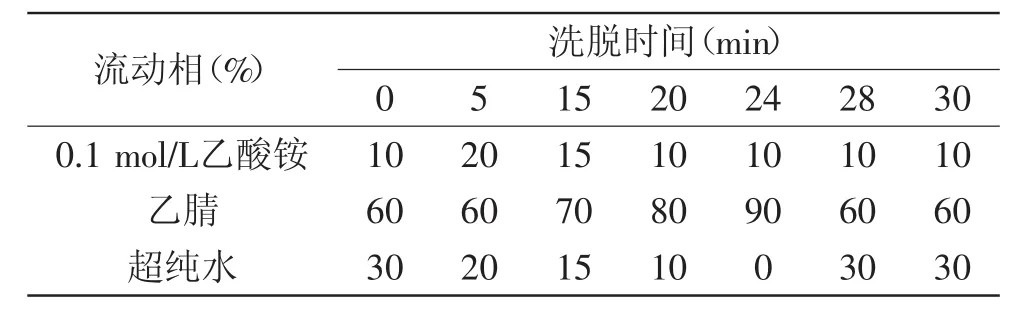
表1 梯度洗脱程序Table 1 HPLC gradient elution program for biogenic amines
1.3数据分析
采用Excel和SPSS 19.0.0进行数据统计。所有样品均作三次平行,测定结果以均值±标准差表示,实验数据采用ANOVA进行Tukey HSD显著性差异分析,p<0.05表示显著。
2 结果与讨论
2.1不同食盐添加量对金线鱼生物胺及其相关指标的影响
不同食盐添加量对金线鱼中8种生物胺的影响见表2。鲜鱼中组胺为主要胺类物质并远低于国家标准300 mg/kg,其他7种生物胺均处于较低的含量(均低于2.5 mg/kg)。除第1 d组胺外,食盐的添加对金线鱼中生物胺有显著影响(p<0.05),腌制过程中,添加8%、15%、25%食盐的金线鱼与未添加食盐金线鱼比较,体内的生物胺生成得到明显的抑制。对于未添加食盐的金线鱼而言,在15℃贮藏过程中,体内8种生物胺的含量明显上升,生物胺中腐胺、尸胺、组胺和酪胺分别从0.76 mg/kg上升到84.34 mg/kg,0.77 mg/kg上升到209.44 mg/kg,19.03 mg/kg上升到137.07 mg/kg和2.13 mg/kg上升到27.35 mg/kg,上升速率明显高于添加食盐的金线鱼。食盐添加8%、15%、25%的金线鱼,在4 d腌制过程中,色胺、2-苯乙胺、腐胺、尸胺、酪胺、亚精胺、精胺无显著性差异(p>0.05),含量均较低、较接近,说明食盐的添加抑制了产胺菌的生长以及各种氨基酸脱羧酶的活性;在腌制同一阶段,组胺随着食盐质量分数越大含量降低,这可能由于随着食盐质量分数的增大,渗透压也随着增加,加快了渗透过程,使食盐内渗量随着增加[16],进而导致鱼体内产组胺菌脱水明显,降低了其生物活性。李平兰等[17]也指出NaCl可破坏位于细菌细胞膜上的氨基酸脱羧酶来降低食品中生物胺的积累。

表2 不同食盐添加量对金线鱼中8种生物胺的影响Table 2 Effect of different salt addition on eight biogenic amines of threadfin bream
图1显示了不同食盐添加量以及冰鲜的金线鱼在4 d腌制过程中8种生物胺各自的贡献率及其变化情况。对于未添加食盐的金线鱼,腐胺、尸胺、组胺在放置过程中为主要胺类,LEITAO等[18]指出高含量的腐胺和尸胺与较差卫生条件有关,也是食物腐败的重要的指标,腐胺和尸胺在贮藏过程中的贡献率逐渐上升而组胺的贡献率则逐渐下降,可以看出未添加食盐的金线鱼的品质在贮藏过程中在逐渐下降。添加8%食盐的金线鱼中,组胺为主要胺类,其次是尸胺,添加15%食盐的金线鱼中,组胺所占的比例最大,而添加25%食盐的金线鱼中,组胺为最主要的胺类,其次是尸胺和酪胺。
表3显示了不同食盐添加量对金线鱼中生物胺相关指标的影响,可以看出,鲜鱼中总胺量、二胺、BAI和QI等主要腐败品质指标均处于较低的水平,腌制第1 d后,不同食盐添加量下鱼体内总胺量、BAI和QI较鲜鱼有明显的增加。腌制的同一天,未添加食盐的金线鱼中总胺量、单胺、二胺、多胺以及BAI均显著高于添加食盐的金线鱼(p<0.05)。对于添加食盐的金线鱼而言,添加25%的食盐的金线鱼,其总胺量、单胺以及BAI的含量在第2 d和第4 d显著低于添加8%和15%食盐的金线鱼(p<0.05)。腌制结束后,添加25%食盐的金线鱼,其总胺量为(50.82±7.18)mg/kg,分别比添加量为0、8%、15%降低了89.7%、45.9%、40.1%。BAI和QI被用于评价鱼种在不同贮藏条件下鱼肉腐败进程的指标,但由于鱼种、贮藏方式等不同,至今没有一致的评价范围[19-20]。对于BAI而言,其变化受组胺、尸胺、腐胺以及酪胺变化的影响,对添加食盐的金线鱼,腐胺、尸胺以及酪胺的含量较低,BAI主要受组胺的影响,而对未添加食盐的金线鱼,在腌制前2 d主要受组胺的影响,而在腌制后2 d主要受组胺、尸胺以及腐胺的影响。

图1 不同食盐添加量下金线鱼中各生物胺占总胺量的百分比Fig.1 Contribution of individual biogenic amines to total levels in threadfin bream at different salt addition
对于添加食盐的金线鱼,由于亚精胺和精胺对鱼体的品质影响不大,因此,QI仍可较好的评价鱼体在腌制过程中的品质。由表3可以看出,腌制第1 d,不同食盐添加量的金线鱼中QI无显著性差异(p>0.05),但随着腌制时间的增长,在后3 d的腌制过程中,添加25%食盐的金线鱼QI显著低于8%以及15%食盐添加量的金线鱼(p<0.05),获得了较好的鱼肉品质。另外,Mieltz等[21]建议QI=10是金枪鱼的可生食接受限值,对于本实验添加25%食盐腌制的金线鱼而言,QI值与其结论较为接近,从一定程度上也可以说明25%食盐可获得较好的鱼肉品质。
Krízek等[22]研究鲤鱼中生物胺,指出二胺可作为评价腐败进程指标,得出与感官可接受等级的二胺限值:<20 mg/kg,好;20~45 mg/kg,可接受;>45 mg/kg,差。由表3可知,对于添加食盐的金线鱼而言均处于较好的感官等级,而对于未添加食盐的金线鱼而言,在放置第2 d开始,感官等级为差,开始出现腐败现象。ZHANG等[23]研究了不同食盐浓度对鲤鱼品质的影响,得出了食盐添加可以抑制尸胺和腐胺的生成,高浓度的食盐相对于低浓度食盐可以提高鲤鱼的货架期,对于这一结论,本实验的结果与其相符合。
2.2不同腌制温度对金线鱼生物胺及其相关指标的影响
由表4可知,腌制温度对8种生物胺有不同程度的影响,精胺、亚精胺、色胺以及2-苯乙胺在腌制过程中,含量均较低,腌制温度对它们的影响不大。而对于酪胺,腌制前2 d,腌制温度对其影响较小,腌制后2 d,腌制温度增高,其含量趋于增大。在腌制的4 d过程中,腌制温度对主要胺类,腐胺、尸胺以及组胺有显著的影响(p<0.05),随着腌制温度的升高,在同一天各自的含量均发生明显的增大。章银良[16]指出随着腌制温度的升高,渗透入鱼肌肉内的食盐含量也会随之增加。可以推断鱼体内产生物胺的菌类因食盐浓度增大发生脱水等现象造成活性降低进而使得生物胺的含量下降,然而本研究的结果却与之相反,因此可以表明,腌制温度上升导致产生物胺菌活性增强的因素要大于前者。王翔等[24]也指出温度的升高一方面可以促进微生物的生长和蛋白质的分解,另一方面也会提高蛋白水解酶和氨基酸脱羧酶的活性,加速生物胺的合成,但生物胺的形成和环境温度之间并不是简单的正相关或者负相关,是一个极其复杂的关系,比如含盐量的不同、温度的不同以及腌制过程中大量的非蛋白氮流入腌制液中都会改变腌制液的pH等理化性质。因此,仍需进行后续的实验去探明生物胺与温度的关系。
图2显示了不同腌制温度以及冰鲜的金线鱼在4 d腌制过程中8种生物胺各自的贡献率及其变化情况。可以看出,0℃和15℃下腌制过程中,组胺为最主要的胺类物质,25℃下,除了组胺,尸胺也是主要胺类物质,可以看出在25℃下腌制,咸鱼的品质比在0℃和15℃下腌制的差。而CHONG等[25]对印度的一种马鲛鱼的研究表明,当鱼处于冰藏时,组胺、尸胺、腐胺、酪胺含量处于很低的水平,当鱼放在25~29℃常温下贮藏时,他们的含量会急剧上升,这与本研究结果吻合。由此可见,温度对生物胺形成影响很大,低温腌制可获得较好的鱼肉品质。

图2 不同腌制温度下金线鱼中各生物胺占总胺量的百分比Fig.2 Contribution of individual biogenic amines to total levels in threadfin bream at different pickling temperature

表3 不同食盐添加量对金线鱼中生物胺相关指标的影响Table 3 Effect of different salt addition on relevant biogenic amine indices of threadfin bream
由表5可知,生物胺及其相关指标的含量均随腌制温度的升高而明显增加,表5显示了0℃腌制4 d时的总胺量为(76.72±0.69)mg/kg分别比15℃和25℃降低9.5%、26.1%。除了多胺、单胺以外,25℃腌制温度下,总胺量、二胺、BAI以及QI的含量均明显高于0℃以及15℃腌制温度下(p<0.05)。二胺(腐胺+尸胺)可以作为鱼体腐败程度的评判依据,是重要的品质指标。25℃下腌制4 d时二胺的含量为(14.46±0.27)mg/kg,分别比0℃以及15℃高79.4%、74.4%。因此,低温腌制可以一定程度保证鱼体的质量。BAKAR等[20]指出澳洲肺鱼中BAI和QI值随着贮藏温度升高而升高,本实验研究也得出了同样的结果,金线鱼中BAI和QI值随着腌制温度的升高,在同一天均发生了升高。
2.3腌制时间对金线鱼生物胺及其相关指标的影响
由图3可见,总胺量、单胺、组胺随着腌制时间的增长含量逐渐增大(p<0.05)且变化趋势相似,腌制第4 d比第1 d总胺量、单胺、组胺分别增加58.9%、60.0%、59.2%;尸胺、酪胺随着腌制时间的增长略有上升,而2-苯乙胺、亚精胺和精胺随着腌制时间的增长基本无变化。由此可见组胺为腌制过程中的优势生物胺。二胺和多胺在腌制过程中基本无变化。由图3可以看出,BAI和QI的变化趋势与总胺量、单胺的变化趋势相似,在某些生物胺的影响下,曲线出现轻微波动,但不影响总体趋势。
2.4干燥工艺对咸金线鱼生物胺及其相关指标的影响
由表6~表7可知,与干燥前相比,干燥后色胺和精胺的变化不明显,但其他生物胺不管用哪种方式干燥均发生明显变化。干燥方式明显影响咸金线鱼生物胺含量变化,其中日晒方式产品的总胺量为(430.13±3.48)mg/kg,日晒条件下,尸胺、腐胺、2-苯乙胺、亚精胺含量均明显升高,其中尸胺和组胺是最主要的胺类物质,占了总生物胺含量的97.75%,这可能由于咸鱼在日晒过程始终处于露天环境中,适宜的温度以及大气条件使得产生物胺菌生长活跃。冷风干燥条件下,10℃下尸胺的含量(360.80±2.39)mg/kg明显高于20℃[(9.90±0.14)mg/kg]和30℃[(20.51± 0.07)mg/kg](p<0.05),可以看出在10℃由于干制时间的增长使主要胺类尸胺的含量增加,20℃干燥的产品中组胺的含量要明显高于其他两个温度(p<0.05),而30℃干燥的产品中8种生物胺均处于较低的含量,其中未检测出色胺。热风干燥条件下,40℃干燥的产品中未检出色胺,组胺的含量明显低于50℃和60℃干燥的产品(p<0.05),但尸胺的含量为61.86 mg/kg,明显高于其他两组,且比冷风30℃干燥产品高。真空干燥条件下,50℃干燥的产品中组胺的含量要明显高于60℃(p<0.05),且单胺含量较高,而60℃真空干燥产品中尸胺的含量要明显高于50℃,同时总胺量或者二胺含量也明显高于50℃,可以看出产生物胺菌在缺氧条件下仍可生存。

图3 不同腌制时间对金线鱼中生物胺及其相关指标的影响Fig.3 Effect of pickling time on biogenic amines and relevant indices of threadfin bream

表4 不同腌制温度对金线鱼中8种生物胺的影响Table 4 Effect of different pickling temperature on eight biogenic amines of threadfin bream
对于不同种类干燥方式下,2-苯乙胺、酪胺、精胺、尸胺、腐胺在60℃真空干燥的含量明显高于其他干燥方式(p<0.05);除冷风干燥20℃外,50℃热风干燥的产品中组胺含量明显高于其他干燥方式(p<0.05),可以看出咸鱼不适合用较高温度进行干制,在干制前期鱼肉温度不断升高是生物胺急剧积累的过程。尸胺在所有干燥方式下均处于较高的含量,为咸金线鱼中主要的胺类物质,该结果与ZHAI[26]和KORAL[27]关于腌干鱼制品中生物胺的研究结果一致,尸胺较干燥前均显著增加(p<0.05),且在60℃真空干燥、日晒和10℃冷风干燥的含量均超过350 mg/kg,其次是40℃热风干燥,含量达到61.86 mg/kg。组胺为腌干金线鱼制品中另一个主要胺类物质,这与ZHAI等[26]研究报道的不符,该实验中组胺的含量除在20℃冷风干燥、日晒、50℃和60℃热风干燥下,均发生了显著的下降(p<0.05),且在60℃真空干燥下达到最低。

表5 不同贮藏温度对金线鱼中生物胺相关指标的影响Table 5 Effect of different pickling temperature on relevant biogenic amine indices of threadfin bream

表6 不同干燥条件对咸金线鱼中8种生物胺的影响Table 6 Effect of different drying condition on eight biogenic amines of salted threadfin bream

表7 不同干燥条件对咸金线鱼中生物胺相关指标的影响Table 7 Effect of different drying condition on relevant biogenic amine indices of salted threadfin bream
在日晒下,总胺量、BAI均达到最大值,其次是在60℃真空干燥条件下(见表7);二胺在60℃真空干燥下达到最大,在10℃和日晒下也均超过了350 mg/kg;QI在60℃真空干燥下达到最大,其次是10℃和日晒下,与二胺相同。单胺除了日晒、20℃冷风干燥、50℃和60℃热风干燥外,均发生了明显的降低(p<0.05);不同干燥条件下,多胺均较干燥前略有上升但仍处于较低水平。此外,HWANG等[28]也研究了不同食盐浓度以及不同干制条件下虱目鱼中生物胺的变化,结果同样显示了干制条件的不同显著的影响鱼体中生物胺的形成。
综上所述,同一类型干燥条件干燥温度的不同以及干燥类型的不同都显著影响着咸金线鱼中主要生物胺及其相关生物胺指标。冷风干燥较热风干燥有利于抑制咸鱼生物胺的产生,30℃冷风干燥条件下,产品的总胺量、二胺、BAI和QI均最低,最能保证产品的品质和安全性。
3 结论
3.1金线鱼在用食盐腌制过程,食盐对金线鱼体内主要生物胺及生物胺相关指标有明显抑制作用,组胺含量随着食盐质量分数的增大而降低。
3.2腌制温度对色胺、2-苯乙胺、亚精胺和精胺含量影响不大,但腐胺、尸胺、组胺及生物胺相关指标与腌制温度成正相关,随腌制温度的升高而上升,因此,在较低温度下腌制有助于抑制鱼体中生物胺的产生,保证产品的品质。
3.3咸鱼腌制过程,组胺为腌制过程中的优势生物胺,其与总胺量、单胺、BAI和QI随腌制时间的延长而升高,变化趋势相似。
3.4传统日晒干燥的咸鱼产品中,产品的总生物胺量、单胺、二胺含量均是最高的,特别是组胺、尸胺含量最高。而其他干燥方式下,干燥温度对咸金线鱼中主要生物胺及相关指标的影响最大,其中,以30℃冷风干燥的咸鱼产品中生物胺含量最低,最能保证产品的品质和安全性。
[1]张月美,包玉龙,罗永康,等.草鱼冷藏过程鱼肉品质与生物胺的变化及热处理对生物胺的影响[J].南方水产科学,2013,9(4):56-61.
[2]吴燕燕,陈玉峰.腌制水产品中生物胺的形成及控制技术研究进展[J].食品工业科技,2014,35(14):396-400.
[3]蔡秋杏,李来好,陈胜军,等.液熏罗非鱼片在25℃贮藏过程中生物胺的变化[J].南方水产,2010,6(5):1-6.
[4]BECKER K,SOUTHWICK K,REARDON J,et al.Histamine Poisoning Associated with Eating Tuna Burgers[J].Journal of the American Medical Association,2001,285(10):1327-1330.
[5]RICE S L,Eitenmiller R R,Koehler P E.Biologically Active AminesinFoods:AReview[J].JournalofMilkandFoodTechnology,1979,39(5):353-358.
[6]陈清朝.南沙群岛至华南沿岸的鱼类(一)[M].北京:科学出版社,1997:94-95.
[7]李来好,丁丽丽,吴燕燕,等.咸鱼中的挥发性风味成分[J].水产学报,2012,36(6):979-988.
[8]张婷,吴燕燕,李来好,等.不同贮藏条件下咸鱼品质的变化规律[J].食品工业科技,2012,33(23):330-334.
[9]WU Y Y,LIU F J,LI L H,et al.Isolation and Identification of Nitrite-degrading Lactic Acid Bacteria from Salted Fish[J]. Advanced Materials Research,2012(393-395):828-834.
[10]WU Y Y,YOU G,LI L H,et al.Effects of inoculating compound lactic acid bacteria on the quality of cured fish[J]. Applied Mechanics and Materials,2014(685):486-489.
[11]杨华,张李玲,梅清清.不同腌制工艺处理对美国红鱼品质的影响[J].食品科学,2013,34(11):126-129.
[12]吴燕燕,游刚,李来好,等.低盐乳酸菌法与传统法腌干鱼制品的风味比较[J].水产学报,2014,38(4):601-612.
[13]张娜,熊善柏,赵思明.工艺条件对腌腊鱼安全性品质的影响[J].华中农业大学学报,2010,29(6):783-787.
[14]REN Z Y,WU Y Y,LI L H,et al.Experimental study and modeling of moisture sorption isotherms of salted largehead hairtail(Trichiurus lepturus)at 25 and 35℃[J].Advanced Materials Research,2014(1033-1034):681-689.
[15]陈玉峰,吴燕燕,李来好,等.腌干鱼制品中8种生物胺测定方法的优化[J].中国渔业质量与标准,2014,4(4):41-48.
[16]章银良.海鳗腌制加工技术的研究[D].无锡:江南大学,2007.
[17]李平兰,沈清武.干发酵香肠中生物胺的产生与控制[J].食品与发酵工业,2004(11):59-64.
[18]LEITAO M C,MARQUES A P,ROMAO M S.A Survey of BiogenicAminesinCommercialPortugueseWines[J].FoodControl,2005,16:199-204.
[19]ÖZOGUL F,ÖZOGULl Y.Biogenic Amine Content and Biogenic Amine Quality Indices of Sardines(Sardina pilchardus)Stored in Modified Atmosphere Packaging and Vacuum Packaging[J].Food Chemistry,2006,99(3):574-578.
[20]BAKAR J,YASSORALIPOUR A,BAKAR FA,et al.Biogenic Amine Changes in Barramundi(Lates calcarifer)Slices Stored at 0 and 4℃[J].Food Chemistry,2010,119(2):467-470.
[21]MIELTZ J L,KARMAS E.Chemical quality index of canned tuna as determined by high-pressure liquid chromatography[J]. Journal of Food Science,1977,42:155-158.
[22]Krízek M,Vách A F,VorlováL,et al.Biogenic amines in vacuum-packed and non-vacuum-packed flesh of carp(Cyprinus carpio)stored at different temperatures[J].Food Chemistry,2004,88(2):185-191.
[23]ZHANG Y M,QIN N,LUO Y K,et al.Effects of Different Concentrations of Salt and Sugar on Biogenic Amines and Quality Changes of Carp(Cyprinus carpio)during Chilled Storage[J].Journal of the Science of Food and Agriculture,2015,95(6):1157-1162.
[24]王翔,卢士玲,徐幸莲,等.发酵肉制品中生物胺的形成及影响因素研究进展[J].食品与发酵工业,2010,36(11):133-136.
[25]CHONG C Y,FATIMAH A B,RUSSLY A R,et al.Biogenic Amines,Amino Acids and Microflora Changes in Indian Mackerel(Rastrellinger kanagurta)Stored at Ambient(25~29℃)and Ice Temperature(0℃)[J].Journal of Food Science and Technology,2014,51(6):1118-1125.
[26]ZHAI H L,YANG X Q,LI L H,et al.Biogenic Amines in Commercial Fish and Fish Products Sold in Southern China[J]. Food Control,2012,25(1):303-308.
[27]KORAL S,TUFAN B,SCAVNICARA,et al.Investigation of the Contents of Biogenic Amines and Some Food Safety Parametersof Various Commercially Salted Fish Products[J].Food Control,2013,32(2):597-606.
[28]HWANG C C,LIN C M,KUNG H F,et al.Effect of Salt Concentrations and Drying Methods on the Quality and Formation of Histamine in Dried Milkfish(Chanos chanos)[J].Food Chemistry,2012,135(2):839-844.

图4 冷鲜羊肉嫩度PLSR模型预测结果Fig.4 Prediction result of chilled mutton tenderness by PLSR
3 结论
采用近红外高光谱成像技术结合偏最小二乘回归法对原始光谱、预处理光谱和特征区域光谱建立冷鲜羊肉嫩度的定量预测模型,通过对比不同方法预处理后的建模效果及全波段与特征区域光谱的建模结果得出,经Savitzky-Golay卷积平滑预处理后的特征区域光谱(波长范围963~1678 nm)所建模型校正和预测集模型的相关系数分别为0.881和0.773,均方根误差分别为和0.806和1.060,交互预测均方根误差为1.023,模型预测精度较高,预测性能良好,可有效预测冷鲜羊肉的嫩度值,实现快速无损检测羊肉冷藏过程中嫩度指标的目的。
参考文献
[1]王文秀,彭彦昆.基于近红外光谱的冷鲜肉-解冻肉的判别研究[J].食品安全质量检测学报,2014,5(3):754-760.
[2]卢智,朱俊玲,马俪珍.冷却肉的加工现状和发展趋势[J].肉类工业,2004(3):8-11.
[3]Shackelfo rd S D,Wheeler T L,Meade M K,et al.Consumer imp ressions of tender select beef[J].Anim Sci,2001,79:2605-2614.
[4]Tao F,Peng Y,Lu Y,et al.Simultaneous determination of tenderness and Escherichia coli contamination of pork using hyperspectral scattering technique[J].Meat Science,2012,90:851-857.
[5]陈士进,彭增起,李景军,等.光谱技术预测牛肉嫩度研究进展[J].食品科学,2013,34(1):333-339.
[6]Gowen A A,O’donnell C P,Cullen P J,et al.Hyperspectral imaging—an emerging process analytical tool for food quality and safety control[J].Trends in Food Science&Technology,2007,18:590-598.
[7]张玉华,孟一.肉类品质无损检测技术研究现状与发展趋势[J].食品工业科技,2012,33(12):392-395.
[8]周全,朱大洲,王成,等.成像光谱技术在农产品/食品检测中的研究进展[J].食品科学,2010,31(23):423-427.
[9]刘魁武,成芳,林宏建,等.可见/近红外光谱检测冷鲜猪肉中的脂肪、蛋白质和水分含量[J].光谱学与光谱分析,2009,29(1):102-105.
[10]张雷蕾,彭彦昆,刘媛媛,等.冷却肉微生物污染和肉色变化的Vis/NIR光谱无损检测[J].农业机械学报,2013,44:159-164.
[11]陶斐斐,王伟,李永玉,等.冷却猪肉表面菌落总数的快速无损检测方法研究[J].光谱学与光谱分析,2010,30(12):3405-3409.
[12]Leroy B,Lambotte S,Dotreppe O.Prediction of technological and organoleptic properties of beef Longissimus thoracis from near-infrared reflectance and transmission spectra[J].Meat Science,2004,66(1):45-54.
[13]褚小立.化学计量学方法与分子光谱分析技术[M].北京:化学工业出版社,2011:47.
[14]Polder G,Gerie WAM,Van Der Heijden.Calibration and CharacterizationofImagingSpectrographs[J].Near-Infrared Spectroscopy,2003,11:193-210.
[15]李丹,何建国,刘贵珊,等.基于高光谱成像技术的小黄瓜水分无损检测[J].红外与激光工程,2014,43(7):2393-2397.
Effect of picking and drying process on biogenic amines formation in salted threadfin bream(Nemipterus hexodon)
CHEN Yu-feng1,2,WU Yan-yan1,*,DENG Jian-chao1,HUANG Hui1,LI Lai-hao1,YANG Xian-qing1,QI Bo1,ZHOU Wan-jun1
(1.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Lab of Aquatic Product Processing of Ministry of Agriculture,Guangzhou 510300,China;2.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
To determine the effect of pickling and drying process conditions on biogenic amines in salted threadfin bream(Nemipterus hexodon),the changes in eight biogenic amines and relevant biogenic amine indices were studied at different pickling and drying conditions by HPLC.The results showed that biogenic amines were significantly inhibited by salt(p<0.05).Biogenic amine value((50.82±7.18)mg/kg)in fish with 25%salt addition compared to 0%,8%and 15%salt addition was brought down 89.7%,45.9%and 40.1%,respectively.The contents of biogenic amines and relevant biogenic amine indices were increased significantly as pickling temperature rose or pickling time extended,after the pickling at 0℃,compared to 15℃ and 25℃,total biogenic amine value((76.72±0.69)mg/kg)were brought down 9.5%and 26.1%,respectively.Total biogenic
salted threadfin bream(Nemipterus hexodon);biogenic amines;pickling;drying
TS254.1
A
1002-0306(2015)20-0083-09
10.13386/j.issn1002-0306.2015.20.009
2015-01-20
陈玉峰(1989-),男,硕士研究生,研究方向:水产品质量与安全,E-mail:wuyycyf@163.com。
吴燕燕(1969-),女,博士,研究员,研究方向:水产品质量与安全,E-mail:wuyygd@163.com。
国家自然科学基金项目(31371800);国家科技支撑项目(2012BAD28B05);广东省海洋渔业科技推广专项(A201301C01)。
amine value at fourth pickling day was added 58.9%relative to first pickling day when fish was pickled at 15℃.Histamine was the most preponderant biogenic amine during pickling process.Drying methods significantly influenced the salty threadfin bream biogenic amines content change.The content of total biogenic amine under sun drying((430.13±3.48)mg/kg)was close to vacuum drying 60℃((404.61±9.23)mg/kg),the contents of total biogenic amine,BAI and QI were lowest at cold drying 30℃ which was beneficial to restrain biogenic amines in salt fish compared to hot drying and could guarantee product quality and security.

