内蒙古马铃薯主栽品种试管薯诱导因子研究
李树生,郝文胜*,韩志刚
(1.内蒙古自治区马铃薯繁育中心,内蒙古呼和浩特010031;2.内蒙古自治区农牧业科学院,内蒙古呼和浩特010031)
内蒙古马铃薯主栽品种试管薯诱导因子研究
李树生1,郝文胜1*,韩志刚2
(1.内蒙古自治区马铃薯繁育中心,内蒙古呼和浩特010031;2.内蒙古自治区农牧业科学院,内蒙古呼和浩特010031)
[目的]探讨各诱导因子对内蒙古马铃薯主栽品种试管薯的影响。[方法]设置不同水平,探讨4种外源植物生长物质多效唑、矮壮素、α-萘乙酸和6-苄基腺嘌呤对马铃薯主栽品种试管薯的影响。[结果]马铃薯品种费乌瑞它适宜结薯的外源植物生长物质浓度分别为:α-萘乙酸1 mg/L、多效唑1 mg/L、矮壮素6 mg/L、BA 10 mg/L。马铃薯品种克新1号适宜结薯的外源植物生长物质浓度分别为:α-萘乙酸3 mg/L、多效唑0.1 mg/L、矮壮素4 mg/L、BA 8 mg/L。[结论]在有外源植物生长物质添加的情况下,马铃薯品种费乌瑞它及克新1号均会表现促进结薯。
马铃薯;主栽品种;试管薯;诱导因子
马铃薯试管薯(microtuber)是通过组织培养的方法在培养容器中培养小苗,通过诱导于叶腋内所形成的小薯,其直径在2~10 mm[1]。作为一种特殊的种质形式和繁育材料,试管薯具有如下特点:生产不受季节限制。只要有简单的无菌设备和培养条件,可周年在器内(试管或三角瓶等容器)生产[2];无病毒和其他病原(真菌、细菌)再侵染的危险[2-3]。这是由于生产过程中是无菌操作,昆虫传毒、接触传毒和真菌传毒均可被避免。试管薯体积小、重量轻,便于种质资源的保存和交流[3];较常规的大田繁殖方法大大缩短脱毒种薯的生产周期,提高繁殖速度和繁殖系数[3];及时诱导试管薯可解决脱毒苗多次继代繁殖易导致生长衰退或重现病毒的问题[4]。正是由于具有上述特点,试管薯具有广泛的用途:用于种质资源保存和交流[2];在马铃薯基因工程研究中作为基因转移的受体材料;离体条件下诱导马铃薯块茎的形成也是研究马铃薯块茎形成机理较为理想的方法[5];作为一个体系在块茎生理(如休眠机制、碳水化合物的代谢调节等)研究中应用[6];还可以用来进行抗性育种的快速鉴定工作[6];替代脱毒试管苗,用于生产迷你薯(minituber,国标中级别为“原原种”)。
20世纪70年代中期,开始有了用组织培养方法诱导试管薯的报道[7]。1982年,世界上首次报道批量生产试管薯。我国关于试管薯最早的研究开始于1988年[3],其后自20世纪90年代初开始,陆续有人参与该领域的研究[5,7-13]。从文献发表的情况来看,关于试管薯的研究自21世纪初以来进入兴盛期,近年从事该方面研究的单位仍然不少。针对内蒙古的2个主栽品种费乌瑞它和克新1号(2011年马铃薯产业技术体系统计,内蒙古地区克新1号57.33万hm2,费乌瑞它6.67万hm2),该研究针对马铃薯试管薯各诱导因子(包括外源植物生长物质、培养容器、培养温度、培养光照、培养基中的碳源等)进行了全面研究,并形成一套完善的试管薯生产技术体系。
1 材料与方法
1.1材料
内蒙古马铃薯主栽品种克新1号和费乌瑞它脱毒试管苗。
1.2方法
1.2.1试验设计。4种外源植物生长物质[多效唑(设计3个水平,即0.01、0.10、1.00 mg/L)、矮壮素(设计2、4、6、8、10 mg/L 5个水平)、α-萘乙酸(设计1、2、3、4、5 mg/L 5个水平)和6-苄基腺嘌呤(6水平:2、4、6、8、10、12 mg/L)。培养容器(三角瓶、广口瓶和组培专用瓶)。培养温度(15~27℃,每3℃为1个梯度)。培养光照(0~24 h/d,每4 h为1个梯度)。碳源(食用白糖和蔗糖,设梯度为60、80、100、120 g/L)。
1.2.2试验的具体措施及调查指标。首先以健壮无污染的马铃薯试管苗接种到MS固体培养基上,每瓶接种20个单节切段,常规培养(温度为25℃,光照16 h/d,光强2 000~3 000 lx)15 d,按各外源植物生长物质的设计浓度添加到不同容器内(20 mL),培养容器、培养温度、碳源加入20 mL MS液体培养液,在全黑暗(光照时间处理除外)的培养情况下进行培养,40 d后收获试管薯,调查试管薯的结薯数、重量和小薯直径。
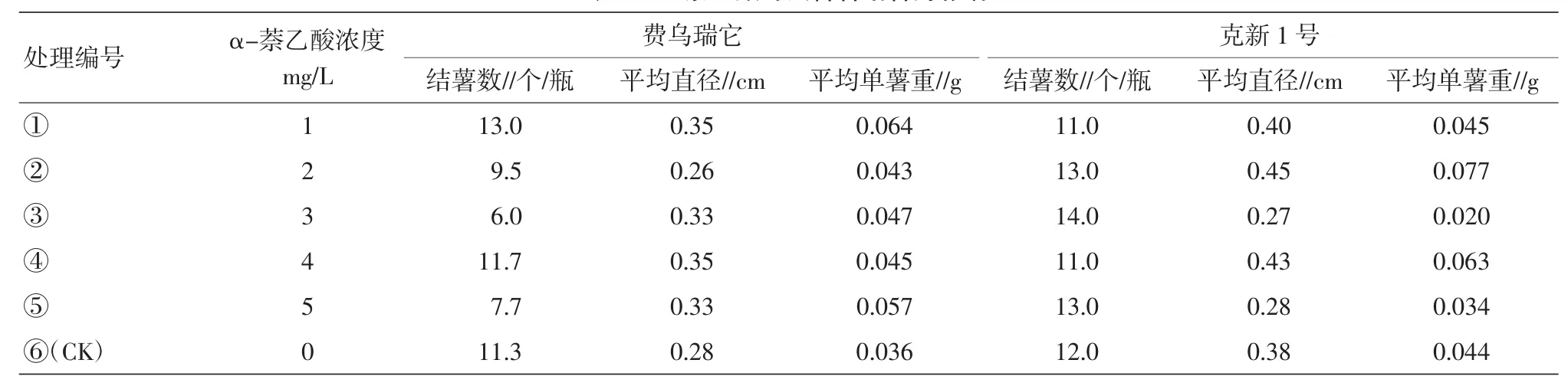
表1 α-萘乙酸对试管薯结薯的影响
2 结果与分析
2.1外源植物生长物质对试管薯结薯的影响
2.1.1α-萘乙酸对试管薯结薯的影响。品种费乌瑞它中,处理①(1 mg/L)结薯数、薯块直径、单薯重均为最高,随着处理浓度的增加,调查的3项指标有下降的趋势;品种克新1号中,处理②(2 mg/L)和处理③(3 mg/L)表现最好,说明早熟品种在较低浓度下对结薯就有较好的促进作用,而晚熟品种则需在一定的浓度下才表现出较好效果。总之,该激素随着浓度增加,会表现出对结薯的抑制作用(表1)。
2.1.2多效唑对试管薯结薯的影响。在费乌瑞它品种中,处理③(1 mg/L)在结薯数、块茎直径、单薯重均为最高,分别为14.3个、0.43 cm、0.089 g,超出对照26.5%、53.5%、144.4%。在克新1号品种中,处理②(0.1 mg/L)在结薯数的指标上优于对照。试验中,处理③(1 mg/L)茎秆粗壮,节间极短,说明该处理对试管苗的生长有极强的抑制作用,对试管薯的生长有促进作用(表2)。
2.1.3矮壮素对试管薯结薯的影响。费乌瑞它品种中,处理③(6 mg/L)结薯数最多,各处理薯块直径变化不大,随着处理浓度的增加,单薯重有上升的趋势。克新1号品种中,处理②(4 mg/L)结薯数、块茎直径、单薯重均排名第1,同时呈现出低浓度和高浓度在这3项调查指标中有下降趋势,中等浓度表现好的现象(表3)。
2.1.46-苄基腺嘌呤对试管薯结薯的影响。费乌瑞它品种中,处理⑤(10 mg/L)结薯数最多,随着处理浓度的增加,单薯重有上升的趋势,说明高浓度下,有利于块茎的干物质积累。克新1号品种中,处理④(8 mg/L)结薯多,块茎大,薯块重,分别较对照增加16.7%、26.3%、63.6%(表4)。2.2培养容器对试管薯结薯的影响
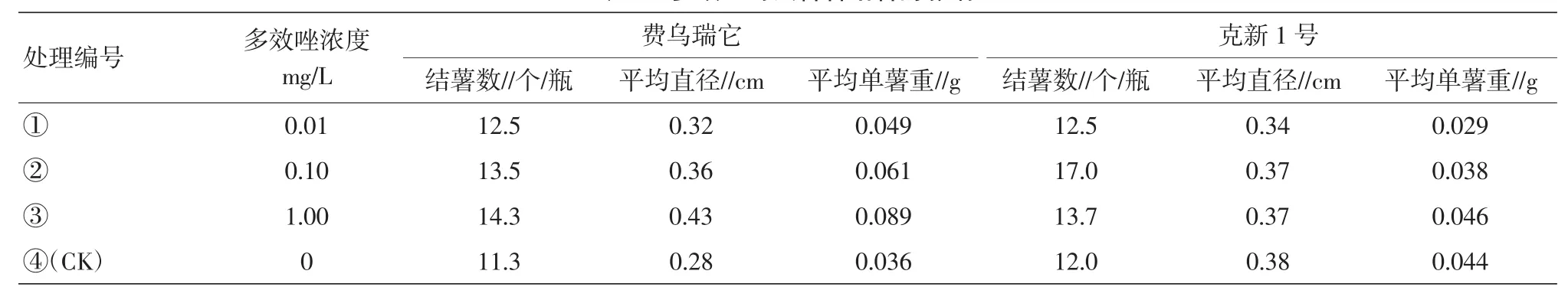
表2 多效唑对试管薯结薯的影响
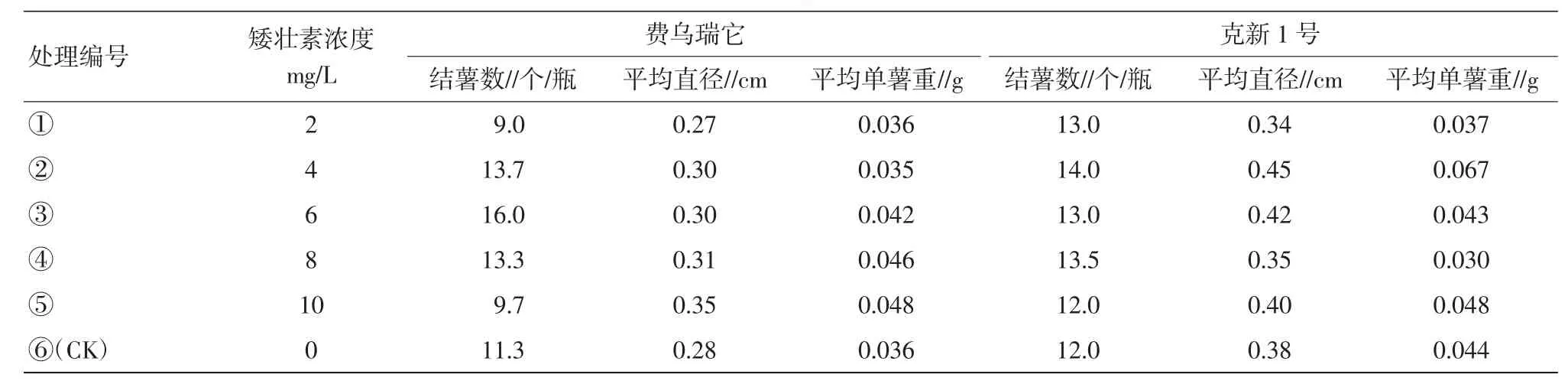
表3 矮壮素对试管薯结薯的影响
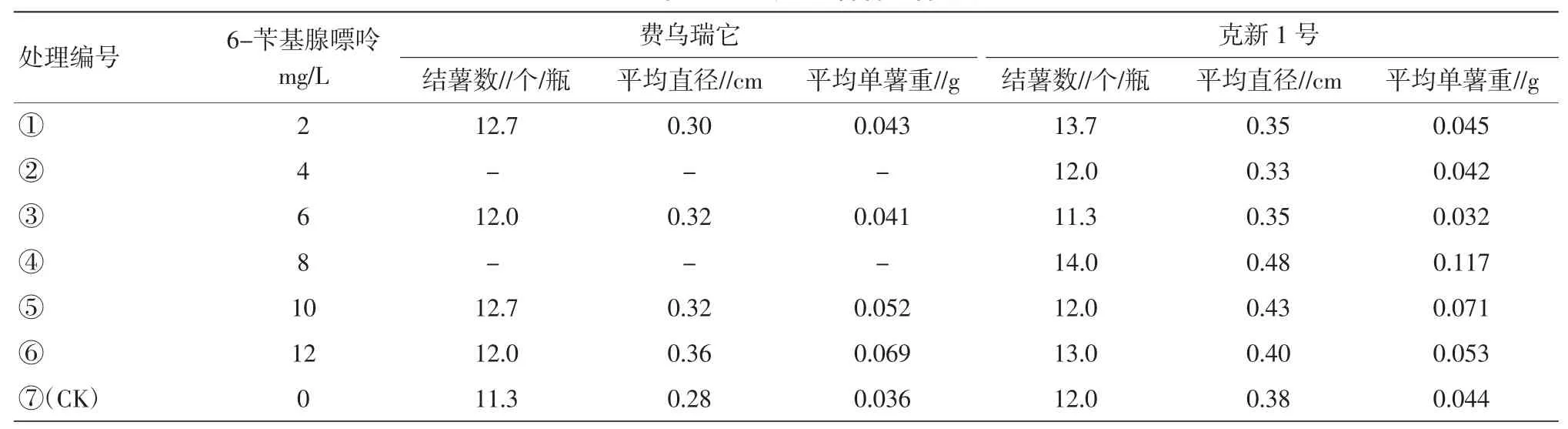
表4 6-苄基腺嘌呤对试管薯结薯的影响
试验的2个品种使用组培专用瓶在结薯数的指标中明显超出三角瓶和广口瓶,超出1倍左右。而三角瓶和广口瓶由于结薯数较少,薯块大而且重(表5)。2.3培养温度对试管薯结薯的影响
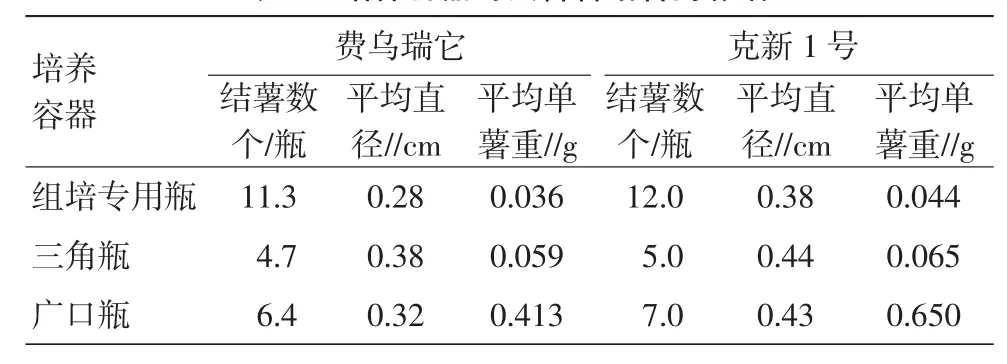
表5 培养容器对试管薯结薯的影响
参加试验的2个品种在21~24℃时,结薯数最多。随着温度从15~27℃的变化中,结薯数由少变多再变少(一般情况,超过28℃,试管苗停止生长)。在低温度的条件下,薯块重量有所增加,说明低温有利于干物质的积累(表6)。
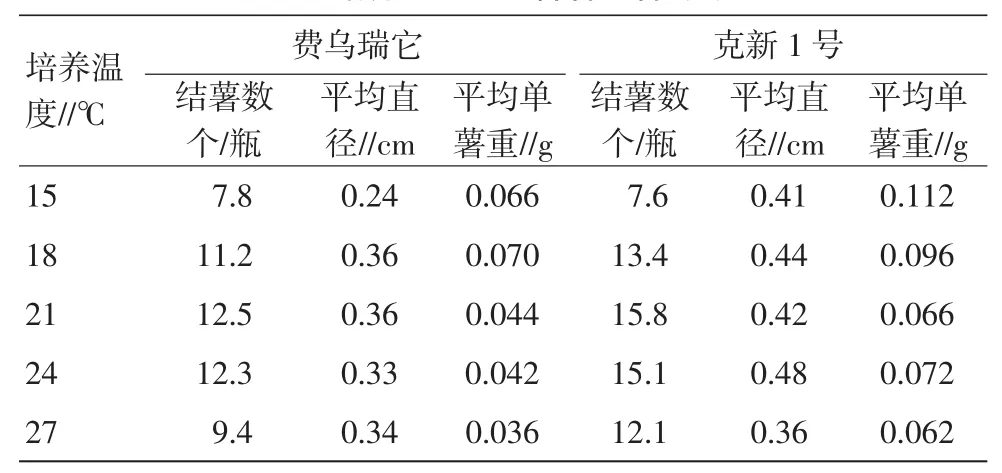
表6 培养温度对试管薯结薯的影响
2.4光照时间(光周期)对试管薯结薯的影响
0 h(全黑暗)光照处理,在2个参试品种上的结薯数均表现最好,随着光照时间的延长,结薯数、块茎直径、单薯重均出现下降的趋势。试验中发现0 h处理,由于没有光照,试管苗出现黄化现象;全光照或接近全光照(20~24 h)处理,结薯时间延长,且薯块小而轻(表7)。
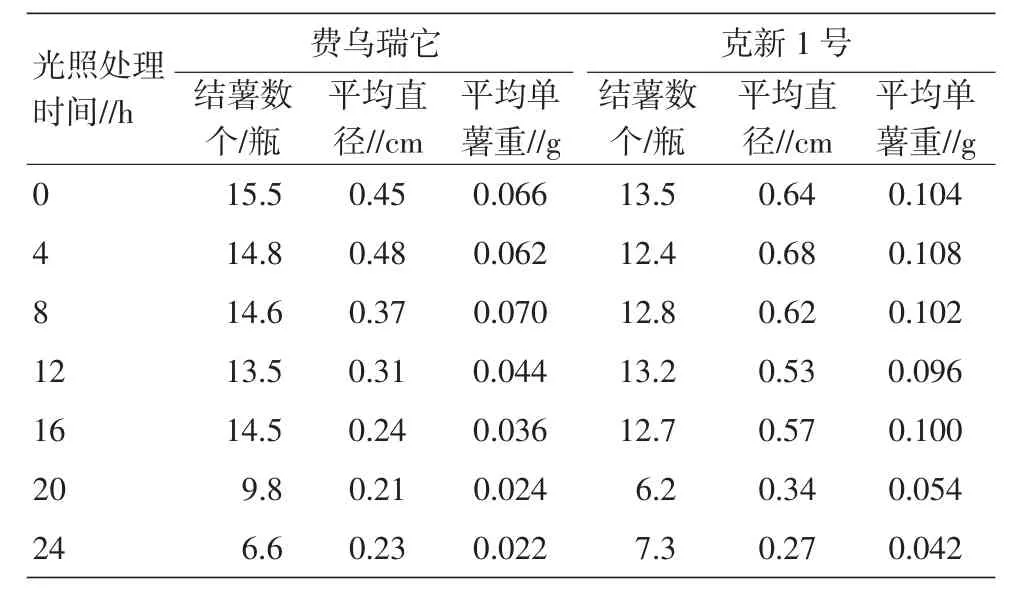
表7 光照时间(光周期)对试管薯结薯的影响
2.5碳源对试管薯结薯的影响
食用白糖和蔗糖在参试的2个品种各个处理中没有明显差别。随着碳源浓度的由低到高,结薯数、块茎直径、单薯重均出现由低到高再降低的抛物线变化,以80~100 g/L为最佳浓度。这说明适当的高浓度的碳源,可以诱导试管薯的形成(表8)。
3 结论与讨论
(1)费乌瑞它适宜结薯的外源植物生长物质浓度分别为:α-萘乙酸1 mg/L、多效唑1 mg/L、矮壮素6 mg/L、BA 10 mg/L。克新1号适宜结薯的外源植物生长物质浓度分别为:α-萘乙酸3 mg/L、多效唑0.1 mg/L、矮壮素4 mg/L、BA 8 mg/L。在有外源植物生长物质添加的情况下,2个品种均会表现促进结薯。所需浓度的不同是因为试管苗自身也会合成激素,自身合成的数量不同,对外加的激素要求也会不同。
(2)在培养容器、培养温度、培养光照、碳源2个品种需要的条件一致。选用组培专用瓶,适宜温度21~24℃,全黑暗的条件下培养,利于结薯。由于食用白糖与蔗糖没有显著区别,在生产中可以用食用白糖替代蔗糖,适宜浓度为80~100 g/L。在生产中,为了避免黄化或白化苗子出现,诱导试管薯时,在一天的光周期中可增加4~8 h的光照。
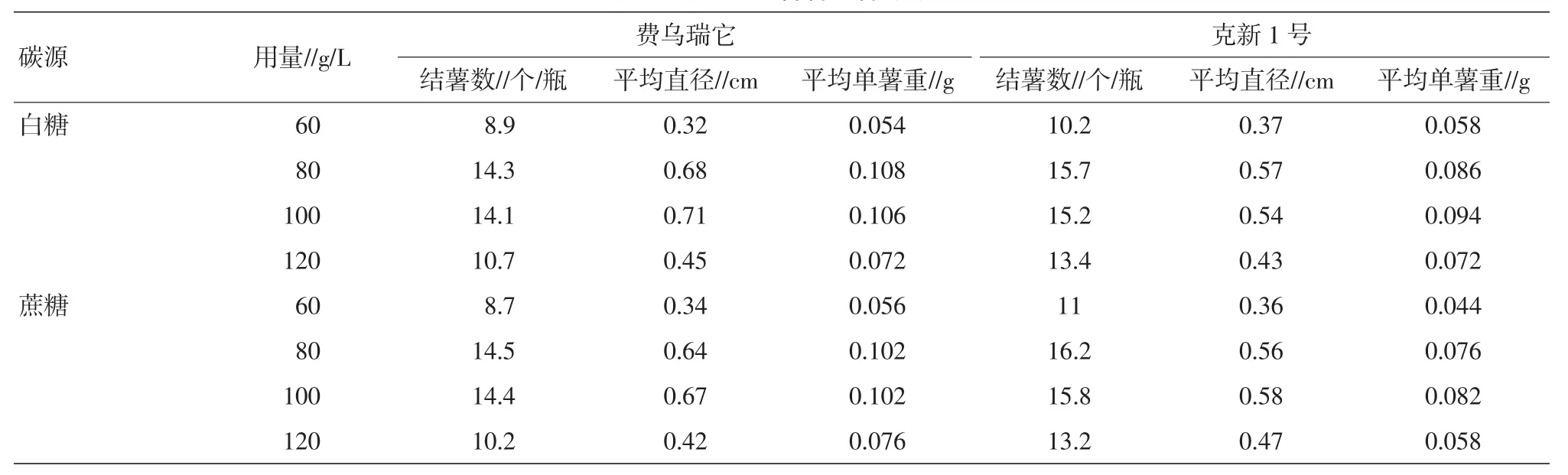
表8 碳源对试管薯结薯的影响
[1]VANDER ZAAG D E.Recent trends in development,production and utilization of potato crop in the world[J].APA Proceedings,12-19.
[2]孙慧生.马铃薯育种学[M].北京:中国农业出版社,2003:371.
[3]何静波,段金玉,万勇,等.马铃薯试管诱导结薯方法的改进[J].云南植物研究,1988,10(4):396-402.
[4]孙慧生,杨元军.中国马铃薯种薯生产[C]//陈伊里,屈冬玉.中国马铃薯研究与产业开发.哈尔滨:哈尔滨工业大学出版社,2003:1-9.
[5]李灿辉,王军,管朝旭,等.离体培养条件下植物生长物质对马铃薯块茎形成的影响[J]马铃薯杂志,1998,12(2):67-74.
[6]李娟,张国裕,程智慧.马铃薯微型薯在块茎生理及育种研究中的应用[J].西北农业学报,2003,12(3):69-72.
[7]杨文玉.不同组织培养条件对马铃薯试管微型薯的诱导[J].马铃薯杂志,1996,10(1):20-22.
[8]张颙,陈廷芳.马铃薯试管薯诱导因子最佳组配的研究[J].马铃薯杂志,1990,4(4):206-209,253.
[9]胡云海,蒋光明.氮源对马铃薯微型薯的影响[J].马铃薯杂志,1991,5(4):199-203,238.
[10]陈善娜,李聪,王军.不同浓度香豆素诱导无病毒马铃薯试管薯的氨基酸分析[J].氨基酸杂志,1991(1):37-38.
[11]胡云海,蒋光明.植物激素对微型薯形成的影响[J].马铃薯杂志,1992,6(1):14-22.
[12]孙慧生,张振洪,石卓文,等.马铃薯试管薯的诱导与利用研究[J].山东农业科学,1993(2):10-12.
[13]石瑛,秦昕,王凤义.马铃薯主要早熟品种微型薯诱导与光周期的关系[C]//陈伊里.中国马铃薯研究进展.哈尔滨:哈尔滨工业大学出版社,1999:143-147.
(责任编辑张杨林)
Study on Inducing Factors for Microtuber of Main Potato Varieties in the Inner Mongolia
LI Shu-shenget al.(Potato Breeding Center of the Inner Mongolia Autonomous Region,Hohhot,Inner Mongolia 010031)
[Objective]The aim was to explore the effects of inducing factors on microtuber of main potato varieties in the Inner Mongolia.[Method]The effects of different inducing factors on microtuber of main potato varieties in the Inner Mongolia were studied,by setting different levels.[Result]The results showed that the exogenous plant growth substance concentrations for appropriate junction potato of variety Feiwuruita were as follows:Alpha naphthyl acetic acid 1 mg/L,Multi-effect azole 1 mg/L,CCC 6 mg/L,BA10mg/L;and the exogenous plant growth substance concentrations for appropriate junction potato of variety Kexin 1 were as follows:Alpha naphthyl acetic acid 3 mg/L,Multi-effect azole 0.1 mg/L,CCC 4 mg/L,BA 8mg/L.[Conclusion]Potato chips of potato varieties Feiwuruita and Kexin 1 would all be promoted,under the condition of adding exogenous plant growth substances.
Potato;Main variety;Microtuber;Inducing factors
S532
A
2095-0896(2015)12-053-04
内蒙古自然科学基金项目(2011MS0301)。
李树生(1973-),男,内蒙古牙克石人,助理研究员,从事马铃薯育种与繁育技术研究。*通讯作者,副研究员,博士,从事马铃薯育种与生物技术研究。
2015-12-12

