KNO3-Ca(NO3)2二元体系相图及热稳定性研究
陈静,曾德文,李东东,王军涛,韩海军,郭立江
(1.中国科学院青海盐湖研究所,青海西宁810008;2.中国科学院大学;中南大学化学化工学院)
KNO3-Ca(NO3)2二元体系相图及热稳定性研究
陈静1,2,曾德文1,3,李东东1,2,王军涛3,韩海军1,郭立江1
(1.中国科学院青海盐湖研究所,青海西宁810008;2.中国科学院大学;中南大学化学化工学院)
针对KNO3-Ca(NO3)2二元体系的相图和热稳定性做了研究。借助DSC对不同组成比的KNO3和Ca(NO3)2混合盐样品做了相转变温度测定,利用XRD表征分析了体系中存在的固相。根据实验结果获得了KNO3-Ca(NO3)2二元体系的相图。研究发现,在KNO3-Ca(NO3)2二元体系中存在2种复盐,即4KNO3·Ca(NO3)2和KNO3·Ca(NO3)2,且该二元体系的最低共熔点为4KNO3·Ca(NO3)2与KNO3·Ca(NO3)2形成的共晶点,共晶温度为154℃,Ca(NO3)2的物质的量分数为31%。通过热稳定性研究发现,任意比例的样品都能在500℃下稳定存在。
硝酸熔盐;DSC;相图;热稳定性
热发电是太阳能高效利用的重要途径之一。太阳能热发电的关键技术之一是拥有工作温度范围宽、热容量大、成本低、腐蚀性小、黏度低等特性的储热材料。热发电技术中太阳能储热的形式为显热储热,即通过材料的升降温进行储放热。如果材料的比热容和保持液态状态稳定存在的温度范围越大,则储存的热量就越多。因此,要求储热介质材料凝固点较低、热分解温度较高。目前,已经商业化应用的硝酸熔盐主要有Solar Salt(60%NaNO3+40%KNO3,质量分数,下同)[1]、Hitec(53%KNO3+40%NaNO2+7% NaNO3)[2]和Hitec XL[15%NaNO3+43%KNO3+42% Ca(NO3)2][3-6]等,这3种混合熔盐的熔点分别为222、142、120℃,其中Hitec XL的熔点最低。然而,多篇文献[3-6]中报道的NaNO3-KNO3-Ca(NO3)2三元体系共晶点的组成和温度并不一致,甚至相差很大。KNO3-Ca(NO3)2二元体系的准确相图对于理解NaNO3-KNO3-Ca(NO3)2三元体系有重要作用,但针对其液相线的温度和复盐组成的研究仍有较大的分歧[5-8]。
为确定KNO3-Ca(NO3)2二元体系共晶点温度和组成,笔者利用DSC(差示扫描量热法)对不同组成比的KNO3和Ca(NO3)2混合熔盐样品进行测试,分析了DSC曲线中的吸热峰并绘制KNO3-Ca(NO3)2二元体系的相图。由于缺少KNO3和Ca(NO3)2形成的复盐的晶体数据,因此需通过对比分析不同组成比样品的XRD谱图,从而确定该二元体系中复盐的存在形式。最后,通过加热前后样品的质量损失率判断样品分解程度确定样品的热稳定性。
1 实验部分
1.1原料与仪器
原料:KNO3为在150℃下干燥12 h的分析纯KNO3试剂(上海国药集团)。Ca(NO3)2由分析纯Ca(NO3)2·4H3O试剂(上海国药集团)制备得到。制备过程:1)将Ca(NO3)2·4H3O在真空干燥箱中130℃下干燥,直至样品变为白色块状固体;2)将得到的白色块状固体放置于马弗炉中在300℃下干燥24 h[3,9]。分析干燥后样品的成分可知,Ca2+的质量分数为24.25%(理论值为24.42%),CaO的质量分数为0.15%。
仪器:硝酸熔盐样品的DSC曲线采用STA449F3型同步热分析仪测定,装样坩埚材质为Al2O3,升温速率为5℃/min,测试温度为30~500℃。XRD曲线用PANalytical X′Pert Pro型X射线衍射仪测定。利用CPA225D型电子分析天平称量样品质量。
1.2实验步骤
准确称取无水Ca(NO3)2和KNO3按一定比例配制混合硝酸盐样品于坩埚中,将样品置于烘箱中150℃下干燥12 h;将干燥后的样品放入马弗炉中从400℃逐渐升温至500℃(温度最高不超过500℃)直至样品全部熔融,加热2 h并不断搅拌;随炉缓慢冷却至100℃,机械研磨后将样品移至烘箱中,130℃下干燥24 h后测试。
2 结果与讨论
2.1KNO3-Ca(NO3)2二元体系相图
为验证实验方法的准确性,首先测定了纯KNO3和纯Ca(NO3)2的TG、DSC曲线,结果见图1。

图1 KNO3(a)与Ca(NO3)2(b)的TG-DSC曲线
在研究过程中,固-固转变温度取DSC升温曲线中吸热峰的起始温度,固-液转化温度(即固相消失温度)取DSC吸热峰的峰值温度。由图1a可见,KNO3的DSC曲线中包含2个吸热峰:132.2℃处的吸热峰与文献[10]报道的KNO3正交晶型向六方晶型转变的温度132℃一致,相变焓为4.79 kJ/mol;334.8℃处的吸热峰与文献[10]报道的KNO3的熔点334.6℃一致,熔融焓为10.01 kJ/mol。利用切线法分析TG曲线,KNO3起始分解温度为650℃。由图1b可知,Ca(NO3)2的DSC曲线中只有1个吸热峰,峰值温度为572.9℃,高于文献[6]计算得到的Ca(NO3)2熔点561℃,峰面积为195.6 kJ/mol。利用切线法分析Ca(NO3)2的TG曲线可知,Ca(NO3)2的分解温度为545℃,低于前人计算得到的熔点561℃,且由于实验得到Ca(NO3)2的DSC曲线中仅有1个温度范围较宽、峰面积较大的吸热峰,可推断Ca(NO3)2在加热时熔融过程与分解过程发生重叠。因此,DSC曲线中的吸热峰应包含Ca(NO3)2的熔融吸热和分解吸热两部分,由于分解时吸热较大,从而导致DSC曲线中仅出现1个吸热峰且其峰面积也较大。
实验配制不同KNO3-Ca(NO3)2组成的混合熔盐,并测定各样品(1~15)的DSC曲线,结果见图2。各样品的具体相变温度见表1。

图2 不同KNO3-Ca(NO3)2组成混合熔盐的DSC曲线
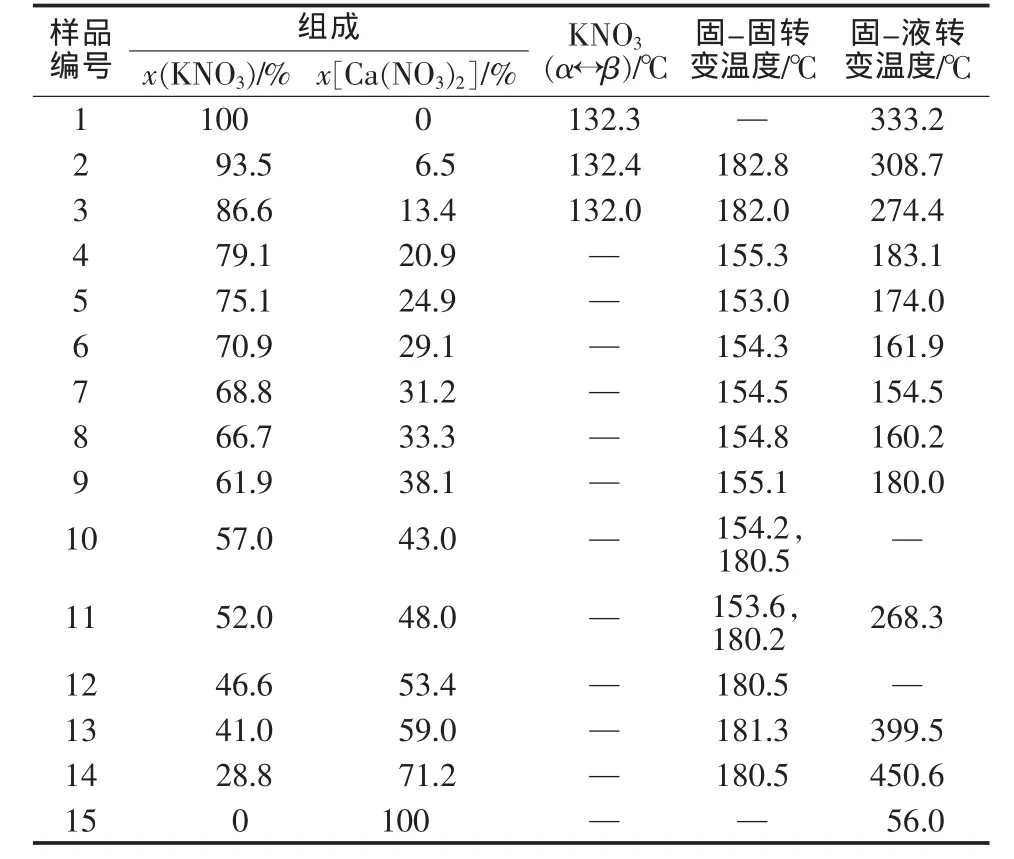
表1 DSC曲线测得的不同比例KNO3-Ca(NO3)2二元体系混合熔盐样品的相转变温度
由图2和表1可知,在升温过程中,所有样品的吸热峰可分为5组。组1:样品1~3中132℃处的吸热峰对应KNO3的晶型转变反应;组2:样品4~14中154℃处的吸热峰对应二元体系共晶反应的逆反应;组3:样品2~5中182℃处的吸热峰对应4KNO3· Ca(NO3)2的分解反应;组4:样品10~14中180℃处的吸热峰对应KNO3·Ca(NO3)2的分解反应;组5:液相线温度并不统一,各样品液相线温度见表1。由图2还可见,样品3、12、13和14在154℃处均存在吸热峰,结合相律分析这4个样品在154℃并不存在相转变,出现该吸热峰的原因可能是样品制备冷却过程中发生包晶反应导致。
分析样品DSC曲线中的吸热峰峰值(见表1)并结合相律,绘制了KNO3-Ca(NO3)2二元体系相图,结果见图3。由图3可知,该二元体系的最低共融点温度为154℃,该点是复盐4KNO3·Ca(NO3)2与KNO3·Ca(NO3)2的共晶点,其中Ca(NO3)2的物质的量分数为31%。图3中,E点所对应的温度为182℃,即复盐4KNO3·Ca(NO3)2的分解温度,该点为β型KNO3、复盐4KNO3·Ca(NO3)2和熔液的三相共存点;F点对应的温度为180℃,即复盐KNO3·Ca(NO3)2的分解温度,该点为Ca(NO3)2、复盐KNO3·Ca(NO3)2和熔液的三相共存点。
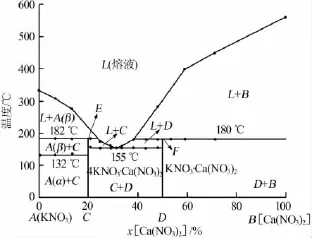
图3 实验测得的KNO3-Ca(NO3)2二元体系相图
结合图3相图与文献[8]的报道,初步判定体系中可能存在2种复盐,即4KNO3·Ca(NO3)2和KNO3· Ca(NO3)2。为鉴定这些复盐生成区域随熔盐组成而变化的关系,实验配制了不同KNO3和Ca(NO3)2物质的量比的熔盐样品,待冷却后进行XRD分析,结果见图4。由图4可见,样品b的特征峰中均不存在纯KNO3和Ca(NO3)2的特征峰,该峰值为复盐4KNO3·Ca(NO3)2的特征峰。将样品d直接降温测得的XRD谱峰中含有纯Ca(NO3)2的特征峰,通过将样品d在包晶温度(180℃)下恒温7 d得到了复盐KNO3·Ca(NO3)2的纯相。利用纯KNO3和Ca(NO3)2与复盐4KNO3·Ca(NO3)2和KNO3·Ca(NO3)2的特征峰分析样品a、c和e。样品a中,2θ=23.6、29.5、33.9、41.1、41.9、46.6°处的特征峰与纯KNO3的特征峰一致,2θ=27.4、29.9、39.4、43.2、44.7°等处的特征峰与复盐4KNO3·Ca(NO3)2的特征峰一致,可判定样品a为纯KNO3与复盐4KNO3·Ca(NO3)2的混合物。样品c中,2θ=27.4、29.9、39.4、43.2、44.7°处的特征峰与复盐4KNO3·Ca(NO3)2的特征峰一致,2θ=15.0、15.5、20.8、21.3、21.8、25.4、25.7、36.6、37.2、42.2、43.6°等处的特征峰与复盐KNO3·Ca(NO3)2的特征峰一致,可判定样品c为复盐4KNO3·Ca(NO3)2和复盐KNO3· Ca(NO3)2的混合物。样品e中,2θ=20.2、26.1、28.6、39.3、41.0°等处的特征峰与纯Ca(NO3)2的特征峰一致,2θ=15.0、15.5、20.8、21.3、21.8、25.4、25.7、36.6、37.2、42.2、43.6°等处的特征峰与复盐KNO3·Ca(NO3)2的特征峰一致,可判定样品e为复盐KNO3·Ca(NO3)2与纯Ca(NO3)2的混合物混合。通过XRD谱图对比分析并结合相图,进一步确定KNO3-Ca(NO3)2二元体系中应存在4KNO3·Ca(NO3)2和KNO3·Ca(NO3)2两种复盐。

图4 不同配比样品的XRD谱图
在测定KNO3-Ca(NO3)2二元体系相图时,文献[6]采用了步冷曲线法,但测定时是采用升温过程;文献[8]采用了目测多温法,通过肉眼直接观察样品在加热过程中的熔化测定相转变温度。笔者采用差示扫描量热法,通过分析DSC曲线得到样品的相转变温度。本实验得到的KNO3-Ca(NO3)2二元体系相图与已有文献[5-8]报道基本一致,但个别点仍存在差异。分析本实验与文献[5-8]报道的液相线数据可知,在x[Ca(NO3)2]<0.15%时本实验测定的数据与文献[5-8]报道的数据基本一致;在x[Ca(NO3)2]>0.35%时本实验数据与文献[6,8]的数据基本一致,但与文献[5,7]的数据差别较大。文献[5,7]报道的在Ca(NO3)2物质的量分数分别为35%~52%和35%~45%时的液相点温度均高于本实验和文献[6,8]报道的温度。在x[Ca(NO3)2]=15%~35%时本实验测定的液相线数据与文献[5]非常吻合,但与文献[6-7]相差较大。本实验测得体系中存在复盐4KNO3·Ca(NO3)2和KNO3·Ca(NO3)2的2个包晶点,组成分别为x[Ca(NO3)2]=25%和x[Ca(NO3)2]= 38%;文献[5]认为复盐4KNO3·Ca(NO3)2的包晶点组成为x[Ca(NO3)2]=26%;文献[6]测定的复盐4KNO3·Ca(NO3)2的包晶点组成为x[Ca(NO3)2]= 29%。文献[7]认为该体系中存在复盐4KNO3·Ca(NO3)2和KNO3·Ca(NO3)2的2个包晶点,组成分别为x[Ca(NO3)2]=34%和x[Ca(NO3)2]=41%。通过以上对比可知,本实验与文献[7]都认为KNO3-Ca(NO3)2二元体系中存在2个包晶点,但包晶点的组成有较大差异。
2.2热稳定性分析
为分析该体系不同组成的热稳定性,实验将样品放置于马弗炉中分别在450、500、550℃下恒温72 h,用电子分析天平准确称量样品加热前后的质量,并绘制质量损失率与组成的关系,结果见图5。

图5 熔盐样品分别在不同温度下恒温72 h后的质量变化率曲线
由图5可知,在450、500℃时,样品的质量损失率大部分都低于5%。然而当加热至550℃时,质量损失率明显增大,当Ca(NO3)2物质的量分数为48%时混合硝酸熔盐样品质量损失率最大,达到31.35%。由此可知,KNO3-Ca(NO3)2二元体系的混合熔盐样品在450、500℃时分解较少热稳定性较好,当温度升至550℃时,样品开始大量分解。
3 结论
实验对KNO3-Ca(NO3)2二元体系相图用DSC做了测定。明确确定了在该体系中存在不一致熔融化合物4KNO3·Ca(NO3)2和KNO3·Ca(NO3)2,并得到相关的XRD谱图。研究发现,该二元体系的最低共熔点是由复盐4KNO3·Ca(NO3)2与KNO3·Ca(NO3)2形成的共晶点,共晶温度为154℃,Ca(NO3)2的物质的量分数为31%。通过对样品的热稳定性研究表明,由KNO3和Ca(NO3)2以任意比例构成的混合物都能够在500℃下稳定存在。当温度高于550℃时,混合物会大量分解。
[1]Bradshaw R W,Carling R W.A review of the chemical and physical propertiesofmoltenalkalinitratesaltsandtheireffectsonmaterials used for solar central receivers[R].Livermore,CA:Sandia National Laboratories,1987.
[2]JanzGJ,TruongGN.MeltingandpremeltingpropertiesoftheKNO3-NaNO2-NaNO3eutectic system[J].J.Chem.Eng.Data,1983,28:201-202.
[3]Gomez J,Calvet N,Starace A K,et al.Ca(NO3)2-NaNO3-KNO3molten salt mixtures for direct thermal energy storage systems in parabolic trough plants[J].Journal of Solar Energy Engineering,2013,135(2):122-129.
[4]Bradshaw R W,Meeker D E.High-temperature stability of ternary nitrate molten salts for solar thermal energy systems[J].Solar Energy Materials,1990,21(1):51-60.
[5]Jänecke V E.The quaternary system of the nitrates of Na-K-Ca-Mg and the systems of its components[J].Z.für Elektrochemie und Angewandte Physikalische Chemie,1942,48:453-512.
[6]Protsenko P I,Bergman A G.Ternary system of fused nitrates of calcium,potassium,andsodium[J].Russ.J.Gen.Chem.,1950,20:1365-1375.
[7]Menzies A W C,Dutt N N.The liquidus surface of the ternary system composed of the nitrates of potassium,sodium and calcium[J].J. Am.Chem.Soc.,1911,33(8):1366-1375.
[8]IIyasov I I,Dunaeva T I.Ternary system of potassium,cesium,and calcium nitrates[J].Russ.J.Inorg.Chem.,1977,22(1):265-267.
[9]Shomate C H.High-temperature heat contents of Mg(NO3)2,Ca(NO3)2and Ba(NO3)2[J].J.Am.Chem.Soc.,1944,66:928-929.
[10]BenešO,KoningsRJM,WurzerS,etal.ADSCstudyoftheNaNO3-KNO3system using an innovative encapsulation technique[J]. Thermochim.Acta,2010,509(1/2):62-66.
——————
联系方式:deweng_zeng@hotmail.com
Phase diagram and thermal stability of KNO3-Ca(NO3)2binary system
Chen Jing1,2,Zeng Dewen1,3,Li Dongdong1,2,Wang Juntao3,Han Haijun1,Guo Lijiang1
(1.Qinghai Institute of Salt Lakes,Chinese Academy of Sciences,Xining 810008,China;2.University of Chinese Academy of Sciences;3.College of Chemistry and Chemical Engineering,Central South University)
The phase diagram and thermal stability of KNO3-Ca(NO3)2binary system were studied.DSC was used to test the phase transition temperatures of the samples mixed with different ratios of KNO3and Ca(NO3)2.The solid phase existed in the system was characterized by the XRD.Based on the test results the phase diagram of KNO3-Ca(NO3)2binary system was obtained.Researchindicated that two double salts,4KNO3-Ca(NO3)2and KNO3-Ca(NO3)2,could be found in the binarysystem. And the eutectic point temperature of 4KNO3-Ca(NO3)2and KNO3-Ca(NO3)2was 154℃which was the lowest melting temperature of binary system,with 31%in amount-of-substance fraction of Ca(NO3)2.The study of the thermal stability indicated that the molten salts samples with any mixed proportion could be stable under 500℃.
nitrate molten salt;DSC;phase diagram;thermal stability
TQ131.13
A
1006-4990(2015)11-0038-04
2015-05-18
陈静(1990—),女,硕士研究生,主要从事熔盐储能材料的研究。
曾德文

