糠秕马拉色菌皮肤感染模型的构建
曹玉萍 沈永年 吕桂霞 王 乐 曾 荣 张孟丽 李玲珺 马鹏程刘维达
·论著·
糠秕马拉色菌皮肤感染模型的构建
曹玉萍 沈永年 吕桂霞 王 乐 曾 荣 张孟丽 李玲珺 马鹏程∗刘维达∗
目的: 构建糠秕马拉色菌的体外组织工程皮肤感染模型。方法: 利用成纤维细胞及牛胶原混合液构建组织工程真皮,采用气液界面培养方法在组织工程真皮表面培养角质形成细胞和黑素细胞;糠秕马拉色菌悬液感染组织工程皮肤,在不同时间点,利用HE染色及PAS染色观察组织工程结构的改变及糠秕马拉色菌侵入深度的变化。结果: 构建的组织工程皮肤结构紧密,分化层数达8~10层。随着糠秕马拉色菌感染时间的延长,组织工程皮肤的基本结构不被该菌破坏,芽生孢子密度随着时间延长而增加,对于组织工程皮肤的侵袭仅限于表皮浅层。结论: 糠秕马拉色菌的组织工程皮肤感染模型可较好的代表糠秕马拉色菌在体感染情况,是马拉色菌相关疾病较好的体外研究工具。
糠秕马拉色菌; 组织工程
马拉色菌是皮肤真菌感染性疾病最常见的病原菌之一,作为一种角层寄生真菌,它与花斑糠疹、马拉色菌毛囊炎、头皮糠疹、脂溢性皮炎、特应性皮炎、银屑病及融合性网状乳头瘤病等疾病的发病有关。在这些疾病中,有的即使菌含量很高,仍很少发生炎症反应(如花斑糠疹),有些则有明显的炎症反应(如马拉色菌毛囊炎、脂溢性皮炎、银屑病等)。关于马拉色菌致病机制的假说很多,但均未经证实。主要是由于此种真菌体外培养不易,需要特殊含油的培养基,目前尚无理想的体外模型。1,2有学者将临床分离株与人外周血单核细胞(PBMC)共同培养研究其与宿主共存的模式;5,6此外,为了研究马拉色菌在花斑糠疹中的致病机制,将临床分离株与人角质形成细胞共培养,以及其共培养液对黑素细胞的影响,7-9这些研究范围较小,研究结论仍存在争议,且单独的细胞液下培养模型对在体皮肤的代表性仍存在一定差距,寻找理想的体外模型研究马拉色菌的致病机制成为许多科学家努力的方向。糠秕马拉色菌是临床马拉色菌相关疾病中分离率较高的菌种,为了对马拉色菌的致病过程有更深入的了解,本研究利用糠秕马拉色菌感染组织工程皮肤,拟在体外构建糠秕马拉色菌感染模型,为今后马拉色菌发病机制的研究提供一个有利的工具。
1 材料和方法
1.1细胞及菌株来源 正常人原代角质形成细胞、黑素细胞及成纤维细胞来源于5~25岁正常男性常规包皮环切术后的包皮(南京鼓楼医院泌尿外科和南京市第一医院泌尿科提供)。糠秕马拉色菌(CBS1878)由卫生部医学微生物菌(毒)种保藏管理中心真菌中心[简称CMCC(F)]提供。
1.2试剂和仪器 角质形成细胞培养基为DK-SFM(Invitrogen公司),黑素细胞培养基为 M254,加入HMGS(Invitrogen公司),成纤维细胞培养基为DMEM完全培养基(Invitrogen公司),牛I型胶原溶液(Sigma公司),糠秕马拉色菌培养基为Leeming和Notman培养基(MLNA),倒置显微镜(Olympus公司),CO2孵箱(Thermo公司),超净工作台(苏州安泰空气技术有限公司),隔水式恒温培养箱(上海精密科学仪器有限公司),Transwell 12孔板购自Corning公司。
1.3细胞培养 角质形成细胞分离与培养及成纤维细胞的分离与培养参见文献,3黑素细胞的培养参见文献4
1.4含色素的组织工程皮肤的培养 在前期研究培养方法4进行改进。将4×105mL/L成纤维细胞重悬于牛胶原混合液中,取2 mL/孔至12孔板中,放置于37℃,5%CO2下孵育至完全凝固,向其中加入1.5 mL含10%胎牛血清的DMEM培养基培养3天得组织工程真皮。向真皮表面滴加0.45 m L含4.5×104个黑素细胞和9×104个角质形成细胞的细胞悬液,置于37℃,5%CO2孵箱培养2天,第5天进行气液界面培养,第15天结束培养。
1.5糠秕马拉色菌悬液制备 取新形成的成熟糠秕马拉色菌菌落,将菌落置于盛有1 m L生理盐水的碾磨器中,充分碾磨均匀。用生理盐水将其浓度调整至1个麦氏浓度(106个孢子m L/L)。
1.6糠秕马拉色菌感染的组织工程皮肤模型的构建取5μL糠秕马拉色菌悬液滴加于Transwell小室内含色素的组织工程皮肤表面,向下室加入含10%胎牛血清的DMEM培养基及50μL的无菌橄榄油,置于35℃ 5%CO2培养;于12 h、24 h、48 h和72 h终止培养,同时设置不加菌液的平行对照组。
1.7苏木精-伊红(HE)染色 组织工程皮肤用4%甲醛固定后,经过脱水、透明、浸蜡、切片和染色,光镜下观察。
1.8过碘酸雪夫(PAS)染色 按照试剂盒步骤进行,切片按常规脱蜡水洗,1%~2%淀粉酶消化25 min后,充分洗涤,0.5%~1%过碘酸水溶液氧化5 min;水洗后Schiff氏试剂染15 min;充分洗涤后明矾苏木精染核,梯度乙醇脱水、二甲苯透明、中性树胶封固。
2 结果
2.1HE染色观察构建的含色素的组织工程皮肤形态 牛胶原和成纤维细胞形成的组织工程真皮质地均匀,可见散在呈梭形的成纤维细胞分布于胶原纤维束之间;角质形成细胞和黑素细胞在组织工程真皮表面气液界面培养10天后,可见表皮层次均匀、结构清晰,细胞分化达8~10层,见图1。
2.2糠秕马拉色菌感染的组织工程皮肤后HE染色结果 糠秕马拉色菌作用于组织工程皮肤12 h、24 h、48 h和72 h,随着感染时间延长,组织工程皮肤结构未见明显变化,表皮形态与空白对照组一致,表皮均未见明显破坏,在48 h和72 h时,表皮上表面可见大量马拉色菌繁殖(图2)。
2.3糠秕马拉色菌感染的组织工程皮肤后PAS染色结果 糠秕马拉色菌作用12 h后,表皮层上方可见少许芽生孢子,偶见个别芽生孢子黏附于表皮的上表面(图3a箭头所示);感染24 h后,芽生孢子数量增加,常见群集芽生孢子黏附聚集于表皮层表面,但孢子并未侵入表皮层内(图3b);感染48 h后,芽生孢子由粘附转为侵入表皮层上部(图3c);感染72 h后,芽生孢子仍主要分布于表皮层浅层,侵入深度较前有所加大(图3d)。
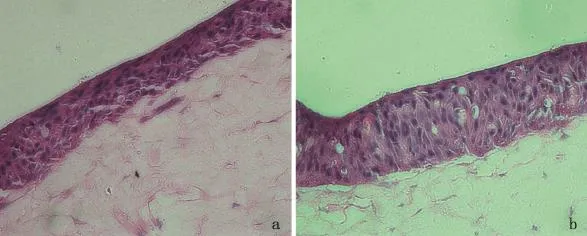
图1 角质形成细胞(a)和黑素细胞(b)在胶原和成纤维细胞形成的组织工程真皮表面培养10天后(HE,×200)
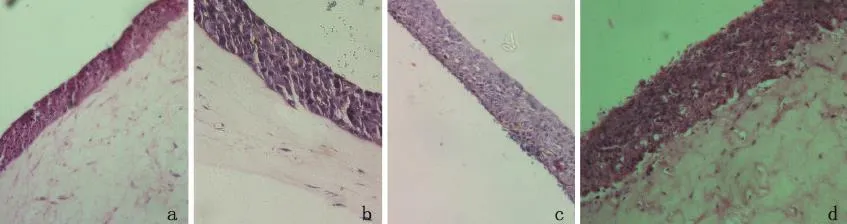
图2 糠秕马拉色菌感染组织工程皮肤12 h(a),24 h(b),48 h(c)和72 h(d)后(HE,×100)

图3 糠秕马拉色菌感染组织工程皮肤12 h(a),24 h(b),48 h(c)和72 h(d)后,PAS染色后油镜下观察结果(×1000)
3 讨论
本研究在前期构建的含色素的人源性组织工程皮肤的基础上,利用马拉色菌相关疾病中较常见的糠秕马拉色菌对其进行感染,初步建立糠秕马拉色菌感染的组织工程模型。结果显示,随着糠秕马拉色菌感染时间的延长,组织工程皮肤的基本结构不被该菌体破坏,芽生孢子密度随着时间延长而增加,对于组织工程皮肤的侵袭仅限于表皮浅层。
马拉色菌作为最常见的皮肤真菌感染菌之一,关于马拉色菌致病机制的体外研究方面,有研究将马拉色菌在体外含油的培养基中培养,分析其分泌各种生物活性产物在其致病过程中可能发挥的作用,由于体外培养与该菌体在人体皮肤表面作用时的环境相差较大,马拉色菌分泌物的类型和模式会有较大差异,因此需要更理想的体外模型证实其各种分泌产物的作用。
早在上个世纪末Bhattacharyya等10首次利用I型鼠尾胶原复合成纤维细胞构建组织工程真皮,在其上培养角质形成细胞构建出组织工程皮肤,利用糠秕马拉色菌感染该模型后,进行组织结构的观察发现糠秕马拉色菌仅侵袭表皮上部,对皮肤组织的破坏极小。Holland等11在组织工程皮肤构建的基础上,利用低浓度表皮葡萄球菌、痤疮丙酸杆菌、马拉色菌等常驻菌群感染该模型建立体外微生态模型,检测随感染时间延长各种病原体数量平稳上升,模型最长可维持120 h。
基于以上出发点,为了在体外建立更接近于马拉色菌感染的实际环境,本研究在含色素的组织工程皮肤构建的基础上建立了糠秕马拉色菌感染模型,在感染的不同时间段进行切片观察,结果显示随着培养时间的不断延长,HE染色中,组织工程皮肤结构始终保持完整,未见破坏。PAS染色显示,随着感染时间的延长,糠秕马拉色菌芽生孢子由最初低密度黏附于表皮上方逐渐转变为侵入表皮上部。糠秕马拉色菌对组织工程皮肤的感染模式显示其对组织工程皮肤的破坏力极低,侵入范围仅限于表皮浅层。这一特征符合马拉色菌作为角层真菌,只侵犯角质层而不侵犯基底层、真皮及真皮深层的特点。与国外的类似研究有着相似的结果,与国外的研究相比,本研究所建立的模型中包含有黑素细胞,对马拉色菌相关的色素性疾病的研究更有优势,同时表皮的主要成分是由角质形成细胞和黑素细胞,在对抗外源性微生物过程中,可能存在细胞间的交互对话及协同作用,因此,含色素的组织工程皮肤马拉色菌感染模型在其致病机制的研究中更有优势。
1 Pedrosa AF,Lisboa C,Rodrigues AG.Malassezia infections:A medical conundrum.J Am Acad Dermatol,2014,71(1):170-176.
2 Gaitanis G,Velegraki A,Mayser P,et al.Skin diseases associated with Malassezia yeasts:facts and controversies.Clin Dermatol,2013,31(4):455-463.
3曹玉萍,周武庆,马鹏程,等.组织工程表皮与单核白血病细胞共培养的致敏性检测模型.中国组织工程研究与临床康复,2011,15(20):3641-3644.
4曹玉萍,周武庆,马鹏程,等.用HaCaT细胞和正常人黑素细胞构建组织工程皮肤.毒理学杂志,2009,23(5):341-344.
5 Saadatzadeh MR,Ashbee HR,Cunliffe WJ,et al.Cell-mediated immunity to themycelial phase of Malassezia spp.in patients with pityriasis versicolor and controls.Br JDermatol,2001,144(1):77-84.
6 Kesavan S,Holland KT,Ingham E.The effects of lipid extraction on the immunomodulatory activity of Malassezia species in vitro.Med Mycol,2000,38(3):239-247.
7罗东辉,王侠生.糠秕孢子菌诱导培养角质形成细胞凋亡的研究.临床皮肤科杂志,2000,29(6):336-338.
8陈菊萍,冉玉平,魏大鹏,等.马拉色菌与人角质形成细胞株共同培养液对培养人黑素细胞生长及酪氨酸酶mRNA表达的影响.中国麻风皮肤病杂志,2006,22(2):122-124.
9冉玉平,周光平,坪井良治,等.糠秕孢子菌与培养人角质形成细胞的相互作用.中华皮肤科杂志,1997,30(5):294-298.
10Bhattacharyya T,Edward M,Cordery C,et al.Colonization of living skin equivalents by Malassezia furfur.Med Mycol,1998,36(1):15-19.
11 Holland DB,Bojar RA,Jeremy AH,et al.Microbial colonization of an in vitromodel of a tissue engineered human skin equivalent-a novel approach.FEMS Microbiol Lett,2008,279(1):110-115.
(收稿:2015-05-17 修回:2015-07-16)
·病例报告·
Construction of tissue-engineered skin for themodel of Malassezia furfur infection
CAO Yu-ping,SHEN Yong-nian,LVGui-xia,etal.Institute ofDermatology,Chinese Academy ofMedical Sciences&Peking Union Medical College,Nanjing,210042
Objective:To constructan in vitromodel of tissue-engineered skin for Malassezia furfur infection.M ethods:The tissue engineered dermis was used to constructwith primary cultured fibroblasts and bovine collagenm ixed solution.And then,keratinocytes and melanocyteswere seeded on the surface of the engineered dermiswith themethod ofair-liquid interface culture.The suspension of Malassezia furfur was inoculated with the pigmented tissue-engineered skin.At different time points,HE staining and PAS staining were performed.Resu lts:The structure of the tissue engineered skin was intactand compact,with 8-10 cell layers. Blastospores of Malassezia furfur were only seen in the upper of epiderm is over time through the hematoxylineosin staining and periodic acid-schiff staining.Conclusion:Malassezia furfur infected tissue-engineered skin was successfully established,which can be used for a studymodels of Malassezia furfur infection in vitro.
Malassezia furfur;tissue engineering
江苏省自然科学基金项目(编号:BK2008092)
江苏省临床医学科技专项(编号:BL2012003)
2014年度北京协和医学院协和青年基金(编号:33320140051)
北京协和医学院中国医学科学院皮肤病研究所,江苏南京,210042

