携带SXT/R391家族整合接合元件多重耐药菌株的高效筛选与分析
孙凤娇,贺 羽,陈兰明*
(农业部水产品贮藏保鲜质量安全风险评估重点实验室(上海),上海海洋大学食品科学与技术学院,上海 201 306)
携带SXT/R391家族整合接合元件多重耐药菌株的高效筛选与分析
孙凤娇,贺羽,陈兰明*
(农业部水产品贮藏保鲜质量安全风险评估重点实验室(上海),上海海洋大学食品科学与技术学院,上海 201 306)
本研究建立了一种抗生素平板与分子检测相结合的高效筛选水产品中携带SXT/R391家族整合接合元件(integrative and conjugative elements,ICEs)的多重耐药菌株的方法。采用美国临床与实验室标准研究所标准Kirby-Bauer纸片扩散法、需氧菌液体微量稀释法,以及接合实验,对筛选、鉴定获得的携带SXT/R391家族ICEs的变形杆菌(Proteus vulgaris)进行了抗菌素、重金属抗性以及ICEs元件接合转移活性的分析。结果表明:运用本研究建立的筛选法可有效获得含有多重耐药基因的ICEs元件,其检出率为3%,远高于常规聚合酶链式反应技术的检测水平(<1‰)。受试菌株对六大类10 种抗菌素均表现出抗性,并且对重金属镉、铜、锌和汞具有高度耐受性。接合实验证明了受试菌株所携带的ICEs元件在普通变形杆菌与大肠杆菌(Escherichia coli)MG1655之间的自我转移活性。
整合接合元件;SXT/R391家族;多重耐药;重金属抗性
自2002年以来,我国已成为世界第一大水产品生产国和出口国[1-2]。可是,随着水产养殖业的高密度、集约化、规模化的快速发展,细菌性病害的发生更为频繁,给中国水产养殖业带来了严重的经济损失[3]。目前,化学药物防治仍然是我国水产养殖病害控制的主要措施之一,然而抗生素的过量使用现象较为普遍,导致抗性致病菌甚至“超级细菌”的形成;同时,药物残留造成的环境污染也加速了多药抗性(multip le drug resistance,MDR)基因的传播和扩散[2-6]。
原核生物的可移动遗传元件(mobile geneticelement,MGEs)通过接合、转化、转导等方式介导遗传物质在不同种属细菌间的横向(水平)基因转移(lateral/horizontal gene transfer,LGT/HGT)[4-5]。研究发现,携带抗性基因簇的SXT/R391家族的可移动遗传性整合接合元件(integrative and conjugative elements,ICEs)与抗药性的散播高度相关。ICEs元件最初发现于1992年导致印度和孟加拉霍乱爆发的致病性霍乱弧菌(Vibrio cholera)MO10临床分离株中,该菌株携带的99.5 kb SXT元件含有编码磺胺甲基异噁唑(sulfamethoxazole,Su)、甲氧苄氨嘧啶(trimethoprim,Tm)、链霉素(streptomycin,Sm)和氯霉素(chloramphenicol,Cm)的抗性基因[6-7]。此后,国内外研究发现,SXT/R391家族ICEs元件不仅存在于弧菌属(Vibrio)细菌中,而且还在超过25 个种属的细菌中被检测和鉴定,例如变形菌属(Proteus)、克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)等[8-12],它们广泛存在于水产品、养殖水体等环境水体中[13-14]。作为MDR基因的载体,环境中ICEs元件及其散播的分子机制已成为国内外研究的热点[15-16]。生物信息学的方法也已广泛应用于细菌ICEs的研究,ICEs数据库ICEberg(http://db-mml.sjtu.edu.cn/ ICEberg/)通过生物信息学预测和文献挖掘,已系统地识别了上百个细菌中400多个ICEs,包括89 个SXT/R391家族的ICEs。但是目前所发现的ICEs仅如冰山一角,未来必将在越来越多隶属于不同种属的原核生物中发现SXT/R391家族ICEs的存在[17]。
本研究课题组在国内率先开展了水产品、养殖水体、环境淡水和海水中携带ICEs元件弧菌的大量研究工作。本实验研究一种抗性平板与分子检测相结合的高效筛选携带MDR基因SXT/R391家族ICEs元件的方法;并对本研究所获目的菌株进行了药物敏感性、重金属耐受性以及ICEs元件自主传递活性的测定,为MDR超级细菌形成的分子机制以及水产食品安全的风险评估研究奠定基础。
1 材料与方法
1.1材料、试剂与仪器
水产品样品采集于上海恒大水产市场和上海芦潮港水产市场。
MiniBEST细菌基因组DNA提取试剂盒、Premix Ex Taq DNA聚合酶 大连宝生物工程有限公司;庆大霉素琼脂培养基、碱性蛋白胨水(alkaline peptone water,APW)、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、Luria-Bertani培养基(LB)、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(thiosulfate citrate bile salts sucrose,TCBS) 北京陆桥技术有限责任公司;Mueller-Hinton Broth(MHB)培养基以及抗生素试纸片,包括氨苄西林(ampicillin,AMP,10 μg)、链霉素(streptomycin,STR,10 μg)、氯霉素(chloramphenicol,CHL,30 μg)、卡那霉素(kanamycin,KAN,30 μg)、复方新诺明(trimethoprim-sulfamethoxazole,SXT,25 μg)、四环素(tetracycline,TET,30 μg)、甲氧苄氨嘧啶(trimethoprim,TMP,5 μg)、利福平(rifampin,RIF,5 μg)、庆大霉素(gentamicin,GEN,10 μg)、壮观霉素(spectinomycin,SPE,100 μg) 英国Oxoid公司;重金属BaCl2、PbCl2、ZnCl2、CrCl3、CdCl2、NiCl2、CuCl2、HgCl2上海国药集团化学试剂有限公司。
Eppendorf 6325 PCR仪、Eppendorf 5424高速冷冻离心机 德国Eppendorf公司;电泳仪、Bio-Rad CHEF Mapper XA System凝胶成像系统 美国Bio-Rad公司;拍击式均质器 法国Interscience公司;多功能酶标仪美国BioTek公司;MilliQ纯化柱纯水仪 法国Millipore公司。
1.2样品制备
参考Loi-Braden等[18]的方法富集样品中的细菌,根据美国食品药品管理局的标准细菌学分析手册(the Standard of the Bacteriological Analytical Manual(BAM)of U.S. Food and Drug Administration,8th Edition Revision A,1998)分离样品中的细菌。步骤如下:无菌操作将25 g水产品样品置于无菌均质袋中,加入225 mL的APW(3 g/100 mL NaCl),用拍击式均质器拍打3 min成为匀浆。将匀浆倒入250 mL无菌离心瓶中,380×g离心5 min。收集上清液于50 mL无菌离心管中,5 000×g离心7 min,弃上清后将沉淀重悬浮于5 mL APW中为菌体原液,并用APW梯度稀释5~25 倍后,各吸取原液与稀释液100 ☒L涂布于庆大霉素平板和TCBS平板上,放置于37 ℃培养箱中过夜培养。
1.3SXT/R391家族ICEs元件保守核心基因的检测
挑取上述平板上生长良好的单菌落,接种在含200 ☒L APW(3 g/100 mL NaCl)的96 孔细菌培养板中,置于37 ℃培养16~18 h。吸取10 ☒L菌液至200 ☒L的超纯水中,95 ℃热裂解15 min。吸取1 ☒L裂解液为模板,采用聚合酶链式反应(polymerase chain reaction,PCR)技术,扩增SXT/R391家族ICEs元件的保守功能模块相关核心基因,包括整合酶基因(int)、ICEs调控蛋白基因(setR)、接合转移相关蛋白基因(traC、traI),以及SXT/R391家族ICEs元件携带的典型链霉素(strA、strB),甲氧苄氨嘧啶(dfrA1、dfr18),磺胺甲基异噁唑(sul2)抗性基因。PCR扩增反应条件参考Song Yuze等[15]的方法,PCR反应引物以及相应的扩增产物长度见表1。寡核苷酸引物由生工生物工程(上海)股份有限公司合成。对检测结果为阳性的菌株,通过16S rRNA基因的PCR扩增和DNA序列的测定进行鉴定。

表1 寡核苷酸引物及其序列Table1 The oligonucleotides used in this study
1.4抗菌素平板-PCR结合筛选法
收集上述庆大霉素平板或TCBS平板上生长的菌体,采用磷酸盐缓冲液(phosphate buffered saline,PBS,pH 7.4)[22]重悬菌体,系列梯度稀释后,涂布于LB选择性平板(含256 ☒g/mL磺胺甲基异噁唑,128 ☒g/mL链霉素)或LB选择性平板(含128 ☒g/mL磺胺甲基异噁唑,64 ☒g/mL链霉素)上,37 ℃过夜培养。挑取选择性平板上生长良好的单菌落,按照上述菌液PCR法,检测受试菌的ICEs元件保守核心基因(int、setR、traC、traI)与典型耐药基因(strA、strB、sul2、dfrA1、dfr18)。对检测为阳性的菌株,进行16S rRNA基因的PCR扩增和DNA序列的测定与鉴定。
1.5抗菌素药物敏感性和重金属抗性分析
采用美国临床与实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI,2012版)标准纸片扩散法(Standards for Antimicrobial Disk Susceptibility Tests),对受试菌进行六大类10 种抗生素的药物敏感性测试。质控菌大肠杆菌(Escherichia coli)ATCC25922与铜绿假单胞菌(Pseudomonas aeruginosa)ATCC2785购自上海工业微生物研究所。参考美国CLSI的需氧菌液体微量稀释法,对受试菌株进行重金属(BaCl2、PbCl2、 ZnCl2、CrCl3、CdCl2、NiCl2、CuCl2、HgCl2)耐受性测定。进行3 次独立平行实验。
1.6接合实验
参考Song Yuze[15]、Waldor[23]等的方法,以E. coli MG1655(Cmr、Sms、Sus)为受体菌,本研究分离菌株为供体菌进行接合实验。挑取LB抗性平板(含磺胺甲基异噁唑256 ☒g/mL、链霉素128 ☒g/mL、氯霉素30 ☒g/mL)上生长的接合子单菌落,提取基因组DNA,检测ICEs元件保守核心基因、耐药基因以及16S rDNA。同时计算受试菌接合效率,即形成接合子数量/供体菌数量。分别进行3 次独立平行实验。
2 结果与分析
2.1抗菌素平板-PCR结合筛选法的建立
本研究采用庆大霉素平板与TCBS平板从虾、贝类水产品中初筛获得约1 000 株弧菌或变形菌属分离菌株。采用PCR法检测SXT/R391家族ICEs元件耐药基因与保守功能模块核心基因,结果显示:链霉素、磺胺甲基异噁唑、甲氧苄氨嘧啶抗性基因(strA/strB、sul2、dfrA1/dfr18)的检出率分别约为28%、40%和13%,携带2 种或以上抗性基因的菌株检出率分别约为7%、1%;ICEs元件保守功能模块核心基因int、setR、traC、traI检出率分别约为48%、25%、20%和23%,携带ICEs元件保守功能模块核心基因的菌株检出率约为4%,与Bakhshi等[24]报道的5.4%的筛选率基本一致。但是,在受试菌中未筛选到ICEs元件可变区Ⅲ插入MDR基因簇的菌株。
Song Yuze[15]和唐毓祎[25]等的研究也表明仅采用传统PCR技术获得携带MDR基因的ICEs元件的环境分离菌株筛选率极低(<1‰)。因此,本研究在初筛基础上,增加了氯霉素、链霉素、磺胺甲基异噁唑抗性平板筛选步骤,对获得的200 株阳性分离菌株进行了ICEs元件核心基因与典型耐药基因簇的检测,结果显示:int、setR基因检出率分别为43%和27%,但是,int和setR基因同时检测为阳性的菌株,经进一步检测为携带SXT/R391家族ICEs元件且含有MDR抗性基因菌株的筛选率高达3%,远高于传统PCR技术的筛选率(< 1‰)。
2.2“多重耐药菌”抗菌素药物敏感性及重金属耐受性的分析
本研究对筛选获得的阳性菌株中的5 株分别进行了16S rRNA基因的PCR扩增和序列测定。BLASTn比对分析结果显示,它们与RDP数据库[26](http://rdp.cme.msu. edu/)中普通变形杆菌(Proteus vulgaris)16S rRNA基因序列相似性为99%。抗生素药物敏感性分析结果显示:受试菌株对8 种抗生素均表现出抗性,包括氨苄西林、链霉素、氯霉素、卡那霉素、新诺明、甲氧苄氨嘧啶、利福平和壮观霉素,对庆大霉素与四环素表现为中介。其中,链霉素、甲氧苄氨嘧啶、磺胺甲基异噁唑和氯霉素的抗性为SXT/R391家族ICEs元件携带菌株具有的典型MDR表型。此外,本研究对获得的“多重耐药菌”还进行了8 种环境常见重金属的敏感性测定,结果如表2所示。受试菌株对重金属锌(≥3 200 μg/mL)、铜(≥3 200 μg/mL)、镉(≥3 200 μg/mL)和汞(≥25 μg/mL)表现出高度抗性。
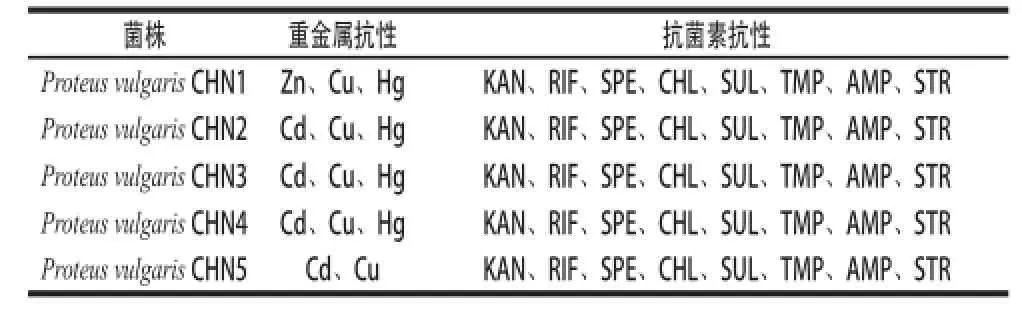
表2 携带SXT/R391家族ICEs元件变形杆菌分离菌株重金属与抗菌素的耐受性Table2 Susceptibility off Proteus vulgaris isolates harboring SXT/R391 family of ICEs to heavy metals and antimicrobial agents
2.3变形杆菌分离菌株携带的ICEs元件的接合转移活性
本研究以筛选获得的携带SXT/R391家族ICEs的变形杆菌为供体菌,E. coli MG1655作为受体菌进行了接合实验,在LB抗性平板上(含256 ☒g/mL磺胺甲基异噁唑,128 ☒g/mL链霉素,30 ☒g/mL氯霉素)获得了E. coli MG1655接合子。PCR检测接合子的ICEs元件核心基因(int、setR、traC、traI)以及典型耐药基因簇(strA、strB、sul2)均呈阳性反应;并且通过接合子的16S rDNA序列测定鉴定,证明了本研究发现的SXT/R391家族ICEs元件(命名为ICEPvuChn1~ICEPvuChn5)在变形杆菌与大肠杆菌之间自主的接合转移活性,介导MDR基因在不同属细菌间的传播。它们的自主传递频率如表3所示,其中ICEPvuChn3的自主接合转移效率最高,为6.61×10-4。
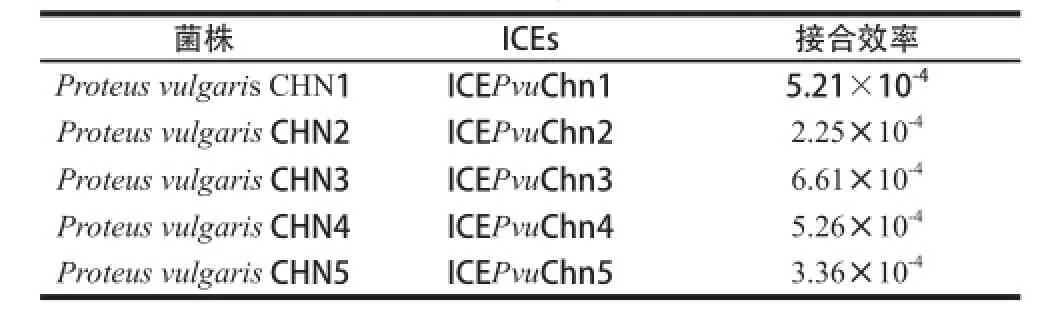
表3 普通变形杆菌携带的SXT/R391家族ICEs元件自主传递频率的比较Table3 Self-transmissible activity of SXT/R391 family of ICEs derived from from Proteus vulgaris aris isolates ates
3 讨 论
ICEs元件兼具转座子、质粒和噬菌体的特性,既可以在染色体上跳跃,从宿主染色体上切离、整合并随染色体一起复制,也可以接合形式在细胞与细胞间进行DNA转移[16]。ICEs携带大量基因信息,例如,耐药基因、抗重金属基因、烃类化合物降解基因等,使得宿主对环境胁迫获得适应性[8-9]。SXT/R391家族作为ICEs中较具代表性的一类,阐明其耐药基因散播的分子机制将对致病菌防控研究起到重要的实践指导意义[20]。
变形杆菌在自然界中分布广泛,腐物寄生,属于条件致病菌。普通变形杆菌可引发人类肠 道或尿道感染等疾病及水产养殖鱼类疾病[27]。近年来,涉及变形杆菌属ICEs元件携带菌株的相关研究大多集中于临床分离菌株[28]。本研究自水产品中分离、鉴定出携带SXT/R391家族ICEs元件的变形杆菌,表现出多重耐药性和重金属抗性特性,并且在不同种属细菌间具有自主转移活性。细菌的重金属耐受性及协同选择机制下的抗生素抗性问题已对生态环境和人类健康构成潜在威胁[29-30]。多重抗性菌株的加快形成和抗性基因的连锁传播为致病菌感染性疾病的医治带来了极大的挑战[4]。本研究建立的高效筛选携带ICEs元件多重耐药菌的方法,为进一步探讨环境中重金属和抗生素逆境应答的共选择机制以及多重抗性超级细菌形成的分子机制奠定了基础。
[1] 张家国, 刘翠玲. 乳酸菌代替抗生素在水产养殖上的应用[J]. 中国水产, 2014(7): 66-68.
[2] 孙胤. 我国出口贸易的现状及发展对策[J]. 统计与管理, 2014(1):34-36.
[3] 王德武, 张健. 浅谈水产品质量安全及对策[J]. 中国科技博览,2013(6): 268.
[4] BURRUS V, PAVLOVIC G, DECARIS B, et al. Conjugative transposons: the tip of the iceberg[J]. Molecular Microbiology, 2002,46(3): 601-610.
[5] WOZNIAK R A, WALDOR M K. Integrative and conjugat ive elements: mosaic mobile genetic elements enabling dynamic lateral gene fl ow[J]. Nature Reviews Microbiology, 2010, 8(8): 552-563.
[6] HOCHHUT B, LOTFI Y, MAZEL D, et al. Molecular analysis of antibiotic resistance gene clusters in Vibrio cholerae O139 and O1 SXT constins[J]. Antimicrobial Agents and Chemotherapy, 2001,45(11): 2991-3000.
[7] WALDOR M K, TSCHAPE H, MEKALANOS J J. A new type of conjugative transposon encodes resistance to sulfamethoxazole,trimethoprim, and streptomycin in Vibrio cholera e O139[J]. Journal of Bacteriology, 1996, 178(14): 4157-4165.
[8] HOCHHUT B, BEABER J W, WOODGATE R, et al. Formation of chromosomal tandem arrays of the SXT element and R391,two conjuga tive chromosomally integrating elements that share an attachment site[J]. Journal of Bacteriology, 2001, 183(4): 1124-1132.
[9] HOCHHUT B, WALDOR M K. Site-specific integration of the conjugal Vibrio cholerae S XT element into prfC[J]. Molecular Microbiology, 1999, 32(1): 99-110.
[10] AHMED A M, SHINODA S, SHIMAMOTO T. A variant type of Vibrio cholerae SXT element in a multidrug-resistant strain of Vibrio fl uvialis[J]. Federation of Eur opean Microbiological Societies Microbiology Letters, 2005, 242(2): 241-247.
[11] TAVIANI E, CECCARELLI D, LAZARO N, et al. Environmental Vibrio spp., isolated in Mozambique, contain a polymorphic group of integrative conjugative elements and class 1 integrons[J]. Federation of European Microbiological Societies Microbiology Letters, 2008,64(1): 45-54.
[12] MATA C, NAVARRO F, MIRO E, et al. Prevalence of SXT/R391-like integrative and conjugative elements carrying blaCMY-2 in Proteus mirabilis[J]. Journal of Antimicrobial Chemotherapy, 2011, 66(10):2266-2270.
[13] DACCORD A, CECCARELLI D, BURRUS V. Integrating conjugative elements o f the SXT/R391 family trigger the excision and drive the mobilization of a new class of Vibrio genomic islands[J]. Molecular Microbiology, 2010, 78(3): 576-588.
[14] BURRUS V, MARRERO J, WALDOR M K. The current ICE age: biology and evolution of SXT-related integrating conjugativ e elements[J]. Plasmid, 2006, 55(3): 173-183.
[15] SONG Yuze, YU Pan, LI Bailin, et al. The mosaic accessory gene structures of the SXT/R391-like integrative and conjugative elements derived from Vibrio spp. iso lated from aquatic products and environment in the Yangtze Riv er Estuary, China[J]. BioMed Central Microbiology, 2013, 13(1): 214-226.
[16] FALBO V, CARATTOLI A, TOSINI F, et al. Antibiotic resistance conferred by a conjugative plasmid and a class I integron in Vibrio cholerae O1 El Tor strains isolated in Albania and Italy[J]. Antimicrob Agents Chemother, 1999, 43(3): 693-696.
[17] BI D, XU Z, H ARRISON E M, et al. ICEberg: a web-based r esource for integrative and conjugative elements found in bacteria[J]. Nucleic Acids Research, 2012, 40: D621-D626.
[18] LOI-BRADEN M H, HUANG T S, KIM J H, et al. Use of electrolyzed oxidizing water for quality improvement of frozen shrimp[J]. Journal of Fo od Science, 2005, 70(6): M310-M315.
[19] DALSGAARD A, FORSLUND A, TAM N V, et al. Cholera in Vietnam: changes in genotypes and emergence of class I integrons containing aminoglycoside resistance gene cassettes in Vibrio cholerae O1 strains isolated from 1979 to 1996[J]. Journal of Clinical Microbiology, 1999, 37(3): 734-741.
[20] IWANAGA M, TOMA C, MIYAZATO T, et al. Antibiotic resistance conferred by a class I integro n and SXT constin in Vibrio cholerae O1 strains isolated in Laos[J]. Antimicrob Agents Chemother, 2004, 48(7):2364-2369.
[21] WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703.
[22] SAMBROOK J, RUSSELL D W. Molecular cloning: a laboratory manual[M]. 3th ed. New York: Cold Spring Harbor Laboratory Press, 2001.
[23] WALDOR M K, TSCHAPE H, MEKALANOS J J. A new type of conjugative transposon encodes resistance to sulfamethoxazole,trimethoprim, and streptomycin in Vibrio cholerae O139[J]. Journal of Bacteriology, 1996, 178(14): 4157-4165.
[24] BAKHSHI B, BARZELIGHI H M, ADABI M, et al. A molecular survey on virulence associated genotypes of non-O1 non-O139 Vibrio cholerae in aquatic environment of Tehran, Iran[J]. Water Research,2009, 43(5): 1441-1447.
[25] 唐毓祎, 谈建国, 缪海振, 等. 南美白对虾养殖水体中霍乱弧菌的毒力、耐药及重金属抗性研究[J]. 上海海洋大学学报, 2014, 23(6):867-873.
[26] COLE J R, WANG Q, FI SH J A, et al. Ribosomal Database Project:data and tools for high throughput rRNA analysis[J]. Nucleic Acids Research, 2014, 42(D1): D633-D642.
[27] 金元宝, 王英, 刘莉萍, 等. 鲎素I对普通变形杆菌的作用研究[J]. 生物技术通报, 2014(5): 190-196.
[28] 陈晓莉, 徐元宏, 储洁 , 等. 临床分离的变形杆菌中整合子分型研究[J].中国微生态学杂志, 2007, 19(5): 408-410.
[29] 窦秋燕, 贡娇娜, 张智辉, 等. 细菌金属耐受性及协同选择抗生素抗性的研究进展[J]. 云南大学学报: 自然科学版, 2009(增刊1):523-526.
[30] NISHINO K, NIKAIDO E, YAMAGUCHI A. Regulation of multidrug effl ux syst ems involved in multidrug and metal resistance of Salmonella enterica serovar Typhimurium[J]. Journal of Bacteriology,2007, 189(24): 9066-9075.
Effective Screening for Multiple-Drug Resistant Bacteria Harboring SXT/R391 Family of Integrative and Conjugative Elements
SUN Fengjiao, HE Yu, CHEN Lanming*
(Laboratory of Quality and Safety Risk Assessment for Aquatic Products on Storage and Preservation (Shanghai), Ministry of Agriculture, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
In this study, we established a highly effective method to screen multiple-drug resistant (MDR) bacteria carrying the integrative and conjugative elements (ICEs). Five Proteus vulgaris strains harboring SXT/R391 family of ICEs, isolated from aquatic products in Shanghai, China, were obtained using the new method. Antimicrobial activity and heavy metal susceptibility of the P. vulgaris strains w ere examined using standard Kirby-Bauer disk diffusion method and dilution susceptibility t ests according to the Clinical and Laboratory Standards Institute (CLSI, USA, 2012 Edition), all showing distinct resistance to ten antimicrobial agents belonging to six drug classes tested. In addition, a wide heavy metal resistance profile was also detected, displaying strong resistance to Cd, Cu, Zn and Hg. The conjugation experiments demonstrated the capacities of active self-transmission of the SXT/R391-like ICEs between P. vulgaris and Escherichia coli MG1655 strains. Our results will facilitate further research on collaborative selection mechanism of environmental antibiotics and heavy metals, and early warning in prevalence of novel MDR bacteria or “super bacteria”.
integrative and conjugative elements (ICEs); SXT/R391 family; multiple-drug resistance; heavy metal tolerance
TS201.3
A
1002-6630(2015)13-0079-05
10.7506/spkx1002-6630-201513016
2015-02-11
国家自然科学基金面上项目(31271830)
孙凤娇(1988—),女,硕士研究生,研究方向为食品质量与安全。E-mail:fengjiaosun@foxmail.com
陈兰明(1965—),女,教授,博士,研究方向为食品安全与质量控制、海洋微生物资源的开发与利用。E-mail:lmchen@shou.edu.cn

