籼稻不育系花药培养诱导条件探讨
李三和 陈志军 刘凯等

摘要:以7个籼稻不育系的花药为材料,探讨了籼稻不育系花药培养诱导的条件。结果表明,材料品种对诱导效率的影响最为明显;诱导培养基中激素浓度处理对籼稻花药的愈伤诱导率的影响有显著差异,KT浓度以1 mg/L为宜,碳源以蔗糖50 g/L相对较好,但替换成50 g/L的麦芽糖后诱导效率相对稳定;取材后以8 ℃低温预处理12 d达到最好效果。
关键词:花药培养;诱导效率;籼稻不育系
中图分类号:S511.2+1 文献标识码:A 文章编号:0439-8114(2015)19-4868-03
DOI:10.14088/j.cnki.issn0439-8114.2015.19.056
Abstract: The effects of variety, phytohormone KT, carbon source and days of pretreatment on anther culture were studied with seven Indica rice male sterile lines. The results showed that the variety had the most obvious influence on induction efficiency and the phytohormone KT had difierent effect on the callus induction rate. The proper concentration of KT in medium for callus induction was 1.0 mg/L. Sucrose was the best carbon source with whose concentration was 50 g/L, but maltose with the same dose in medium had a stable efficiency. The best day of cold pretreatment was 12 days in 8 ℃ for most male sterile lines for anther culture.
Key words: anther culture; induction efficiency; Indica rice male sterile line
花药培养是目前生物技术育种中一项较为成熟、实用而有效的技术,大量应用于粳稻育种和水稻的提纯复壮[1-4],并育成了中花系列、龙粳系列的粳稻品种。花药培养诱导产生的单倍体,表现出双亲性状的各种重组类型,通过自然加倍或人工处理加倍,可以在当代获得稳定的纯合二倍体。花药培养与常规育种技术相结合,可以快速纯合有益基因,提高选择效率,缩短育种周期[5,6]。但在实际操作过程中,由于受培养基组分、材料的差异性以及培养环境的影响,往往获得的再生植株群体较小,使选择受到较大的限制。因此,提高花药培养的诱导效率,增大花培后代群体,是水稻花药培育种成败的关键。粳稻的花药培养已经相对比较成熟,但基本局限于常规粳稻的培养。籼稻的花培效率一直低下,籼稻不育系更低。关于如何提高花药培养的效率,国内外许多学者在基本培养基成分、激素种类和配比、低温预处理等对培养效率的影响方面进行了大量的研究[7-12],但专门针对多种育种中间材料,尤其是籼稻不育系材料的花药培养研究报道并不多见。本研究通过对不同的籼稻不育系材料、同一材料的培养基中不同激素浓度、不同碳源、同一碳源不同用量等条件下进行诱导培养,探讨了籼稻不育系花药培养诱导阶段的最佳条件。
1 材料与方法
1.1 材料
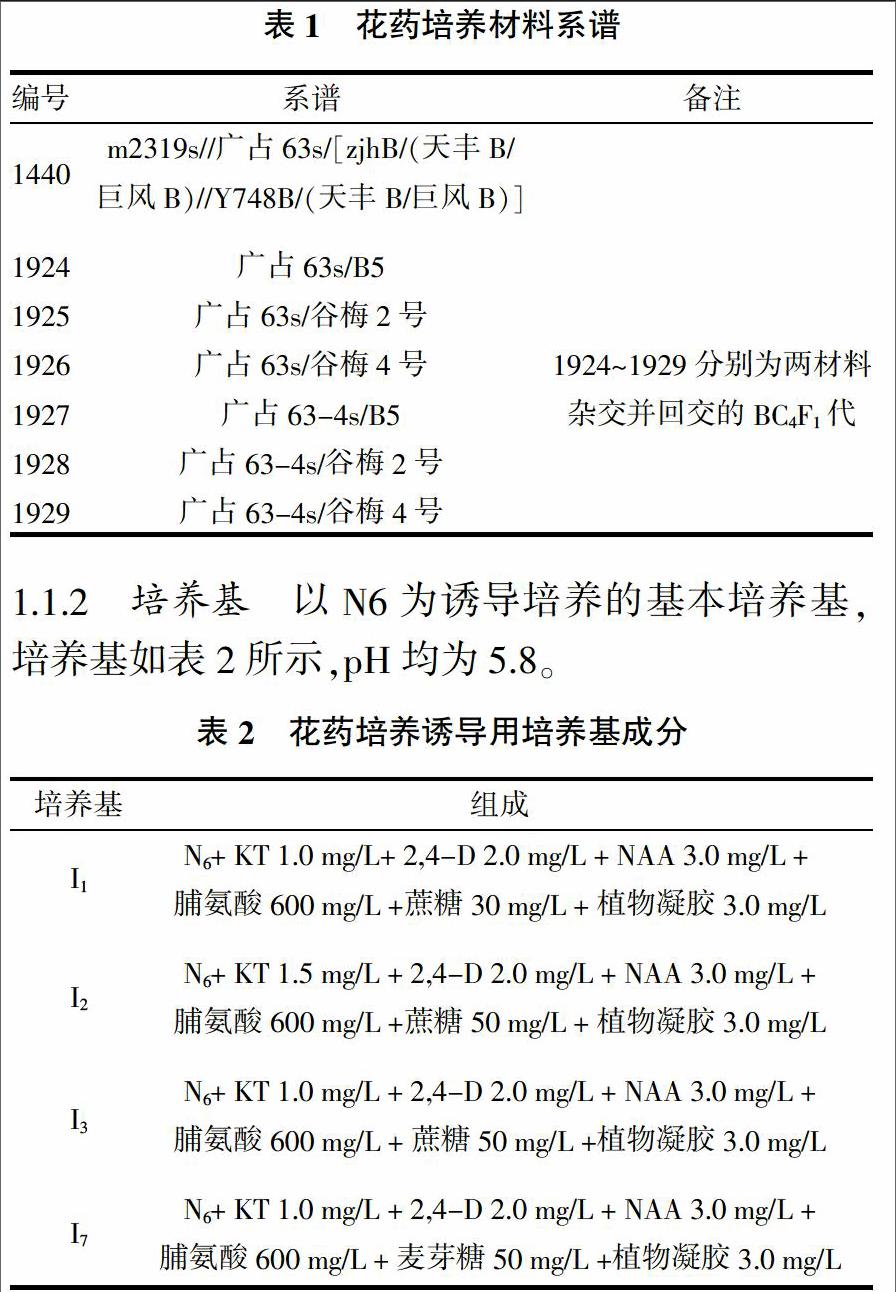
1.1.1 植物材料 所用水稻材料均为中稻籼型不育系,具体品种如表1所示。
1.1.2 培养基 以N6为诱导培养的基本培养基,培养基如表2所示,pH均为5.8。
1.2 方法
1.2.1 幼穗取材及低温预处理 幼穗取材一般于晴天上午10点前或下午5点后进行。选取剑叶与下一叶的叶枕距约5~10 cm的带苞叶稻穗,此时幼穗的颖壳宽度已接近成熟时的大小,颖壳呈现淡绿色,雄蕊伸长达到颖壳的1/3~1/2,花药发育处于单核中晚期。将带苞叶稻穗用湿润纱布包裹,装入保鲜袋后置于冰箱中8 ℃进行低温预处理8~12 d。
1.2.2 花药接种 无菌台上剥除稻穗苞叶,选取合适的小穗剪下,用3%的次氯酸钠溶液浸泡25 min,用无菌水冲洗4~5次,用无菌滤纸吸干水后,用剪颖抖药法将花药接至诱导培养基上,每个三角瓶约接种100个花药。
1.2.3 不同因素对诱导效率的影响 7种不同基因型的材料分别设置不同KT用量、不同碳源及浓度、不同预处理时间等处理,分析培养基成分、预处理时间及基因型对诱导效率的影响。诱导阶段均采取31 ℃黑暗培养。试验均在诱导培养50 d后统计愈伤诱导情况。
2 结果与分析
2.1 培养基成分对诱导效率的影响
本试验中所用诱导培养基均以N6培养基为基础,添加不同浓度的KT或碳源。从表3可以看出,不同培养基成分对每个材料的诱导效率都有明显的差别。以低温预处理12 d为例,I3培养基与I2培养基相比,KT用量由1.5 mg/L减至1.0 mg/L,除1924外的6个材料中诱导效率均有所升高,有的材料升高幅度还很大,说明高浓度的KT不利于花药培养愈伤组织的诱导。
与I1培养基相比,I3培养基增加了蔗糖的用量,由30 g/L增加到50 g/L,但从诱导效率上来看,7个材料除1924未用I1诱导外,其余6个材料有5个是I3培养基明显优于I1培养基,提高蔗糖的用量能增加籼稻不育系的花培诱导效率,用量为3%~6%。endprint
与I3培养基相比,I7培养基将碳源由蔗糖变为麦芽糖,用量相同。从7个材料的诱导效果来看,1440和1924效率有所提高,其余都有所降低。从表3还可看出,培养基使用相同含量的蔗糖时,不同的材料之间诱导效率会有较大的差异,但用麦芽糖作为碳源时,出愈率相对比较平稳。
4种培养基中,I1、I2、I3培养基对不同的材料的诱导效率都有较大的差异,I7则表现出相对稳定的出愈率,基本处于12%~24%之间。对于未知诱导效率的籼稻不育系材料来说,想要获得比较稳定的诱导效果,I7培养基是比较理想的选择。
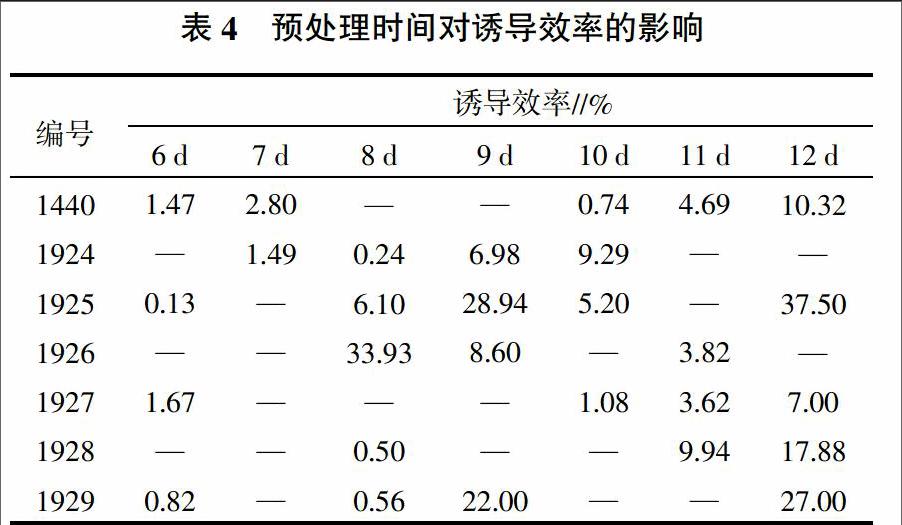
2.2 预处理时间对诱导效率的影响
预处理时间对诱导效率的影响如表4所示。以I3培养基为例,籼稻不育系材料预处理时间低于8 d,花培诱导效率都非常低,随着时间延长,诱导效率明显提高。本试验中预处理时间最长达12 d,这些材料诱导率达到了最高值,超过12 d后,诱导效率反而下降。
2.3 基因型对诱导效率的影响
7个不同材料除1924未使用I1培养基外,其余都使用了I1、I2、I3、I7 4种培养基配方。从表3可以看出,对于使用同一种培养基而言,不同试验材料诱导效率有很大的差别。在1925、1926和1929 3个材料的试验中,4种诱导培养基都有相对较高的平均诱导效率,在10%以上,1926使用I3培养基可以达到33.93%;对1927来说,4种培养基的诱导率明显偏低很多,均低于5%。每个材料不同预处理时间和不同诱导培养基情况下的平均出愈率见表5。从表5也可以看出,不同材料的平均诱导率也存在较大差异,材料基因型对花培诱导效率的影响是最主要的。
3 小结与讨论
籼稻花药培养一直是被认为是各种水稻类型中培养力最低的[13,14],籼稻不育系的花药培养则由于不育系材料受气候的影响在某些地域会出现花药发育不正常的情况更加难以成功。本研究试图在普通籼稻材料的基础上探讨适合籼稻不育系花药培养的合适条件,结果表明,对于不育系材料而言,增加KT用量至1.5 mg/L会降低花培诱导效率,这与向发云的研究结果一致[12]。有研究表明,花培诱导过程仅使用生长素类激素2,4-D和NAA,而不使用KT[9],能得到较好的诱导效果,但张艳敏等[15]的对3个粳稻的试验表明,花药愈伤组织诱导的最佳激素组合中含有1 mg/L的KT。
在花药培养中,蔗糖一直是最常用的碳源,同时在培养基中起着调节渗透压的作用。水稻培养基中蔗糖浓度为一般为3%~6%,也有文献报道诱导阶段使用麦芽糖作为碳源有较好的效果[3,16],这些与本研究的结果有差异。本研究认为大部分籼稻不育系材料用蔗糖诱导效果较为理想,但使用麦芽糖作为培养基的碳源,对籼稻不育系有相对稳定的诱导效率。研究结果表明对于籼稻常规材料,麦芽糖的效果远远高于蔗糖(本文未列)。
低温预处理对水稻花培有较大的影响,从罗琼等[17]对偏籼材料的低温预处理看来,9 ℃处理7~10 d有利于提高花药愈伤组织诱导频率,本研究采用8 ℃处理12 d则能达到普遍较好的诱导效果。
材料(即不同基因型)对愈伤诱导效率的影响是最重要的。本研究中1924的平均诱导效率不到1925的1/6,各个其他材料之间差异也很大,这是几乎所有花培研究者公认结果。因此,为了提高培养效率,建议通过基因型筛选,积累培养力较高的花培资源,用培养力较高的粳稻品种作为桥梁亲本,配制优异的组合来获得较大量的花培苗[18],或者通过测定分析亲本及外植体的花药培养力,把高培养力基因导入到优良亲本或杂种中,改善花药适应离体培养的遗传背景来提高花培育种效果[19]。事实上,这些方法虽然切实可行,但由于实际育种过程中,籼稻培养力高的品种数量不多,籼粳交也因存在不亲和性等原因,应用起来也存在一定的困难。
参考文献
[1] 葛美芬,白和盛,王保和,等.籼型杂交稻三系花培提纯的技术途径及其在生产上的应用[J].杂交水稻,1989(S1):65-68.
[2] 张家宏,张永新.应用花培技术提纯不同质源不育系取得成效[J].杂交水稻,1995(2):27.
[3] 张承妹,陆家安,袁 勤,等.粳稻BT型三系花药培养提纯复壮[J].上海农业学报,2002,18(3):7-12.
[4] 马镇荣,凌定厚,王昌虎.花药培养对籼稻两用核不育系培矮64 S进行提纯与改良[J].热带亚热带植物学报,2000,8(4):308-314.
[5] 朱旭东,曾大力,斯华敏,等.标记两用核不育水稻M2S的花药培养及遗传分析[J].中国水稻科学,2002,16(2):24-128.
[6] 曾千春,吴 茜,冯德江,等.转修饰cryAc基因籼稻明恢81经花药培养获得抗虫DH系[J].生物工程学报,2002(4): 442-445.
[7] 孙宗修,斯华敏,程式华.麦芽糖提高水稻花培效率的研究[J].中国水稻科学,1993,7(4):227-231.
[8] RAINA S K,IRFAN S T.High frequency embryogenesis and plantlet regeneration from isolated microspores of rice[J]. Plant Cell Reports,1998,17:957-962.
[9] GABRIELA TREJO-TAPIA, URIEL M A,GUADALUPE S M. The effects of cold –pretreatment, auxins and carbon source on anther culture of rice[J].Plant Cell Tissue and Organ Culture,2002,71:41-46.
[10] 冯双华,赵 森,郭家源,等.不同培养基和激素对超级杂交稻花药培养力的影响[J].西南农业大学学报(自然科学版),2006,28(4):523-525,565.
[11] 王伍梅,台德卫,张效忠,等.水稻高效花药培养技术体系的构建[J].中国农学通报,2009,25(16):65-68.
[12] 向发云,宋志红,吴金平,等.籼稻材料特性和激素配比对花药培养效率的影响[J].湖北农业科学,2008,47(12):1380-1384.
[13] 沈锦骅,李梅芳,陈银全,等.花药培养在水稻品种改良上的应用[J].中国农业科学,1982(2):15-19.
[14] 赵成章.水稻试管苗正常化调控技术的研究[M].北京:北京工业大学出版杜,1990.
[15] 张艳敏,高润红,郭桂梅,等.不同优质粳稻花药对低温和激素处理的培养响应[J].上海农业学报,2011,27(2):121-124.
[16] 冯双华,侯海军,廖江林,等.不同因素对水稻温敏核不育系香125S花药培养的影响[J].农业现代化研究,2007,28(3):358-360.
[17] 罗 琼,曾千春,周开达,等.水稻花药培养及其在育种中的应用[J].杂交水稻,2000,15(3):1-2.
[18] 葛胜娟.水稻花药培养及其在遗传育种上的应用[J].种子,2013,32(8):45-50
[19] 迟 铭,方兆伟,李 健,等.花药培养在水稻育种中的应用研究进展[J].江苏农业科学,2011,39(6):111-113.endprint

