基于Mn掺杂ZnS量子点-BSA纳米复合材料检测头孢曲松钠
杨茂青,苗艳明,闫桂琴
(山西师范大学生命学院,山西临汾 041000)
文章编号:1000-7032(2015)04-0472-08
基于Mn掺杂ZnS量子点-BSA纳米复合材料检测头孢曲松钠
杨茂青,苗艳明,闫桂琴*
(山西师范大学生命学院,山西临汾 041000)
以3-巯基丙酸(MPA)为稳定剂,采用水相合成法合成了具有优良光学性质的Mn掺杂ZnS量子点。该量子点在室温条件下即可发射较强的磷光信号。将量子点与牛血清蛋白(BSA)偶联后,形成了纳米复合材料。由于BSA对量子点表面缺陷进行了有效修复,量子点发出的磷光明显增强。当加入头孢曲松钠后,头孢曲松钠与BSA的相互作用使量子点的磷光被有效猝灭,该磷光猝灭量(△P)与头孢曲松钠的浓度在一定范围内呈良好的线性关系(R=0.99)。量子点与BSA偶联的最佳条件为:pH=7.4,反应温度37℃,反应时间40 min,BSA浓度80 mg·L-1,量子点浓度40 mg·L-1。反应形成新的生物纳米复合材料,作为头孢曲松钠的磷光探针,其线性范围为0~30 μmol·L-1,相关系数R=0.99,检出限为0.14 μmol·L-1,相对标准偏差为1.63%。
量子点;牛血清蛋白;磷光探针;头孢曲松钠
1 引 言
掺杂型量子点是一种重要的纳米发光材料。掺杂离子通常不会改变量子点本身的晶体结构,并且会产生新的电子能级,产生新的发光性能[1-3]。相对于荧光量子点,室温磷光(Room-temperature phosphorscence,RTP)量子点具有发光寿命长、选择性高、线性范围宽等优点。由于磷光是一种很少见的现象,所以可避免样品基体自体荧光和散射光的干扰。ZnS是重要的Ⅱ-Ⅵ宽禁带直接带隙半导体纳米材料,相比于Cd等纳米材料,无毒的ZnS更适合应用于生物分析检测方面。Mn掺杂ZnS量子点容易与生物大分子等结合形成掺杂型ZnS量子点复合材料[4-5],量子点表面的羧基等功能基团赋予其更好的水溶性和与生物活性分子的相容性。游离羧基可通过偶联作用与多肽、蛋白质、核酸等生物分子的氨基脱水缩合构建较为稳定的室温磷光纳米复合材料[6-8],以其为磷光探针用于生物体药物检测,可以更清楚地了解药物在体内的代谢过程。
牛血清蛋白(Bovine serum albumin,BSA)由于其特异性结构及不寻常的配位结合性质,常作为生物蛋白的模式蛋白。BSA由582个氨基酸残基组成,二级结构主要为α-螺旋,除此以外还有β-折叠等类型[9]。BSA在体内承担各种代谢产物的运载,如脂肪酸、激素、氨基酸、尿素等,并转运至全身各处。在生理条件下,BSA的螺旋内部维系力较弱,结合部位易变。BSA的特殊结构使其能结合和转运多种内源性、外源性物质。
头孢曲松钠(Ceftriaxone,CTRX)为第三代头孢菌素类抗生素。其抗菌作用机理是能够抑制细菌细胞壁的合成。该药对革兰氏阴性菌和阳性菌有较强的抗菌作用,主要用于治疗腹腔感染、胆道感染、呼吸道感染、皮肤软组织感染、脑膜炎等及手术期致病菌的感染[10],但服用不当及超量注射会引起敏感性休克、溶血性贫血、肠胃系统损害等不良反应。据世界卫生组织调查,CTRX引起的不良反应在在抗菌素药物中比例偏高[11]。目前测定CTRX的主要方法有毛细血管电泳法、高效液相色谱法、荧光法等[12-16]。
目前,有关ZnS:Mn室温磷光量子点用于生物分子和药物分子等生物活性物质的检测已有很多报道,但该室温磷光量子点与蛋白质偶联并组装成新的纳米复合材料的研究还很少[6,8,17-19]。本文以MPA-Mn/ZnS量子点的羧基基团与BSA所携带的氨基基团连接形成室温磷光纳米复合材料,并将其作为磷光探针用于对CTRX的检测。量子点与BSA偶联后,ZnS:Mn量子点的磷光强度显著增大。CTRX可通过静电作用与量子点-BSA结合产生更多的非辐射中心,从而使量子点的磷光猝灭,由此建立了检测CTRX的高效、灵敏的室温磷光方法。
2 实 验
2.1 实验仪器
样品的形貌采用JEM-2100透射电子显微镜(日本电子)观测。荧光光谱和磷光光谱在Cary Eclipse荧光分光光度计(安里瓦,美国)上进行测定,测试溶液放在四面通石英比色池(1 cm×l cm)中,激发和发射的狭缝宽度分别为10 nm和20 nm。紫外光谱在UV-29100紫外-可见分光光度计(岛津公司,日本)上进行测定。圆二色谱采用J-815圆二色谱仪(日本分光公司)测定。
2.2 实验试剂
实验中使用的所有试剂都是分析纯。Zn(Ac)2· 2H2O、Mn(Ac)2·4H2O、NaS·9H2O购于天津科密欧化学试剂有限公司,3-巯基丙酸(MPA)购于北京百灵威科技有限公司,高纯水(18.2 MΩ·cm)采用WaterPro水纯化系统(Labconco公司,美国)制作,头孢曲松钠(CTRX)购于广西科伦制药公司,牛血清蛋白(BSA)为Sigma公司生产。
2.3 实验方法
图1所示为曲松钠分子结构、MPA包裹的ZnS:Mn量子点结构和ZnS:Mn量子点-BSA检测头孢曲松钠的示意图。
2.3.1 MPA包裹的ZnS:Mn量子点的合成
ZnS:Mn水溶性量子点是在已有的方法基础上做简单的修改后合成的[19]。在250 mL的三口烧瓶中,依次加入50 mL浓度为0.04 mol·L-1的MPA、2 mL浓度为0.01 mol·L-1的Mn(Ac)2和5 mL浓度为0.1 mol·L-1的Zn(Ac)2水溶液,在室温下磁力搅拌,用1 mol·L-1的NaOH调节溶液的pH到11,通氩气饱和30 min,保证MPA与Zn2+和Mn2+在无氧的情况下充分络合。然后,用注射器在隔绝空气的状态下将5 mL浓度为0.1 mol·L-1的Na2S注入到溶液中,继续反应20 min。将得到的溶液在空气中50℃下陈化2 h,得到具有室温磷光性质的MPA包裹的ZnS:Mn量子点。待溶液冷却后加入相同体积的无水乙醇,高速离心后,将上清液倾倒,这样重复用乙醇洗涤3次。产物在室温下真空干燥24 h后,便得到了水溶性良好的MPA包裹的ZnS:Mn量子点粉末。
2.3.2 量子点与BSA的偶联
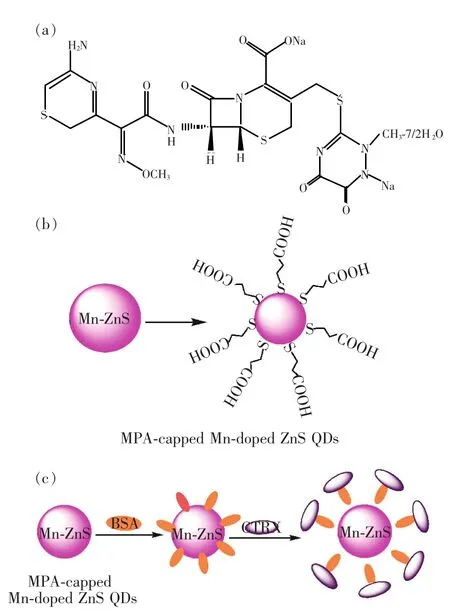
图1 (a)曲松钠分子结构;(b)MPA包裹的ZnS:Mn量子点结构;(c)ZnS:Mn量子点-BSA检测头孢曲松钠示意图。
取10 mL的比色管,依次加入500 μL浓度为0.02 mol·L-1的磷酸缓冲液(PBS)、100 μL浓度为2 mg·mL-1的MPA包裹的ZnS:Mn量子点水溶液,分别加入不同量的1 mg·L-1的BSA溶液,用高纯水定容至5 mL摇匀,在37℃水浴恒温反应不同的时间,冷却至室温。然后进行室温磷光检测,荧光分光光度计选取磷光模式,激发波长为295 nm,激发和发射的狭缝宽度分别为10 nm和20 nm。
2.3.3 基于量子点-BSA的CTRX的室温磷光法检测
取10 mL的比色管,依次加入500 μL浓度为0.02 mol·L-1的磷酸缓冲液(PBS)、100 μL浓度为2 mg·mL-1的MPA包裹的ZnS:Mn量子点水溶液,各加入400 μL浓度为1 mg·mL-1的BSA溶液,在37℃下水浴恒温40 min,冷却至室温,加入不同量的0.15 μmol·L-1头孢曲松钠,用高纯水定容至5 mL摇匀。然后进行室温磷光检测,荧光分光光度计选取磷光模式,激发波长为295 nm,激发和发射的狭缝宽度分别为10 nm和20 nm。
2.3.4 样品预处理
CTRX样品来自标准CTRX注射液(浓度为378 mmol·L-1),将其稀释1 000倍制备成母液,测试时取母液100 μL、浓度为0.02 mol·L-1磷酸缓冲液500 μL和2 mg·mL-1MPA包裹的ZnS:Mn量子点100 μL、1 mg·mL-1的BSA 400 μL,将上述溶液定容至5 mL摇匀进行测试。尿样和血清来自健康志愿者,将其稀释100倍用于检测分析,样品不需要进一步的复杂处理。
3 结果与讨论
3.1 ZnS:Mn量子点的透射电镜图

图2 (a)ZnS:Mn量子点的透射电镜图;(b)ZnS:Mn量子点的发光示意图。
图2(a)为ZnS:Mn量子点的透射电镜图,从图中可以看出这些量子点粒径均匀并呈球形,直径约为3.5 nm。ZnS:Mn量子点的最强激发峰为295 nm,最强发射峰为590 nm。ZnS是一种宽禁带的半导体材料,能为掺杂离子(Mn2+)提供较宽的能级范围。由于Zn2+和Mn2+有相同的价态且离子半径相近,因此Mn2+能较好地掺入到ZnS晶格中,且不会对ZnS的结构产生很大影响。图2(b)为ZnS:Mn量子点的发光原理示意图,可以看到ZnS:Mn量子点有两种发光形式:hv1是源于表面缺陷的以荧光形式发生的辐射;hv2是源于Mn2+的从三重态(4T1)到基态(6A1)的跃迁产生的磷光[19]。
3.2 量子点与BSA的偶合
3.2.1 pH值的影响
酸碱度对ZnS:Mn QDs-BSA复合物磷光强度的影响较大,过酸或者过碱都会破坏量子点复合物的稳定性。从图3可以看出,在7.0~7.5的pH值范围内,ZnS:Mn QDs-BSA体系的发光稳定且发光强度最大。鉴于生理体系的酸碱度,本次实验选择最佳pH值为7.4。
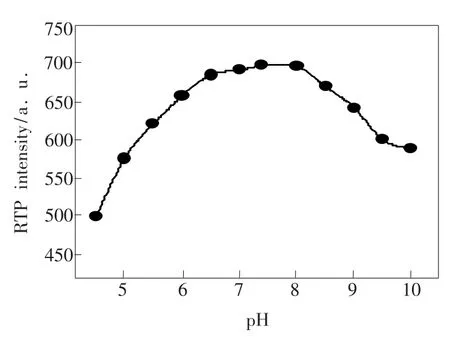
图3 pH值对ZnS:Mn QDs-BSA磷光的影响
3.2.2 BSA浓度对磷光强度的影响
选择pH=7.4的PBS缓冲液,我们考察了不同浓度BSA与ZnS:Mn量子点在37℃恒温水浴40 min后的磷光强度。图4(a)为量子点与BSA偶联的示意图。图4(b)为ZnS:Mn QDs-BSA复合物的发射光谱,可以看到BSA浓度只是对量子点的发光强度有影响,而未改变量子点的发射波长,所有样品的发射波长都为590 nm。图4(c)为BSA浓度对ZnS:Mn量子点发光强度的影响。随着BSA浓度的增大,量子点的磷光强度在0~80 mg·L-1的范围内线性增大,在80 mg·L-1后曲线趋于平缓。随着BSA加入量的增大,它与量子点的偶联亦增加[20],减少了量子点的表面缺陷。而当BSA对量子点表面有限的结合位点偶联平衡(BSA浓度80 mg·L-1)后,量子点的磷光强度变化趋于平缓。80 mg·L-1的BSA与量子点偶联后形成的纳米材料的RTP强度是未偶联量子点的3.35倍。该现象表明,BSA和量子点偶联可形成磷光性质优越的纳米复合材料。

图4 (a)量子点与BSA偶联示意图;(b)不同浓度的BSA与量子点偶联后的发射光谱;(c)不同浓度的BSA与磷光强度的关系。
MPA包裹的ZnS:Mn量子点不仅增加了量子点水溶性,而且使其外端的羧基暴露在量子点表面,同时BSA外端有氨基存在,因此,二者之间可通过共价偶联作用形成ZnS:Mn QDs-BSA纳米复合材料,BSA进一步对量子点表面缺陷进行有效修复,形成了新的电子-空穴中心。另外,BSA中和了量子点表面羧基所带的负电荷,使量子点电负性降低,从而改变量子点周围的化学极性,量子点之间间距减小,库仑力增强,导致量子点周围的局部电场增强,使量子点的激发更加有效[19],发光增强。
3.2.3 不同预热时间对磷光强度的影响
在最佳条件下,我们考察了在37℃预热不同时间的ZnS:Mn QDs-BSA复合物的磷光强度,如图5所示。随着时间的增加,ZnS:Mn QDs-BSA复合物的磷光强度不断增大,40 min后曲线开始趋于平缓。故我们得出ZnS:Mn量子点与BSA在37℃恒温下预热40 min、BSA浓度80 mg·L-1、量子点浓度40 mg·L-1为最优偶合条件。

图5 不同预热时间对量子点-BSA磷光强度的影响
3.3 量子点-BSA作为磷光探针对CTRX的检测
在最佳条件下,向ZnS:Mn QDs-BSA纳米复合物中加入CTRX。从图6可以看出,在一定范围内,随着CTRX浓度的增大,ZnS:Mn QDs-BSA的磷光强度呈现出有规律的猝灭。
实验表明,ZnS:Mn QDs-BSA的磷光猝灭值ΔP与CTRX浓度(C)在一定范围内呈线性关系,如图6(b)所示。其线性关系为ΔP=18.680C+ 37.378(R=0.99),线性范围为0~30 μmol· L-1。11次平行测定的标准偏差的3倍除以标准曲线的斜率计算出检出限(3σ)为0.14 μmol· L-1,相对标准偏差为1.63%。
3.4 量子点-BSA的紫外吸收光谱
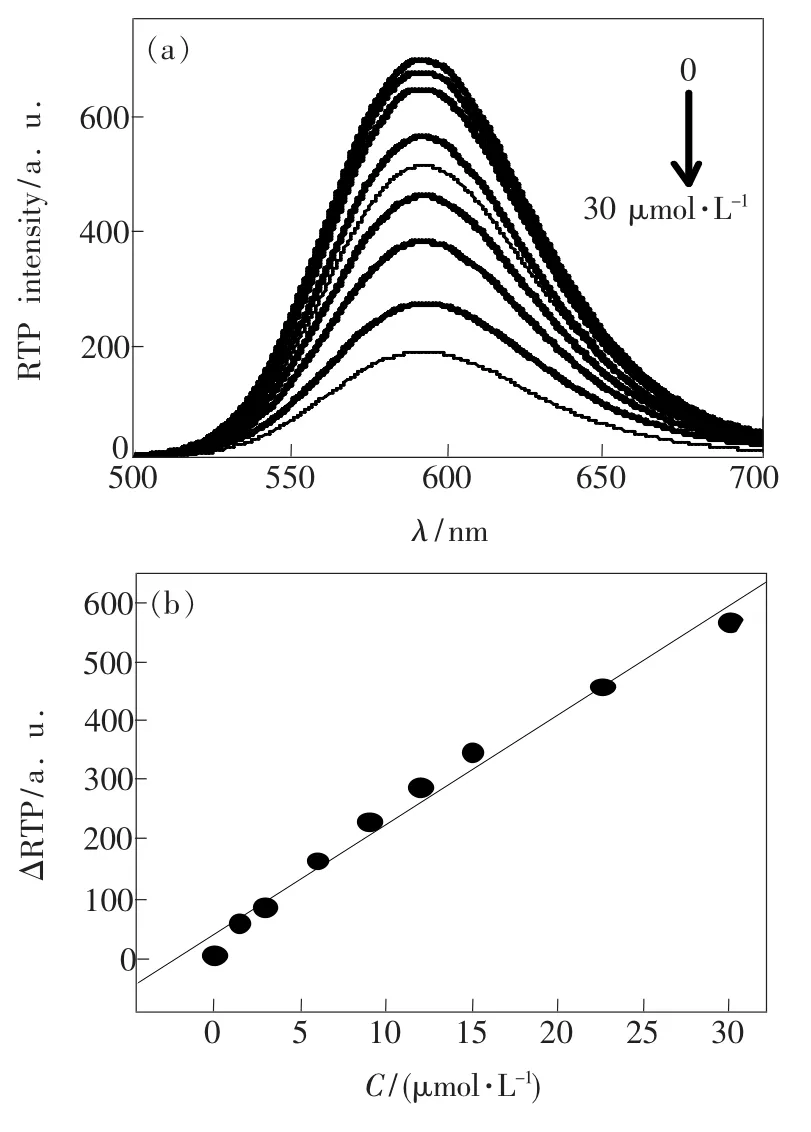
图6 头孢曲松钠对QDs-BSA磷光光谱的影响。(a)不同头孢曲松钠浓度下的QDs-BSA磷光光谱;(b)ΔP vs.C(CTRX)。
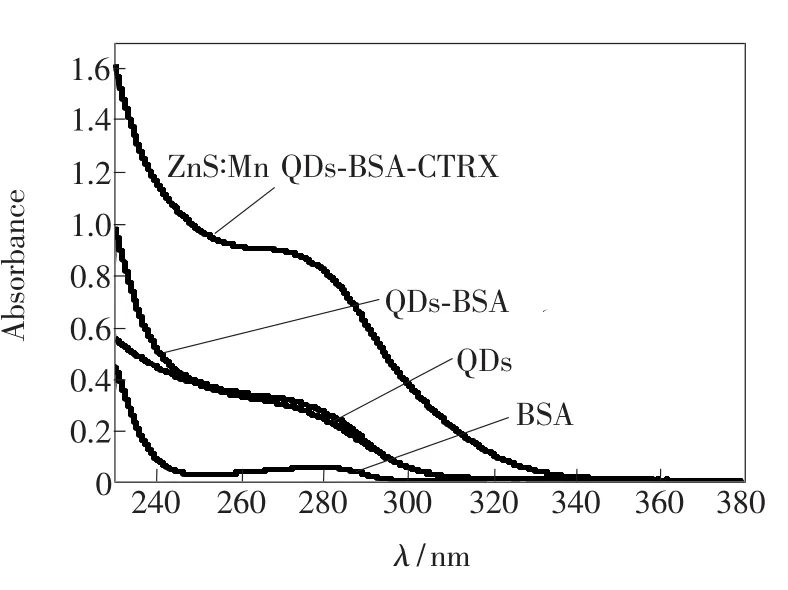
图7 样品的紫外-可见吸收光谱
紫外吸收光谱是研究药物等小分子与血清白蛋白相互作用的常用技术之一。有些小分子化合物与血清白蛋白结合后,其吸收光谱就会发生变化,据此可进一步研究它们之间的作用机理[21]。蛋白质分子中的酪氨酸、苯丙氨酸残基等对紫外光有吸收作用,最大吸收峰在280 nm附近。图7中显示了BSA、ZnS:Mn量子点、ZnS:Mn QDs-BSA以及ZnS:Mn QDs-BSA-CTRX的紫外吸收光谱。可以看出BSA加入后,量子点表面态发生变化,最大吸收峰发生红移。加入CTRX后,ZnS:Mn QDs-BSA的吸收峰明显发生了蓝移,CTRX与量子点-BSA产生强烈的相互作用,产生更多新的非辐射中心,阻碍了量子点的非辐射电子/空穴重组,进而导致量子点的磷光减弱。
3.5 量子点-BSA的共振散射光谱
图8(a)为不同BSA浓度下的ZnS:Mn量子点的共振散射(Resonance light scattering,RLS)光谱。从图中可以发现,随着BSA浓度的不断增大,量子点-BSA的RLS明显增强,但波形并没有发生明显改变。图8(b)为ZnS:Mn量子点、ZnS: Mn QDs-BSA、ZnS:Mn QDs-BSA-CTRX的共振散射光谱,从中可观察到加入CTRX后波形发生了改变,波峰的增大更加显著,由此说明CTRX没有使BSA从量子点脱离,而是与量子点-BSA复合物进一步结合,包覆到了量子点-BSA复合物表面,使量子点-BSA复合物粒径进一步增大。
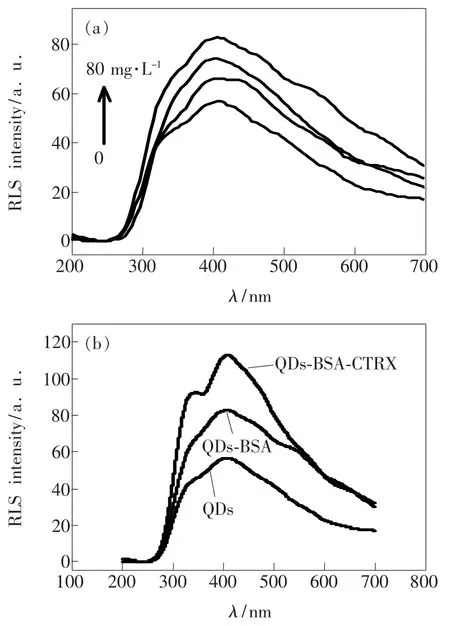
图8 (a)不同BSA浓度下的ZnS:Mn量子点的共振散射光谱;(b)ZnS:Mn QDs、ZnS:Mn QDs-BSA以及ZnS:Mn QDs-BSA-CTRX的共振散射光谱。
3.6 圆二色谱
在研究蛋白质结构和检测其结构变化方面,圆二色光谱(Circular dichroism,CD)是最灵敏和强有力的实验方法。微环境变化会对蛋白质一些色团的吸光性质产生显著影响,从而引起蛋白质的分子构象发生变化[22]。图9是BSA在ZnS: Mn量子点及CTRX作用下的远紫外区(180~280 nm)CD光谱。从图中可以看出,BSA在190~200 nm附近有一个正峰,在208 nm和222 nm处有两个负的特征肩峰。加入量子点对BSA的结构影响微小。但加入CTRX后,CD谱变化显著,在208 nm附近纯BSA的负峰红移,α-螺旋及β-折叠发生了明显结构改变。BSA与量子点和CTRX的作用不一样。BSA与量子点以共价键结合,而BSA与CTRX的结合可能为静电作用[20],使BSA内部电荷分布发生变化,维系其螺旋结构的氢键改变方向,从而影响了量子点-BSA的表面结构,形成新的非辐射中心,使磷光强度发生了明显变化。

图9 BSA在ZnS:Mn量子点及CTRX作用下的圆二色光谱
3.7 样品检测
3.7.1 对注射药物的检测
以ZnS:Mn QDs-BSA为探针,对标示量为10%的CTRX注射液中曲松钠的含量进行检测。测试液(超纯水稀释液)的5次实验平均检出值为(17.9±0.8)μmol·L-1,其结果与标示量(18.9 μmol·L-1)基本一致,相对标准偏差为1.97%,表明该方法的精密度较好。
3.7.2 对体液的检测

表1 血液和尿液中CTRX的检测Table 1 Detection of CTRX in urine and serum samples
在优化条件下,将尿样和血清样品稀释100倍,加标测定尿样和血清样品中CTRX的含量。实验结果显示,样品的回收率为97%~102%,相对标准偏差为2.58%,如表1所示。
3.8 共存物质的干扰
在头孢曲松钠浓度为5 μmol·L-1时,我们考察了样品中常见的几种生物体液中的金属离子、生物分子和其他类型的抗生素对该方法检测CTRX的干扰情况,如表2所示。Na+、K+、Mg2+、Ca2+等常见的金属离子,L-半胱氨酸、L-色氨酸、丝氨酸、L-组氨酸等常见的氨基酸,主要的糖类化合物即使在很高的浓度下也不会对CTRX的磷光检测产生干扰;而一些其他的抗生素药物,如氨苄西林钠、头孢替唑、苯唑西林,分别在50,30,100 μmol·L-1浓度下对CTRX的检测没有干扰。

表2 共存物质对CTRX检测的影响Table 2 Effect of coexisting substances on the detection of CTRX
4 结 论
以3-巯基丙酸为稳定剂水相合成了ZnS:Mn量子点,并与BSA偶联自组装成新型纳米复合材料,使ZnS:Mn量子点的磷光得到增强。CTRX加入后,通过静电作用与量子点-BSA结合产生更多的非辐射中心,从而使其磷光逐渐猝灭,由此建立了检测CTRX的高效、灵敏的室温磷光方法,线性范围为0~30 μmol·L-1,相关系数R=0.99,检出限为0.14 μmol·L-1。该方法不需要复杂的样品预处理,有效地避免了自体荧光和散射的干扰,是一种简单、快速、灵敏和高选择性的CTRX检测方法。
[1]Miao Y M,Zhang Z F,Gong Y,et al.Phosphorescent quantum dots/doxorubicin nanohybrids based on photoinduced electron transfer for detection of DNA[J].Biosens.Bioelectron.,2014,59(15):300-306.
[2]Tang N Y.Effect of strain on formation of antibonding hole ground states in InAs quantum dots[J].Opt.Precision Eng.(光学精密工程),2013,21(6):1472-1478(in Chinese).
[3]Chen S H,Greeff A P,Swart H C.A comparative study between the simulated and measured cathodoluminescence generated in ZnS:Cu,Al,Au phosphor powder[J].J.Lumin.,2005,113:191-198.
[4]Qin J J,Cao L X,Liu W,et al.ZnS:Mn/SiO2quantum dots modified with PVP as fluorescent sensor for Pb2+ions in sea water[J].Chin.J.Lumin.(发光学报),2014,35(7):858-865(in Chinese).
[5]Zhang P F,Song J,Chen J,et al.Study on conjugation of quantum dot with anti-hepatitis B surface antigen antibody[J]. Chin.J.Anal.Chem.(分析化学),2013,41(6):846-850(in Chinese).
[6]Du H Y,Wei Z P,Li S,et al.Luminescent properties of surface modified ZnS:Mn quantum dot and detection of biological molecules[J].Chin.J.Lumin.(发光学报),2013,34(4):421-426(in Chinese).
[7]Xie H Y,Pang D W.Preparation and application of quantum dot research progress in biological detection[J].Chin.J. Anal.Chem.(分析化学),2004,32(8):1099-1103(in Chinese).
[8]Chen J,Sun J F,Guo L,et al.Mn-doped ZnS QDs at room temperature phosphorescence detection of lead ions[J]. Chin.J.Anal.Chem.(分析化学),2012,40(11):1680-1685(in Chinese).
[9]Huang B X,Kim H Y.Probing three-dimensional structure of bovine serum albumin by chemical cross-linking and mass spectrometry[J].J.Am.Soc.Mass Spectrom.,2004,15(8):1237-1247.
[10]Zhang Y F,Wang J Z,Wang C Y,et al.Determination of ceftriaxone with fluorescence method[J].Herald Med.(医药导报),2007,26(3):296-297(in Chinese).
[11]Li C S.Adverse reactions ceftriaxone[J].J.Physiol.Sci.(四川生理科学杂志),2009,31(2):85-87(in Chinese).
[12]Woodfield J C,Van Rij A M,Pettigrew R A,et al.A comparison of the prophylactic efficacy of ceftriaxone and cefotaxime in abdominal surgery[J].Am.Surg.,2003,185(1):45-49.
[13]Liu Y,Yang S X.Determination of ceftriaxone sodium/tazobactam sodium for injection by HPLC[J].Chin.Pharm.J.(中国药学杂志),2005,40(20):1584-1586(in Chinese).
[14]Tu L,Hu C Q.Ceftriaxone capillary electrophoresis assay and related substances content[J].Chin.Pharm.Anal.(药物分析杂志),2005,25(3):303-307(in Chinese).
[l5]Liu B,Wang J Z,Man Y.Ceftriaxone flow injection chemiluminescence inhibition assay[J].J.Instrum.Anal.(分析测试学报),2003,22(4):45-47(in Chinese).
[16]Shi Z Z,Wang F L,Wang J Z.Determination of drug content in ceftriaxone single sweep polarography[J].Phys.Testing Chem.Anal.,Part B:Chem.Anal.(理化检验(化学分册)),2006,42(5):329-333(in Chinese).
[17]Costa-Fernández J M,Pereiro R,Sanz-Medel A.The use of luminescent quantum dots for optical sensing[J].Anal. Chem.,2006,25(3):207-218.
[18]Miao Y M,Zhang Z F,Gong Y,et al.Self-assembly of manganese doped zinc sulfide quantum dots/CTAB nanohybrids for detection of rutin[J].Biosens.Bioelectron.,2014,52:271-276.
[19]He Y,Wang H F,Yan X P.Self-assembly of Mn-doped ZnS quantum dots/octa(3-aminopropyl)octasilsequioxane octahydrochloride nanohybrids for optosensing DNA[J].Chem.—Eur.J.,2009,15(22):5436-5440.
[20]Zhang A M,Yan W,Wang H S.Interactions of proteins with CdTe/CdS quantum dots ceftriaxone[J].Chin.J.Anal. Chem.(分析化学),2014,36(4):444-448(in Chinese).
[21]Wang G,Wang D,Li X,et al.Exploring the binding mechanism of dihydropyrimidinones tohuman serum albumin:Spectroscopic and molecular modeling techniques[J].Colloids Surf.B:Biointerf.,2011,84(1):272-279.
[22]Shen X C,Liang H,He X W.Circular dichroism spectroscopy and protein conformation of progress[J].Chin.J.Anal. Chem.(分析化学),2004,32(3):388-394(in English).

杨茂青(1989-),男,山西晋城人,硕士研究生,2013年于山西师范大学获得学士学位,主要从事生物分子化学方面的研究。
E-mial:yangmaoqing0503@.com

闫桂琴(1956-),女,山西临猗人,教授,博士生导师,2001年于西北大学获得博士学位,主要从事植物分子生物学及生物分子化学等方面的研究。
E-mial:gqyan@126.com
Detection of Ceftriaxone Based on ZnS:Mn Quantum Dots-BSA Nanohybrids
YANG Mao-qing,MIAO Yan-ming,YAN Gui-qin*
(College of Life Science,Shanxi Normal University,Linfen 041000,China)
*Corresponding Author,E-mail:gqyan@126.com
Using 3-mercaptopropionic acid(MPA)as the stabilizer,ZnS:Mn quantum dots(QDs)were synthesized via water phase method,which could emit strong phosphorescence at room temperature.Bovine serum albumin(BSA)can effectively recover the defect on the surface of ZnS:Mn QDs,so the phosphorescence intensity of ZnS:Mn QDs can be enhanced after the conjugation between BSA and ZnS:Mn QDs.Ceftriaxone sodium can obviously quench the phosphorescence of ZnS:Mn QDs-BSA,and the quenched phosphorescence intensity amount(△P)is linearly proportional to the concentration of ceftriaxone sodium with the correlation coefficient R=0.99.The optimal condition of conjunction between ZnS:Mn QDs and BSA is as following:pH=7.4,reaction temperature of 37℃,response time of 40 min,BSA concentration of 80 mg·L-1,ZnS:Mn QDs concentration of 40 mg·L-1,respectively.As the phosphorescence probe,the synthesized ZnS:Mn QDs-BSA can detect ceftriaxone sodium effectively with the linear scope of 0-30 μmol·L-1,correlation coefficient R=0.99,inspection limit of 0.14 μmol·L-1,relative standard deviation of 1.63%,respectively.
quantum dots;bovine serum albumin;phosphorescence probe;ceftriaxone
O482.31;O657
A DOI:10.3788/fgxb20153604.0472
2015-01-28;
2015-02-22
山西省重点化学优势学科建设项目(912019);国家教育部博士点联合基金(20111404110002)资助项目

