苦瓜提取物抗氧化及抑制淀粉酶协同作用研究
邱韵,何庆峰,林妙玲,刘玥,赵俊旭,张湘汮
(天津农学院食品科学系,天津300384)
苦瓜提取物抗氧化及抑制淀粉酶协同作用研究
邱韵,何庆峰*,林妙玲,刘玥,赵俊旭,张湘汮
(天津农学院食品科学系,天津300384)
通过析因设计研究不同溶剂苦瓜提取物的协同作用,为苦瓜功能保健食品的开发提供参考。以邻二氮菲-Fe2+氧化法抗氧化试验及α-淀粉酶的抑制试验研究苦瓜醇提物和水提物的剂量-反应关系,并进行3×3析因设计,通过析因分析研究苦瓜醇提物与水提物的协同作用。结果表明苦瓜的醇提物和水提物在抗氧化及α-淀粉酶抑制作用方面存在协同作用。协同抗氧化效果最好组合是水提物0.2 mg/mL,醇提物0.15 mg/mL;协同抑制α-淀粉酶效果最好的组合是水提物40 mg/mL,醇提物30 mg/mL。
苦瓜提取物;析因分析;协同作用;抗氧化;α-淀粉酶
苦瓜(Momordica charantiaL.)是一种药食同源的植物,具有清热解毒、抗肿瘤、提高免疫功能等多种作用[1-3]。近年来,苦瓜在糖尿病中的预防和辅助调节作用也被国内外学者广泛研究[4-6]。多项研究结果表明,不同溶剂苦瓜提取物可以通过多种途径辅助降血糖,其中,抗氧化及抑制α-淀粉酶是苦瓜调节血糖作用的主要途径[7-9]。不同溶剂的苦瓜提取物在抗氧化及抑制α-淀粉酶方面是否具有协同作用尚未见报道。本试验在以往研究的基础上,采用析因设计研究苦瓜水提物及醇提物抗氧化及抑制α-淀粉酶的协同作用,为苦瓜调节血糖研究及苦瓜功能食品的开发提供参考。
1材料与方法
1.1材料与试剂
苦瓜:红旗农贸市场(产自山东寿光);菲罗啉(分析纯):天津奥滨医科医药销售有限公司;双氧水(分析纯):天津市北方天医化学试剂厂;α-淀粉酶:天津市明川试剂有限公司;Trolox:Sigma公司。
1.2仪器与设备
WFJ7200型可见分光光度计:龙尼柯(上海)仪器有限公司;ELx800型酶标仪:深圳安捷仪器有限公司;HWS28型电热恒温水浴锅:上海—恒科科技有限公司;JA2003电子天平:上海舜宇恒平科学仪器有限公司。
1.2方法
1.2.1苦瓜提取物的制备
1.2.1.1苦瓜水提物
提取工艺条件为:料水比(g/mL)1∶10、温度为100℃、浸提时间为60 min、浸提3次共3 h。浸提液离心,旋转蒸发浓缩,冷冻干燥备用。
1.2.1.2苦瓜醇提物
提取工艺条件为:60%的乙醇,70℃浸提2 h。反复提取3次,过滤,收集滤液,旋转蒸发浓缩,冷冻干燥备用。
1.2.2抗氧化的测定
醇提物及水提物受试浓度为:0.01、0.025、0.05、0.1、0.15 mg/mL。抗氧化能力的测定方法如表1。
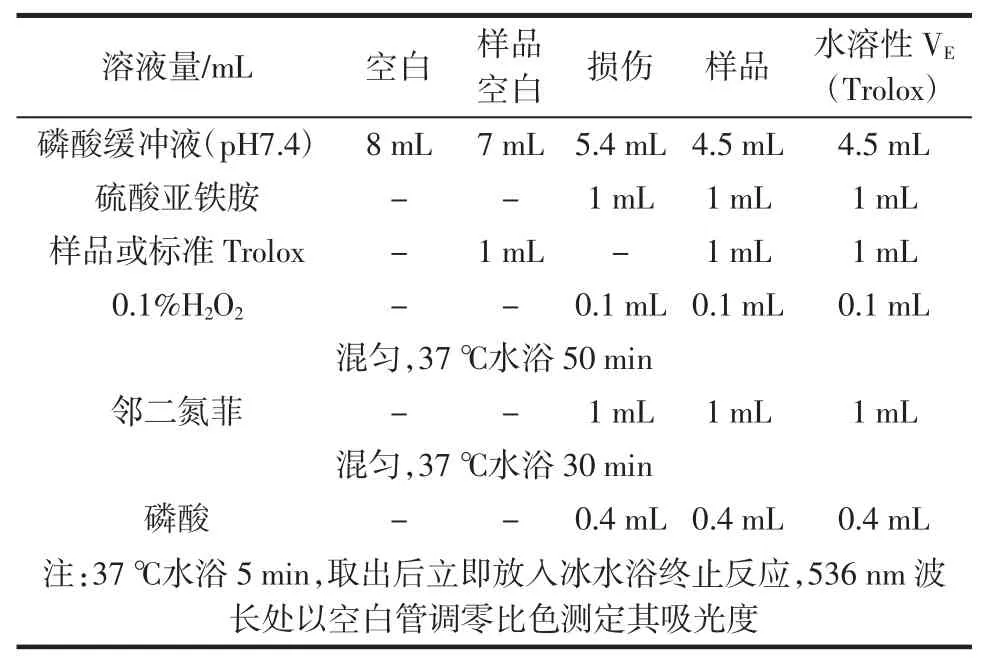
表1 抗氧化能力的测定方法Table 1Method of antioxidant capacity determination
抗氧化能力值=[(A样品-A样品空白-A损伤)/(ATrolox-A损伤)]×(mTrolox/m样品),式中:A样品为样品管吸光度;A样品空白为样品空白管吸光度;ATrolox为标准管吸光度;A损伤为损伤管吸光度;mTrolox为标准管所含Trolox的μmol数;m样品为标准管所含样品的质量[10]。
1.2.3α-淀粉酶抑制试验
醇提物及水提物受试浓度为:10、20、30、40、50、60、70、80、90、100 mg/mL。反应体系如表2。

表2 α-淀粉酶活性抑制反应体系Table 2α-amylase activity inhibition test
α-淀粉酶抑制率(%)=(1-A0/A1)×100,A0=A2-A3;式中:A1、A2、A3分别为540 nm处空白对照、抑制剂管和背景对照的吸光值。以抑制剂浓度为横坐标,抑制率为纵坐标,绘制抑制曲线[11-12]。
1.3统计分析
将数据整理后,输入SPSS13.0,采用3×3析因分析过程,以主效应项考察各因素的单独效应,以交互作用项考察各因素的协同作用,以0.05作为显著性差异标准。
2结果
2.1苦瓜提取物抗氧化作用的协同性分析
2.1.1抗氧化作用剂量-反应关系
抗氧化作用剂量-反应关系见图1。

图1 苦瓜提取物抗氧化值剂量-效应关系图Fig.1Dose-effect relationship of bitter melon extracts antioxidant value
图1可以看出,苦瓜醇提物和水提物具有一定的抗氧化作用,且随着剂量的增加抗氧化能力增强,有剂量依赖性,且趋势趋于平缓。在本次试验中,醇提物最佳抗氧化浓度为0.1、0.15、0.2 g/L;水提物最佳抗氧化浓度为0.1、0.15、0.2 g/L。
2.1.2苦瓜醇提物及水提物抗氧化作用协同作用分析苦瓜醇提物及水提物抗氧化作用协同作用分析
见表3,表4。

表3 苦瓜提取物抗氧化值析因试验设计(n=3,μmol/g)Table 3Interaction analysis of bitter melon extracts antioxidant value
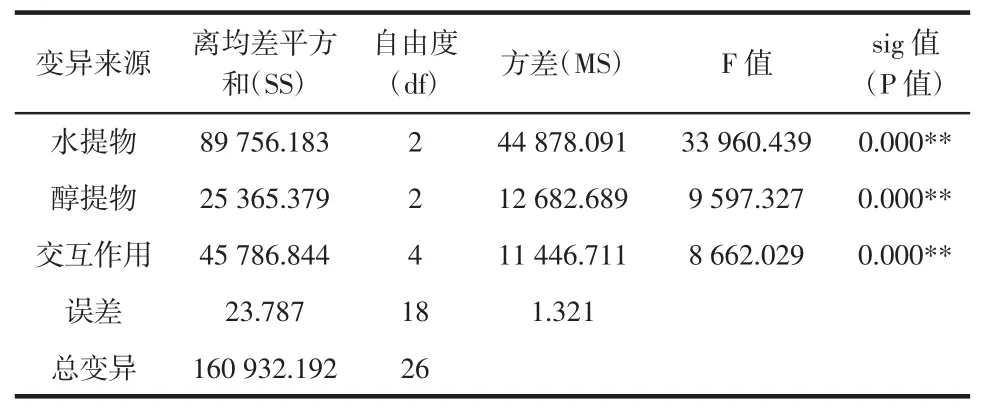
表4 抗氧化作用析因设计方差分析表Table 4Varianc of antioxidant factorial design
由表4可以看出,总变异分解为主效应、交互作用及随机误差项。主效应中,醇提物及水提物均有统计学差异,说明醇提物及水提物确实具有抗氧化效用。交互作用项具有统计学差异(P<0.01),提示醇提物与水提取确实存在着交互作用,即两种物质的抗氧化具有协同作用。从表3可以看出,协同抗氧化效果最好的组合是A2B3,即水提物0.2 g/L,醇提物0.15 g/L。
2.2苦瓜提取物对于α-淀粉酶的抑制试验结果
2.2.1α-淀粉酶的抑制作用剂量-反应关系
α-淀粉酶的抑制作用剂量-反应关系见图2。
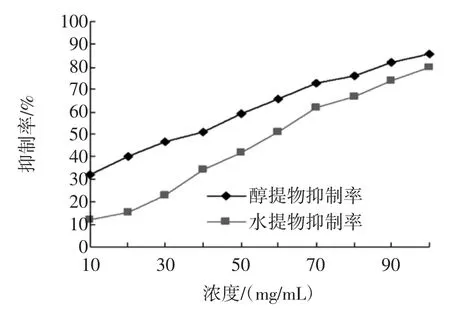
图2 苦瓜提取物α-淀粉酶抑制率剂量-效应关系Fig.2Dose-response relationship of bitter melon extract on αamylase inhibition
由图2可以看出,醇提物和水提物具有一定的α-淀粉酶的抑制作用,且随着剂量的增加抑制能力增强。在本次试验中,醇提物最佳α-淀粉酶的抑制作用浓度为80、90、100 mg/mL;水提物α-淀粉酶的抑制作用浓度为80、90、100 mg/mL。
2.2.2α-淀粉酶的抑制作用协同作用分析
α-淀粉酶的抑制作用剂量-反应关系见表5,表6。
由表6可以看出,总变异分解为主效应、交互作用及随机误差项。主效应中,醇提物及水提物均有统计学差异,说明醇提物及水提物确实具有α-淀粉酶抑制作用。交互作用项具有统计学差异(P<0.01),提示醇提物与水提取确实存在着交互作用,即两种物质的α-淀粉酶抑制作用具有协同作用。从表5可以看出,协同抑制α-淀粉酶效果最好的组合是水提物40 mg/mL,醇提物30 mg/mL。
3讨论

表5 苦瓜提取物对α-淀粉酶抑制作用析因设计试验(n=3,%)Table 5Factorial design experiment of bitter melon extracts on α-amylase inhibitory

表6 苦瓜提取物对α-淀粉酶抑制作用析因设计方差分析表Table 6Factorial design variance of bitter melon extracts on αamylase inhibitory
协同作用是指多种处理因素产生的综合效应中,不能用各试验因素解释的部分。目前,关于协同作用的研究方法很多,在功能性食品配方的研发中,较常用的方法是正交试验设计,但正交试验虽然能减少试验次数寻找最佳配方,但忽略了试验因素间的交互作用。而析因试验实际是多种试验因素的全面组合,不仅能考察各种组合的效果,还能分析各试验因素间的协同作用[13]。近年来的研究表明,不同植物提取物间存在协同作用,功能保健食品的功效是多种活性成分协同作用的结果,天然植物提取物的协同作用研究逐渐成为保健食品领域关注的热点。苦瓜中有多种功能成分,具有降糖及抗氧化功效[14],但不同苦瓜提取物间的协同作用尚不清楚。因此,本研究以析因试验设计研究了两种不同的苦瓜提取物在抗氧化及α-淀粉酶抑制作用的协同性,为苦瓜降糖作用研究提供参考。
苦瓜醇提物和水提物的抗氧化作用是随着浓度参考文献:
的增加而增强的,但是两者的交互作用并非是浓度最强组合(A3B3)抗氧化作用最强,而是(A2B3)效果最强。苦瓜醇提物和水提物的α-淀粉酶抑制作用是随着浓度的增加而增大的,但是两者的交互作用也并非是浓度最强的组合(C3D3),而是浓度最小的组合(C1D1),这种交互作用的具体机理还需要进一步研究。
[1]耿丽晶,周围.苦瓜皂苷的提取方法及其生理功能的研究进展[J].中国酿造,2009(7):448-450
[2]陈敬鑫,张子沛,罗金凤,等.苦瓜保健功能的研究进展[J].食品科学,2012,33(1):271-275
[3]刘苇芬.苦瓜抗氧化活性物质的初步鉴定[J].食品研究与开发,2012,8(33):72-73
[4]张美萍,叶淑红,王际辉,等.苦瓜籽蛋白的提取条件及其抗氧化性质[J].大连工业大学学报,2013,1(32):4-7
[5]黄龙,邓媛元,张名位,等.不同苦瓜品种果肉中酚类物质含量及抗氧化能力比较[J].中国农业科学,2011,44(22):4660-4668
[6]陈红漫,李寒雪,阚国仕,等.苦瓜多糖的抗氧化活性与降血糖作用相关性研究[J].食品工业科技,2012,33(18):349-354
[7]王步江,王瑞,张平平,等.苦瓜皂苷的制备及体外抗氧化活性研究[J].中国食品添加剂,2011(5):153-157
[8]陈林,冯天艳,谢瑜,等.苦瓜根提取物对α-葡萄糖苷酶的抑制作用研究[J].中国药师,2011,3(14):634-636
[9]王琪,邓媛元,张名位,等.苦瓜皂苷和多糖的连续提取工艺及其对α-葡萄糖苷酶的抑制作用[J].中国农业科学,2011,44(19): 4058-4065
[10]刘薇,王宏君,赵健,等.邻二氮菲-Fe2+法测定保健食品的抗氧化能力[J].食品科学,2010,31(18):333-337
[11]张冬英,余霜,黄业伟,等.普洱茶对α-淀粉酶抑制作用的影响研究[J].食品工业科技,2009,30(2):77-79
[12]莫丽春,陈丽娟,吴月霖,等.四种天然产物对α-淀粉酶抑制作用研究[J].食品科技,2012,37(3):85-88
[13]谭旭辉,钱俊,陈平雁,等.析因设计资料的单独效应分析[J].中国卫生统计,2007,24(4):378-382
[14]刘筱,徐济良,邵政一,等.苦瓜降血糖作用研究进展[J].南通大学学报(医版),2006,26(2):140-150
Study of Synergy Effect of Different Bitter Melon Extracts on Activities of Antioxidant and Inhibition of Amylase through Factorial Design
QIU Yun,HE Qing-feng*,LIN Miao-ling,LIU Yue,ZHAO Jun-xu,ZHANG Xiang-jun
(Department of Food Science,Tianjin Agricultural University,Tianjin 300384,China)
The aim of this experiment was to study the synergies of different solvents extracts derived from bitter melon by factorial design and to provide reference for the development of functional foods bitter gourd. Antioxidant and α-amylase inhibition capacity of the bitter alcohol extract and aqueous extract were detected by phenanthroline-Fe2+oxidation assay and α-amylase inhibition experiments in this study.Hypoglycemic effect was explored by statistical analysis of factorial design.The results showed that alcohol extract and aqueous extract had synergies effects on antioxidant and α-amylase inhibition activity.Best combination of synergistic antioxidant effect was 0.2 mg/mL aqueous extract,0.15 mg/mL alcohol extract.The best combination on αamylase inhibition was 40 mg/mL aqueous extract,30 mg/mL alcohol extract.
bitter melon extracts;factorial design;synergies;antioxidant;α-amylase
10.3969/j.issn.1005-6521.2015.14.001
2014-03-10
国家级大学生创新创业训练计划项目(201410061029)
邱韵(1994—),女(汉),本科,研究方向:食品质量与安全。
何庆峰(1979—),男(汉),讲师,硕士,研究方向:食品营养与安全。

