17β-雌二醇对斑马鱼性别分化的影响
李国超 余凯敏 冯为民 刘丽丽 张家禹 闫艳春
(中国农业科学院研究生院,北京 100081)
17β-雌二醇对斑马鱼性别分化的影响
李国超 余凯敏 冯为民 刘丽丽 张家禹 闫艳春
(中国农业科学院研究生院,北京 100081)
有报道表明,经17β-雌二醇(17β-estradiol,E2)处理后,斑马鱼种群中雌性比例上升。为了研究E2雌性化作用的机制,选取一系列斑马鱼体内与性别分化有关的基因(brca2,sox9a,sox9b,dmrt1和 cyp19a1a),采用qRT-PCR分析它们在不同的处理条件下表达水平的变化。结果表明,E2能上调雌性相关基因(brca2、sox9b)的表达,下调部分雄性相关基因(sox9a)的表达,对不同发育阶段的斑马鱼体内的性激素转化通路(cyp19a1a)的影响不同。
环境内分泌干扰物;17β-雌二醇;斑马鱼;性别分化
环境中的多种化合物(包括农药[1]、工业化学物[2]和植物激素[3]等)在进入生物体内后,能干扰正常激素的代谢过程,从而干扰内分泌系统的正常功能,对生物的健康造成危害,这类化学物质统称为内分泌干扰物(Endocrine disrupting chemicals,EDCs),其效应以雌激素效应为主。在众多EDCs中,17β-雌二醇(17β-Estrodiol,E2)占主要地位[4,5],其环境浓度范围为0-141 ng/L[6-8]。已有研究从表型上证明E2能促进斑马鱼发育成雌性[9]。
斑马鱼属硬骨鱼类,鲤科(Cyprinidae)鲐属(Danio),是一种小型热带淡水鱼。成鱼体长4-5 cm,3个月可达性成熟。斑马鱼基因与人类基因的相似度达到 87%。作为模式动物,斑马鱼具有繁殖率高、体外受精、遗传背景清晰等优点,已经被广泛用于药物研发[10]、人类疾病研究[11]和环境毒理学[12,13]等领域。其转基因品系也被逐一建立[14]。
与人、小鼠和鸟类不同,斑马鱼的性别不是由XY/XX或ZZ/ZW机制决定的[15-17]。目前,人们只知道斑马鱼的性别分化发生在受精后21 d到42 d(21-42 dpf)[9],此时性别分化相关基因的表达水平也分别达到高峰[18]。这些基因包括:乳腺癌易感基因2(brca2)、SRY相关基因a(sox9a)、SRY相关基因b(sox9b)、存在于双性且mab-3相关的转录因子1(dmrt1)和细胞色素P450,家族19,亚家族a,多肽1a(cyp19a1a)。其中与斑马鱼发育为雌性相关的基因是brca2[19,20]、sox9b[21,22],与发育为雄性相关的基因是sox9a[21-23]、dmrt1[18,24-27],而cyp-19a1a编码的蛋白可将雄激素转化为雌激素,平衡鱼体内性激素的比例[21,28,29]。上述基因中,除纯合缺失brca2的斑马鱼会全部发育为雄性以外[19,20],其他基因都不能单独决定斑马鱼的性别。因此推测斑马鱼的性别分化是由一个复杂的信号网络负责调控的,以上基因都属于这个网络[16]。
本研究以脊椎动物斑马鱼为材料,采用实时定量PCR(Quantitative real-time polymerase chain reaction,qRT-PCR)的方法,从转录水平对E2促进斑马鱼发育成雌性的机制进行探究,填补EDCs影响性别分化机制的数据短缺。为进一步探究斑马鱼的性别决定机制以及EDCs在其中的影响提供数据和线索,也为完善EDCs的评估标准提供理论依据。
1 材料与方法
1.1 材料
AB 品系斑马鱼由北京大学张博实验室惠赠。
1.1.1 试剂 17β-雌二醇(17β-Estrodiol,E2)购自Sigma-Aldrich公司(CAS 50-28-2)。
E2暴露实验A处理液:6 mg E2溶于1 mL无水乙醇中,再将其溶于1 L培养液(已除氯,pH7.0-7.5,含0.6 g/L NaCl,电导率500 μs/cm),制成6 mg/L E2储液。用培养液依次将其稀释成1、2、2.5、3、4、5和6 mg/L的梯度浓度E2溶液。用培养液稀释无水乙醇至乙醇终浓度为0.1%,作为对照组的培养液,即0 mg/L E2溶液。
E2暴露实验B处理液:1 mg E2溶于1 mL无水乙醇中,再将其溶于1 L培养液中,制成1 mg/L E2储液。用培养液和1 L容量瓶将100 mL储液稀释10倍,重复4次得10 ng/L E2溶液。最后用培养液稀释无水乙醇至乙醇终浓度为0.000 001%,作为对照组的培养液,即0 ng/L E2溶液。
总RNA提取:使用TRIzol试剂盒(TaKaRa)。
cDNA的获得:使用反转录试剂盒 PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa)。
qRT-PCR:使用SYBR Premix Ex Taq II试剂盒(TaKaRa)及其PCR体系。
1.1.2 仪器 斑马鱼独立养殖系统(北京爱生)、生化培养箱、液氮罐、-80℃冰箱、显微镜(Olympus BX63)、链式聚合酶扩增(PCR)仪(Bio-Rad)、凝胶成像系统(Gene Company Limited)、iQ5 多彩RTPCR检测系统(Bio-Rad)。
1.2 方法
1.2.1 斑马鱼养殖 使用独立养殖设备(北京爱生),对斑马鱼进行规范化的饲养。培养液的电导率为 500-550 μs/cm,pH为 7.0-7.5。鱼房的温度恒定(27±2℃),光周期恒定(14 h光/10 h暗)。受精后5 d(5 dpf)可喂食草履虫。13 dpf 后,逐渐喂食新鲜丰年虾,每天喂食2次。根据斑马鱼的发育大小及浓度进行适量喂养。
1.2.2 斑马鱼繁殖 将40条性成熟的斑马鱼成对放入孵化盒中(1条雄鱼和1条雌鱼/盒),用隔板分开。次日上午抽掉隔板,10 min 后斑马鱼开始产卵,30 min 后进行胚胎的收集,放于 28℃的培养箱中。受精后10 h(10 hpf),选择健康、发育一致的胚胎,饲养至合适的发育阶段后,可用于E2的暴露实验。
1.2.3 雌二醇暴露实验A 对于0、1、2、2.5、3、4、5和6 mg/L这个梯度中的每一个E2浓度,设置3个培养皿作为平行,每个培养皿中放 50 个10 hpf胚胎,接受相同浓度的E2处理。每24 h 更换溶液,并及时去除死卵,处理96 h,分别随机收集25条幼鱼,各自作为一个样本。用液氮冷冻,-80℃下保存。重复本实验3次,每个E2浓度都得到9个样本,每个样本含25条幼鱼。
1.2.4 雌二醇暴露实验B 用0 ng/L和10 ng/L E2分别处理3组平行的10 hpf斑马鱼胚胎(每组100个胚胎)。期间,在暴露时长为40、50、60、96、9、10和11 d时,统计斑马鱼的孵化率、存活率、畸形率。该实验重复3次。
用0 ng/L和10 ng/L E2分别处理:3组10 hpf斑马鱼胚胎(每组50个胚胎),3组21 dpf的斑马鱼(每组50条),3组健康成年雄鱼(大于6月龄,每组1条),3组健康成年雌鱼(大于6月龄,每组1条),处理时长为9 d。处理完成后,用液氮冷冻并拍摄各组鱼的照片。之后,分别收集各组平行中幼年、青年鱼的全身,并解剖成鱼,获得卵巢和精巢。将其各自作为一个样本,用液氮冷冻,保存在-80℃下。重复本实验3次,这样对于两个浓度的E2溶液处理下的每个发育阶段,都得到9个样本。
1.2.5 qRT-PCR 设计每个性别分化相关基因和内参基因β-actin的引物,送交上海生工公司合成(表1)。经PCR预实验知:在退火温度为57℃时,能够获得清晰的特异性目的条带。用在E2暴露实验A和暴露实验B中获得的斑马鱼和性腺,分别提取总RNA,反转录得到cDNA。采用qRT-PCR试剂盒说明书中的PCR体系。qRT-PCR程序为:95℃预变性30 s,40个循环(95℃下5 s,57℃下30 s),10℃下20 min。用各基因的引物分别做qRT-PCR。用2-△△CT法分析这些结果[30]。

表1 qRT-PCR引物
1.2.6 统计分析 用Bartlett检验和Levene检验,对原始数据进行标准化,并检测标准化后数据的方差齐性。用单因素方差分析和Duncan法多重比较检验组间差异。所有的统计分析由SPSS 19.0(美国SPSS公司)和R[31]两个软件进行。除图3以外,所有图均用Origin 7.0绘制(美国Origin实验室)。
2 结果
2.1 E2暴露实验A
以10 hpf为处理起点,设置一系列E2溶液浓度梯度,分析E2处理96 h后斑马鱼体内性别分化相关基因的表达水平。结果发现,经4 、5和6 mg/L E2处理96 h后,斑马鱼胚胎全部死亡并腐烂,无法收集样本,因而没有绘出其结果(图1)。其他浓度的实验结果表明,经E2处理96 h后,brca2的表达水平随E2的浓度上升而呈上升趋势,最终在3 mg/L E2处理后,其表达水平呈显著上调(P<0.05)(图1-A)。sox9b表达水平的变化趋势与brca2一致,且对E2更敏感——在2 mg/L E2处理后,其表达水平已经极显著地上调(P<0.01)(图1-B)。这两个雌性相关基因的表达水平均对E2呈现一定的剂量依赖性。sox9a和cyp19a1a的表达水平没有发生显著变化,也不受E2溶液浓度变化的影响(图1-C,D)。在对照组和处理组中均未检测到dmrt1的表达。
2.2 E2暴露实验B
在10 ng/L E2处理后,于不同时间点,对斑马鱼胚胎的孵化率、存活率、畸形率进行了统计。结果(图2)表明,10 ng/L E2不能引起任何肉眼可见的斑马鱼胚胎的畸形(如体轴弯曲、心包水肿等),不会对斑马鱼的孵化时间产生影响(图2-A)。但如果暴露时间过长的话,也会引起幼鱼的死亡(图2-B)。因此又深入研究了E2处理9 d后,各个发育阶段的斑马鱼体内性别分化相关基因的表达水平的变化。

图1 经不同浓度的雌二醇(E2)溶液处理96 h后,各个性别分化相关基因表达水平的变化
用10 ng/L E2处理不同发育阶段的斑马鱼,时长为9 d。处理后发现,所有发育阶段的对照组和处理组斑马鱼的表型没有明显差异(图3)。在所有发育阶段的鱼体内,本实验选择的全部性别分化相关基因(即brca2,sox9a,sox9b,dmrt1和 cyp19a1a)的表达都能被qRT-PCR检测到(图4)。qRT-PCR的结果表明,经10 ng/L E2处理9 d后,幼鱼体内所有性别分化相关基因的表达水平没有发生显著变化(图4-A、E、I、M、Q)。在21 dpf鱼体内,brca2,dmrt1和cyp19a1a的表达水平显著上调。特别是dmrt1,其表达水平上调了12倍(P<0.001)。而sox9b和sox9a的表达水平无显著变化(图4- B、F、 I、N、R)。在成年雌鱼体内,brca2的表达水平上调了4倍,而sox9a和cyp19a1a均显著下调,sox9b和dmrt1的表达水平则无显著变化(图4- C、G、K、O、S)。在成年雄鱼体内,所有基因的表达水平均显著下调(图4- D、H、L、P、T)。
3 讨论
研究表明,许多环境内分泌干扰物(如炔雌醇、双酚A)能促进斑马鱼发育为雌性,而另一些化合物(如法曲唑)能促进斑马鱼发育为雄性[32-34]。有报道用17β-雌二醇(17β-estradiol,E2)处理幼鱼和21 dpf鱼一段时间后,将其放回正常的培养液中饲养至成年,会发现斑马鱼种群的雌性比例上升,雄鱼的第二性征减弱,部分雄鱼发育出了卵巢样的性腺,即E2在表型上促进了斑马鱼发育为雌性[9]。此外,有研究证明E2同样能促进青鳉发育为雌性[33-35]。有趣的是,E2对青鳉体内基因表达水平的影响会随温度和光周期的变化而变化[36]。此外,环境条件也会影响斑马鱼的性别分化。如高水温和低氧条件能促进F1代的雄性比例上升,雌鱼发育速度变快且进行异系繁殖[37-39]。因此推测,斑马鱼体内可能存在一个复杂的调控网络来控制其性别的发育方向,该网络会同时受到遗传和环境因素的影响。而在形态学和组织学水平上已经证实,E2会促进该网络推动斑马鱼发育为雌性[9]。
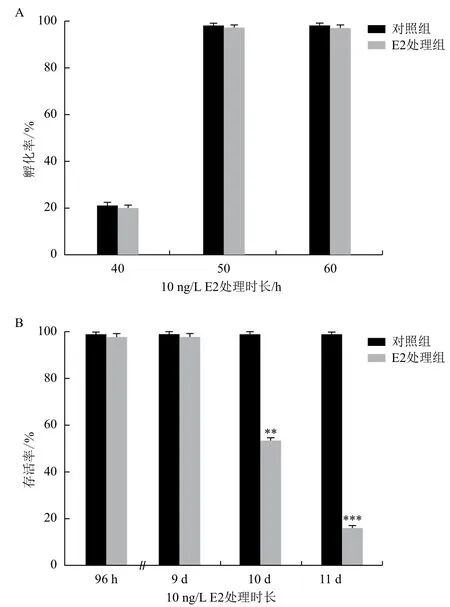
图2 经10 ng/L E2处理不同时长后斑马鱼的孵化率和存活率

图3 经10 ng/L E2处理9 d后各发育阶段斑马鱼的表型
本实验用qRT-PCR的方法,从转录水平上研究了E2促进斑马鱼发育为雌性的机制。我们前期的工作表明,斑马鱼胚胎的96 h半数致死浓度在2-3 mg/L这一范围中(数据未给出)。而E2的环境浓度范围为0-141 ng/L[6-8]。根据以上两点,分别设计E2暴露实验A和B,分别探究高浓度E2和低浓度E2对斑马鱼性别分化相关基因的表达水平的影响。
前人研究已证实brca2的纯合缺失突变斑马鱼会全部发育成雄性[19,20]。这表明brca2在斑马鱼发育为雌性的过程中起关键性作用。而sox9b可以被视为斑马鱼的一个卵巢标志基因[21,22]。E2暴露实验A的结果表明,雌二醇能上调斑马鱼胚胎中这两个雌性相关基因的表达,上调程度呈现一定的剂量依赖性。sox9a可以被视为一个睾丸标志基因[21-23],其表达水平不受雌二醇影响,dmrt1则没有表达。这表明雌二醇不能影响斑马鱼胚胎雄性相关基因的表达,且雄性相关基因各自的表达水平达到高峰的时间点并不一致。cyp19a1a的表达水平不受雌二醇影响,而其编码的蛋白负责将斑马鱼胚胎体内内源雄激素转化为内源雌激素,从而平衡性激素比例[21,28,29]。说明雌二醇不能影响斑马鱼胚胎体内的该通路。

图4 经10 ng/L E2处理9 d后,各发育阶段的斑马鱼体内性别分化相关基因的表达水平
E2暴露实验B的结果表明,在斑马鱼胚胎中,10 ng/L E2浸泡9 d的处理不能影响任何一个性别分化相关基因的表达水平(图4-A、E、I、M、Q)。在21 dpf斑马鱼(性腺发育刚刚开始)中,该处理上调了雌性相关基因的表达,并促进了内源雄激素转化为内源雌激素(图4- B、F、I、N、R)。该结果与前人在形态学和组织学水平上研究得出的结论一致[9,39]。另外,前人观察到dmrt1在蛙、龟和鼠的体内,都是雄性的表达水平远高于雌性[25-27]。人们据此提出假说:dmrt1的高表达水平可能对于雄性的发育是必需的,而低表达水平可能对于雌性的发育是必需的[18]。而在本实验中,在表型上促进斑马鱼发育为雌性的E2[9,39],却能大幅上调21 dpf鱼体内dmrt1的表达水平(图4-N)。这说明上述假说在斑马鱼体内可能是不成立的。即使该假说是部分正确的,即dmrt1的上调表达确实能促进鱼发育为雄性,本实验的结果也证明了dmrt1的效应要远远弱于brca2(图4-B、N,dmrt1的上调倍数远高于brca2,但斑马鱼依然发育成雌性)。在成年雌鱼中,E2下调了部分雄性相关基因(即sox9a)的表达水平。同时,E2还下调了cyp19a1a的表达水平,减弱了内源雄激素转化为内源雌激素的过程(图4-K、S)。推测原因可能是由于鱼吸收了大量外源雌激素E2,导致体内的雌激素浓度过高,以负反馈机制抑制了内源雌激素的生成。该假设需要进一步的实验验证。根据E2对成年雌鱼的影响结果,我们提出了“E2能否引发成年雄鱼的性逆转”的疑问。实验结果表明,在成年雄鱼中,E2下调了所有性别分化相关基因的表达水平(图4-D、H、L、P、T)。对于上述疑问:首先,从形态学上观察不到任何性逆转特征(图3-H);其次,从转录水平看不出明显的性逆转趋势(图4-D、H、L、P、T);最后,如果需要确切地验证该假说,就必须制作性腺切片,从组织学上加以鉴定。
总之,E2暴露实验A和暴露实验B的结果共同证明,在转录水平E2能上调雌性相关基因(brca2、sox9b)的表达,下调部分雄性相关基因(sox9a)的表达,该结果与前人在形态学和组织学水平上研究得出的关于E2对鱼类性别分化的影响的结论一致[9,39],即E2与其他EDCs的效果相同,与法曲唑的效果相反[32-34]。因此,也许可以将“能否促进斑马鱼发育为雌性”作为评估某一化合物是否具有雌激素效应的一项生理指标。
4 结论
本实验采用qRT-PCR的方法,从转录水平研究了雌二醇促进斑马鱼发育为雌性的机制。发现E2能上调雌性相关基因(brca2、sox9b)的表达,下调部分雄性相关基因(sox9a)的表达,对不同发育阶段的斑马鱼体内性激素转化通路(cyp19a1a)的影响不同。
[1] Klotz DM, Ladlie BL, Vonier PM, et al. o. p’-DDT and its metabolites inhibit progesterone-dependent responses in yeast ang human cells[J]. Molecular and Cellular Endocrinology, 1997, 129:63-71.
[2] Ethier SP. Primary culture and serial passage of normal and carcinogen-treated rat mammary epithelial cells in vitro[J]. J NatlCancer Inst, 1985, 74:1307-1318.
[3] Rudel R. Predicting health effects of exposures to compounds with estrogenic activity:Methodological issues[J]. Environmental Health Perspectives, 1997, 105(Suppl. 3):665-663.
[4] Nakada N, Nyunoya H, Nakamura M, et al. Identi fication of estrogenic compounds in wastewater effluent[J]. Envir onmental Toxicology and Chemistry, 2004, 23(12):2807-2815.
[5] Snyder SA, Villeneuve DL, Snyder EM, et al. Identification and quantification of estrogen receptor agonists in wastewater Effluents[J]. Environmental Science & Technology, 2001, 35(18):3620-3625.
[6] Shore LS, Gurevitz M, Shemesh M. Estrogen as an environmental pollutant[J]. Bulletin of Environmental Contamination and Toxicology, 1993, 51(3):361.
[7] Snyder SA, Keith TL, Verbrugge DA, et al. Analytical methods for detection of selected estrogenic compounds in aqueous mixtures[J]. Environmental Science & Technology, 1999, 33(16):2814-2820.
[8] Lei B, Huang S, Zhou Y, et al. Levels of six estrogens in water and sediment from three rivers in Tianjin area, China[J]. Chemosphere, 2009, 76(1):36-42.
[9] Brion F, Tyler CR, Palazzi X, et al. Impacts of 17β-estradiol,including environmentally relevant concentrations, on reproduction after exposure during embryo-larval-, juvenile- and adult-life stages in zebrafish(Danio rerio)[J]. Aquatic Toxicology, 2004, 68(3):193-217.
[10]Terriente J, Pujades C. Use of zebrafish embryos for small molecule screening related to cancer[J]. Dev Dyn, 2013, 242(2):97-107.
[11]Meguro S, Hasumura T, Hase T. Coffee polyphenols exert hypochole sterolemic effects in zebrafish fed a high -cholesterol diet[J]. Nutrition & Metabolism, 2013, 10(1):61.
[12]Liu L, Xu Y, Xu L, et al. Analysis of differentially expressed proteins in zebrafish(Danio rerio)embryos exposed to chlorpyrifos[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2015, 167:183-189.
[13]王健, 刘丽丽, 余凯敏, 等. 高效氯氰菊酯对斑马鱼胚胎毒性的研究[J]. 生物技术通报, 2014(10):223-229.
[14]刘丽丽, 王健, 王海胜, 等. 斑马鱼转基因平台的建立[J].生物技术通报, 2013(10):120 -126.
[15] Trant JM, Gavasso S, Ackers J, et al. Developmental expression of cytochrome P450 aromatase genes(cyp19a and cyp19b)in zebrafish fry(Danio rerio)[J]. J Exp Zool, 2001, 290(5):475-483.
[16]Von Hofsten J, Olsson PE. Zebrafish sex determination and differentiation:involvement of Ftz-F1 genes[J]. Reproductive Biology and Endocrinology, 2005, 3:63-73.
[17] Wang XG, Bartfai R, Sleptsova-Freidrich I, et al. The timing and extent of ‘juvenile ovary’ phase are highly variable during zebrafish testis differentiation[J]. Journal of Fish Biology, 2007,70(sa):33-44.
[18]Jørgensen A, Morthorst JE, Andersen O, et al. Expression profiles for six zebrafish genes during gonadal sex differentiation[J]. Reproductive Biology and Endocrinology, 2008, 6(1):25.
[19] Shive HR, West RR, Embree LJ, et al. brca2 in zebrafish ovarian development, spermatogenesis, and tumorigenesis[J]. PNAS,2010, 107(45):19350-19355.
[20] Rodríguez-Marí A, Wilson C, Titus TA, et al. Roles of brca2(fancd1)in oocyte nuclear architecture, gametogenesis, gonad tumors,and genome stability in zebrafish[J]. PLoS Genetics, 2011, 7(3):e1001357.
[21] Rodríguez-Marí A, Yan Y, BreMiller RA, et al. Characterization and expression pattern of zebrafish anti-Müllerian hormone(amh)relative to sox9a, sox9b, and cyp19a1a, during gonad development[J]. Gene Expression Patterns, 2005, 5(5):655-667.
[22]Tong S, Hsu H, Chung B. Zebrafish monosex population reveals female dominance in sex determination and earliest events of gonad differentiation[J]. Developmental Biology, 2010, 344(2):849-856.
[23] Orlando E, Guillette JL. Sexual dimorphic responses in wildlife exposed to endocrine disrupting chemicals[J]. Environmental Research, 2007, 104(1):163-173.
[24]Guo Y, Cheng H, Huang X, et al. Gene structure, multiple alternative splicing, and expression in gonads of zebrafish Dmrt1[J]. Biochemical and Biophysical Research Communications, 2005, 330(3):950-957.
[25] Raymond CS, Murphy MW, O’sullivan MG, et al. Dmrt1, a gene related to worm and fly sexual regulators, is required for mammalian testis differentiation[J]. Genes & Development, 2000, 14:2587-2595.
[26]Shibata K, Takase M, Nakamura M. The dmrt1 expression in sexreversed gonads of amphibians[J]. General and Comparative Endocrinology, 2002, 127:232-241.
[27] Torres ML, Landa PA, Moreno MN, et al. Expression profiles of Dax1, Dmrt1, and Sox9 during temperature sex determination in gonads of the sea turtle Lepidochelys olivacea[J]. Gen Comp Endocrinol, 2002, 129(1):20-26.
[28] Suzawa M, Ingraham HA. The herbicide atrazine activates endocrine gene networks via non-steroidal NR5A nuclear receptors in fish and mammalian cells[J]. PLoS One, 2008, 3(5):e2117.
[29] Trant JM, Gavasso S, Ackers J, et al. Developmental expression of cytochrome P450 aromatase genes(cyp19a and cyp19b)in zebrafish fry(Danio rerio)[J]. J Exp Zool, 2001, 290(5):475-483.
[30] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4):402-408.
[31] R Core Team. R:A language and environment for statistical computing[CP]. R Foundation for Statistical Computing, Vienna,Austria, 2014. URL http://www. R-project. org/.
[32]Andersen L, Holbech H, Gessbo A, et al. Effects of exposure to 17a-ethinylestradiol during early development on sexual differentiation and induction of vitellogenin in zebrafish(Danio rerio)[J]. Comparative Biochemistry and Physiology Part C,2003, 134:365-374.
[33]Drastichová J, Svobodová Z, Groenland M, et al. Effect of exposure to bisphenol A and 17β-estradiol on the sex differentiation inzebrafish(Danio rerio)[J]. Acta Veterinaria Brno, 2005, 74:287-291.
[34]Fenske M, Maack G, Schfers C, et al. An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio[J]. Environmental Toxicology and Chemistry, 2005, 24(5):1088.
[35]Hirai N, Nanba A, Koshio M, et al. Feminization of Japanese medaka(Oryzias latipes)exposed to 17β-estradiol:Effect of exposure period on spawning performance in sex-transformed females[J]. Aquatic Toxicology, 2006, 79(3):288-295.
[36]Jin Y, Shu L, Huang F, et al. Environmental cues influence EDC-mediated endocrine disruption effects in different developmental stages of Japanese medaka(Oryzias latipes)[J]. Aquatic Toxicology, 2011, 101(1):254-260.
[37] Lawrence C, Ebersole JP, Kesseli RV. Rapid growth and outcrossing promote female development in zebrafish(Danio rerio)[J]. Environmental Biology of Fishes, 2007, 81(2):239-246.
[38] Uchida D, Yamashita M, Kitano T, et al. An aromatase inhibitor or high water temperature induce oocyte apoptosis and depletion of P450 aromatase activity in the gonads of genetic female zebrafish during sex-reversal[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2004, 137(1):11-20.
[39] Shang EHH, Yu RMK, Wu RSS. Hypoxia affects sex differentiation and development, leading to a male-dominated population in zebrafish(Danio rerio)[J]. Environmental Science & Technology,2006, 40(9):3118-3122.
(责任编辑 李楠)
Effects of 17β-estradiol on the Sex Differentiation of Zebrafish(Danio rerio)
Li Guochao Yu Kaimin Feng Weimin Liu Lili Zhang Jiayu Yan Yanchun
(Graduate School,Chinese Academy of Agricultural Sciences,Beijing 100081)
Previous studies have demonstrated that 17β-estradiol(E2)could increase the female proportion in zebrafish population. In order to study mechanisms of feminization caused by E2, quantitative real-time PCR(qRT-PCR)was used to analyze expression levels of genes involved in sexual differentiation(brca2, sox9a, sox9b, dmrt1 and cyp19a1a)under different conditions. The results indicate that E2 can up-regulate the expression levels of the female-predominant genes(brac2 and sox9b), partially down-regulate the expression levels of malepredominant gene(sox9a)and has different effects on sex hormone conversion pathway(cyp19a1a)in different developmental stages of zebrafish.
endocrine disrupting chemicals;17β-estradiol;zebrafish;sexual differentiation
10.13560/j.cnki.biotech.bull.1985.2015.06.032
2014-11-24
国家高技术研究发展计划项目(2008AA10Z402),国家自然科学基金项目(31170119),中国农业科学院基础研究基金项目(0042014006,0042012003,0042011006)
李国超,男,硕士研究生,研究方向:微生物分子生物学与基因工程;E -mail:stevelee0201@163.com
闫艳春,女,教授,研究方向:微生物分子生物学与基因工程;E-mail:yanyanchun@caas.cn

