木炭还原氧化铜实验成功的关键再探究
陈月星
摘要:针对九年级化学教材中木炭还原氧化铜实验很难做成功原因的探究,分别选择了不同比例的木炭和氧化铜混合物,以酒精灯及铁网等辅助装置作为加热热源,在小试管及立位姿势试管装置中进行化学实验。结果表明,为体系提供持续的高温并恰当选择混合反应物的比例及试管的位置是使本实验具有操作简便、安全,实验完成时间短,现象明显等成功的特点。
关键词:氧化铜 实验 关键
一、前言
木炭还原氧化铜是九年级化学中的一个重要实验,能否做好该实验是掌握碳的化学性质的关键。但是由于该实验按教科书及教参上做,受到太多条件的限制,所以完成该实验难度很大,几乎不易成功。查阅近些年中学化学实验文献,可以找到十多篇对该实验所做的不同角度的研究报告,其中的方法和结论不尽相同,足以说明这个实验的复杂性。那么如何改进这个实验,能让这个实验变成一个快捷,操作简单,现象明显,成功率高的实验呢?为了解决这个问题,笔者在前人研究的基础上经过多次的实验和探索,终于找出了简便易行、现象明显、成功率高的实验方法。
二、实验方法
(一)对此实验的历史回顾
一直以来,木炭还原氧化铜的实验对教师来说都是个很熟悉的实验,可是做成功的几率很低,我也是连续几年都没有做成功。据我调查,很多教师包括我对此实验做了些不同的改进工作。例如,在温度和装置都按教材上提供的,而在做实验时把药品充分混合,还把药品处理成糊状的混合在一起,粘在试管内壁一层进行了实验,让其充分接触,但结果还是不理想。还把带铁丝网的酒精灯,在灯芯中插了铜丝,以提高酒精的气化程度,以此来提高供给这个反应的温度。后来索性换成酒精喷灯,把试管都烧化了,实验还是不成功。我们一线教师几乎对这个实验束手无策了,甚至开始怀疑此实验的真实性,到最后都绝望了,只能放弃了。在教学时只能采用讲解的方式来给学生灌输这个实验。就连刘怀乐老师(1996)采用平卧式试管以木炭与氧化铜的质量比为1:10.6进行实验时表明,在酒精灯下就能发生剧烈的反应,过程中反应物出现红热并伴有大量气体生成[1],但之后他承认对这个实验的成功没有绝对的把握,因此仍把它列为初中化学中的疑难实验[2]。之后又有好多人对实验进行了改进。查阅前人研究的成果,都是从改进药品种类(用活性炭代替木炭);改进药品量的比例;调整热源(用酒精喷灯);还有改变实验装置等。
(二)实验方法的设计(包括实验仪器、药品)
1.实验的设计思路
在对已有的实验研究进行分析的基础上,我本着用品简单、现象明显、安全可靠的原则,选择了①药品及药品质量比例:木炭粉(就是把块状的木炭在研钵中研成很细的粉末)和粉末状的氧化铜;比例:1:11;选择了②仪器:酒精灯(火焰外加铁丝网,作用聚拢火焰提高酒精灯的温度;灯芯内插上铜丝,加速酒精的氧化,从而进一步提高酒精灯的温度),但必须用焰心、内焰到外焰加热;铁架台(配本制试管夹);试管(小规格:14mm口径)选择③装置:如图1 所示中进行化学试验。
2.对实验设计思路的分析
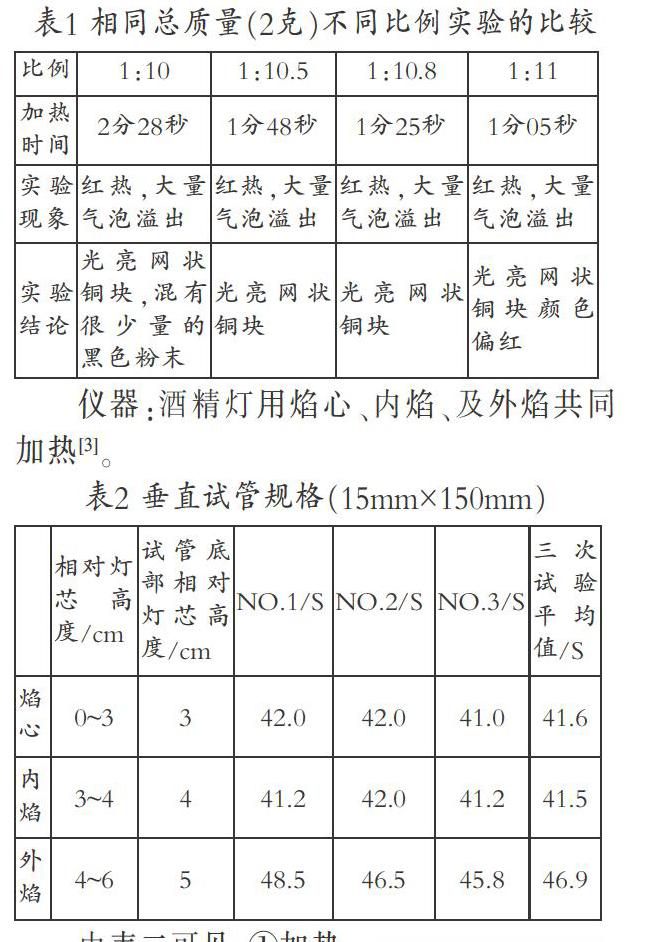
药品:木炭粉(就是把块状的木炭在研钵中研成很细的粉末)和粉末状的氧化铜;把块状的木炭在研钵中研成很细的粉末再与粉末状的氧化铜混合,可能增大接触面积,从而加快反应速度;比例选1:11的原因,见表1。
表1 相同总质量(2克)不同比例实验的比较
表2 垂直试管规格(15mm×150mm)
由表二可见,①加热时,试管底触及内焰,让外焰的能够很好地包裹住垂直的试管下部,使外焰的热量能被充分利用,从而提高温度。所以用焰心、内焰、直到用外焰共同加热效果要远比单纯用外焰加热好。②试管直立的原因:将小试管加到火焰中时,会劈开火焰,变形的火焰包住试管底部,试管越小,伸入火焰中越多,试管被变形的火焰包住的面积越大,从而使试管的受热面积大,加热效率当然就会提高了。
装置如图1。装置中试管带上胶塞密封的原因:是为隔绝空气,防止刚生成的高温的铜被空气中的氧气氧化。
三、实验的实施
按以上实验方法的设计,进行实验步骤的设计。
1.连接装置(小试管和单孔胶塞)检查装置气密性(這是防止生成铜被再次氧化的关键步骤)。
2.装药品:夯实药品(如果药品松散,生成的气体会把固体顶上去,会让装置漏气、反应物的接触面也会减小,反应速度也会降低)。
3.固定装置开始加热:注意用焰心、内焰、外焰来加热。
4.撤去酒精灯,待导管口气泡大量涌出之后渐归于平静时,迅速盖上胶塞。
5.让产物自然冷却,取出产物。
6.整理且清洗仪器。
四、实验的现象和结论
(一)现象
炭还原氧化铜的反应是一个较强烈的放热反应,该反应在上述设计下很容易发生,一旦发生,即出现“红热现象”:反应热能令反应物发红——从反应物底部向上蔓延,十分耀眼。与此同时,试管导管口处也急速释放出使石灰水变浑浊的气体,整个过程可维持好几秒钟。
(二)结论
1.木炭还原氧化铜反应可以在一个比较广泛的比例范围(1:6~1:12)里发生,在低比例段可得到金黄色的铜珠,但同时出现残余的黑色木炭粉;在1:10~1:11之间可得到亮红色金属光泽的网状铜块及小铜珠;比例更高时易生成红色的氧化亚铜。
2.还原反应后出现铜珠颗粒的大小应跟反应过程中释放出来的热量大小有关,足够的热量可以使细小的铜粒熔为较大的铜珠。当混合物中木炭量较充足时往往得到较大的铜珠,说明稍过量的木炭对这个反应是有利的。
3.单纯加热木炭粉末所产生的气体也能使石灰水变浑浊,因此,绝不能把石灰水变浑浊作为木炭跟氧化铜反应的充分证据。
参考文献:
[1]刘怀乐.中学化学实验与教育研究[M].重庆西南师范大学出版社,1996.
[2]刘怀乐.中学化学教学实证与求索[M].重庆西南师范大学出版社,2002.
[3]王立平,卢玉妹.酒精灯加热效率的实验探究,2009.
(责编 赵建荣)

