球囊霉属3种AM真菌对香蕉枯萎病的影响
梁昌聪 刘磊 郭立佳 杨腊英 王国芬 张建华 黄俊生

摘 要 以巴西蕉(Musa AAA Giant Cavendish cv. Baxi)试管苗为材料,在温室盆栽条件下研究了丛枝菌根(Arbuscular Mycorrhiza, AM)真菌Glomus mosseae(Nicol. & Gerd.)Gerdemann、G. aggregatum(Schenck & Smith)Koske和G. etunicatum Becker & Gerdemann对香蕉枯萎病(fusarium wilt of banana)的影响。结果表明:巴西蕉植株的菌根侵染率为23.13%~44.72%,接种AM真菌促进了巴西蕉植株的营养生长,显著地增加地上部分和根系的干重,显著减少根际土壤周围镰刀菌数量,对植株的株高、叶片数和叶片长度略有提高;降低香蕉枯萎病发病率和病情指数,从而减轻香蕉枯萎病的危害。单接种AM真菌显著促进巴西蕉植株地上和根部分P和K含量和吸收量;与单接种镰刀菌的植株相比,双接种混合AM真菌与镰刀菌处理能显著提高植株地上部分P的含量和吸收量及根系部分K的含量和吸收量。结果还表明,混合接种剂的生长防病效果好于单一接种剂。
关键词 丛枝菌根真菌;巴西蕉;香蕉枯萎病;尖孢镰刀菌
中图分类号 S668.1 文献标识码 A
香蕉枯萎病是由尖孢镰刀菌(Fusarium oxysporum Schl.)引起的一种毁灭性的土传病害,已严重危害到香蕉的生产及香蕉产业。目前,单纯采用化学药剂防治香蕉枯萎病的效果并不理想[1],并且随着大量使用化学农药产生了环境污染、农药残留及土壤微生物群落结构失衡等令人担忧的问题[2];因此很多学者把注意力放到生物防治上。丛枝菌根(arbuscular mycorrhiza,AM)真菌作为一种重要的植病生防菌一直受到普遍关注。AM真菌能够与陆地上85%以上的植物建立共生关系,形成丛枝菌根[3]。
由于AM真菌侵染的是植物根系,因此,对植物真菌病害的影响大多涉及植物的土传病害。研究表明,植物根系中从枝菌根的形成确实可以影响植物对土传病害的抗性耐性[4]。在园艺、农作物和林业生产中,AM真菌既可作为生物肥料,又可作为生防药剂,具有很大的应用潜力。研究表明AM真菌可减轻土传病原镰刀菌对番木瓜[5]、番茄[6]、黄瓜[7]、棉花[8-9]、芦笋[10-12]、菜豆[13]等作物所造成的危害。然而目前对AM真菌与香蕉枯萎病的关系研究几乎没有;AM真菌在香蕉上的研究主要集中在AM真菌减轻线虫对香蕉造成的危害[14],真菌促进香蕉养分吸收,提高光合速率和水分的利用效率,促进植株生长,提高产量等方面[15-17]。因此,本研究在温室盆栽条件下探索AM真菌对香蕉枯萎病的影响, 为AM真菌在香蕉病害防治上的田间试验提供依据。
1 材料与方法
1.1 材料
1.1.1 香蕉苗 由中国热带农业科学院种苗组培中心提供的巴西蕉(Musa AAA Giant Cavendish cv. Baxi)试管苗。
1.1.2 AM真菌 Glomus mosseae(Nicol. & Gerd.)Gerdemann(GM-df05)分离自海南东方香蕉地,为中国热带农业科学院环境与植物保护研究所微生物资源研究与利用课题组保存。Glomus aggregatum (Schenck & Smith) Koske(编号:BGC HK02D);Glomus etunicatum Becker&Gerdemann(编号:BGC HEN 02A)购自北京市农林科学院植物营养与资源研究所。这3个AM真菌都以三叶草(Trifolium repens L.)为宿主,用沸石加河沙扩繁,其孢子和菌根根段作为接种物。
1.1.3 病原菌 为尖孢镰刀菌古巴转化型(Fusarium oxysporum f. sp. cubense)(FOC4-B2),为中国热带农业科学院环境与植物保护研究所微生物资源研究与利用课题组分离筛选保存菌株。
1.1.4 栽培容器 包括育苗杯[10 cm(底直径)×10 cm]和塑料盆[21 cm(底直径)×22 cm],育苗杯中的栽培介质为椰糠,塑料盆中的栽培介质为灭菌土壤。
1.1.5 椰糠和土壤 高温灭菌(121 ℃,1 h,间歇灭菌2次)后备用, 土壤理化性质为pH值6.10,有机质含量为17.90 g/kg,碱解氮0.03 g/kg,有效磷0.02 g/kg,速效钾0.11 g/kg,全氮0.91 g/kg,全磷0.26 g/kg,全钾0.95 g/kg。
1.2 方法
1.2.1 试验设计 试验在中国热带农业科学院环境与植物保护研究所日光温室大棚内进行。试验共设置5个处理:①对照CK:幼苗生长过程中既不接種AM真菌也不接种Foc病原菌;②Foc:育苗时不接种AM真菌,幼苗移栽花盆后接种Foc病原菌;③G.m:育苗时单一接种AM真菌G.mosseae;④G.m+Foc:育苗时单一接种AM真菌G.mosseae,幼苗移栽花盆后接种Foc病原菌;⑤G.混:育苗时混合接种AM真菌G.mosseae、G.aggregatum、G.etunicatum(质量比为1 ∶ 1 ∶ 1);⑥G. 混+Foc:育苗时混合接种AM真菌G.mosseae、G.aggregatum、G.etunicatum(质量比为1 ∶ 1 ∶ 1),幼苗移栽花盆后接种Foc病原菌;每处理10盆。
处理③④⑤⑥AM真菌接种剂按10%的比例(质量比)与育苗杯的栽培介质混合后备用;处理①②则加10%的比例(质量比)灭菌接种剂与育苗杯的栽培介质混合后备用。将试管苗从培养瓶中取出,仔细洗净根系上的琼脂,挑选大小一致的幼苗90株(每个处理15株)移栽到育苗杯中,根据天气情况用小型喷雾器向叶面喷射雾状水1-3次/d,保持栽培介质和叶面的湿度。幼苗生长5周后,移栽到塑料盆里。分别从6个处理的成活幼苗中选择生长一致的每个处理各10棵植株,带栽培物质移栽到塑料盆中,每盆装入3 kg灭菌土,每盆1株。
1.2.2 尖孢镰刀菌的接种 从培养7 d的FOC4-B2菌株平板上挑一块菌饼接种于PDB(土豆葡萄糖培养液)培养液中,置于180 r/min 转速的摇床中28 ℃振荡培养5 d,过滤除去菌丝,将孢子液离心沉淀,再用无菌水重悬孢子,并将孢子悬浮液浓度调至约106 cfu/mL。各取100 mL的FOC4-B2孢子悬浮液分别与3 kg灭菌土壤混匀制成病土,装于塑料盆中。不接种病原菌处理则浇入等量灭菌蒸馏水。
1.2.3 指标测定 移栽生长12周后,植株收获,各处理随机取5盆,测定植株叶片数和叶片长度;并且用特异选择培养基稀释分离法测定选取的巴西蕉根围土壤中尖孢镰刀菌数量[18];取出植株,分离地上部和根系,用碱解离、酸性品红染色法[19]进行处理。把染色的根样切成1~2 cm的小根段,然后选取20~30个小根段,用十字交叉法[20]在×200倍的顯微镜下观察AMF在各根样中的感染情况。每一样本观察150个交叉,记录根中菌丝、泡囊、丛枝的感染情况。植株在70 ℃烘干至恒重,测定根系和地上部干重,计算根冠比。植株经消煮后,分别用凯氏定氮法、钒钼黄比色法和火焰光度计测定N、P、K含量[21]。
1.2.4 香蕉病情指数和防病效果 香蕉枯萎病先从根部维管束侵入,然后侵害下部叶片叶鞘维管束,并由下而上不断扩展,因此根据这个特征将香蕉枯萎病分为以下5个标准:
0级:植株无枯黄症状;
1级:植株下部叶片出现轻微的枯黄症状,嫩叶完好,少部分根系轻微褐变,茎部出现水渍状褐变;
2级:植株下部叶片出现明显的枯黄症状,但嫩叶完好,根系出现褐变,茎部和假茎部出现水渍状褐变;
3级:整个植株出现枯黄症状,根系褐变腐烂,茎部和假茎部褐变连片,少数叶柄出现红褐;
4级:植株出现枯萎死亡症状,根系严重褐变腐烂。
植物病情调查:病情指数[22]
病情指数=∑
1.3 数据统计
数据用SPSS 11.5统计软件进行分析,应用Tukey HSD方法进行多重比较,显著水平取0.05(p≤0.05)。
2 结果与分析
2.1 AM真菌对巴西蕉的侵染率及对香蕉枯萎病的影响
表1数据表明,接种AM真菌的4个处理中植株根系均被侵染。不论是接种单一AM真菌还是接种混合AM真菌,在先接种AM真菌后接种Foc病原菌时,AM真菌的侵染率则低于单接种AM真菌处理的植株,说明Foc病原菌能抑制AM真菌对巴西蕉根系的侵染和发育。AM真菌与Foc病原菌双接种的植株根际土壤Foc病原菌数量显著低于单接种Foc病原菌植株,并且混合AM真菌与Foc病原菌双接种的植株根际土壤Foc病原菌数量最少(表1)。
同一种接种方式处理的混合接种剂处理的菌丝侵染率显著高于单一接种剂,如处理⑤G.混的菌丝侵染率44.72%高于处理③G.m 33.34%,表明混合接种剂能提高AM真菌对植株的侵染水平。从表1可知,接种AM真菌能显著降低香蕉枯萎病的发病率和病情指数, 不同AM真菌的效应存在差异,混合接种剂处理的效果优于单一接种剂。
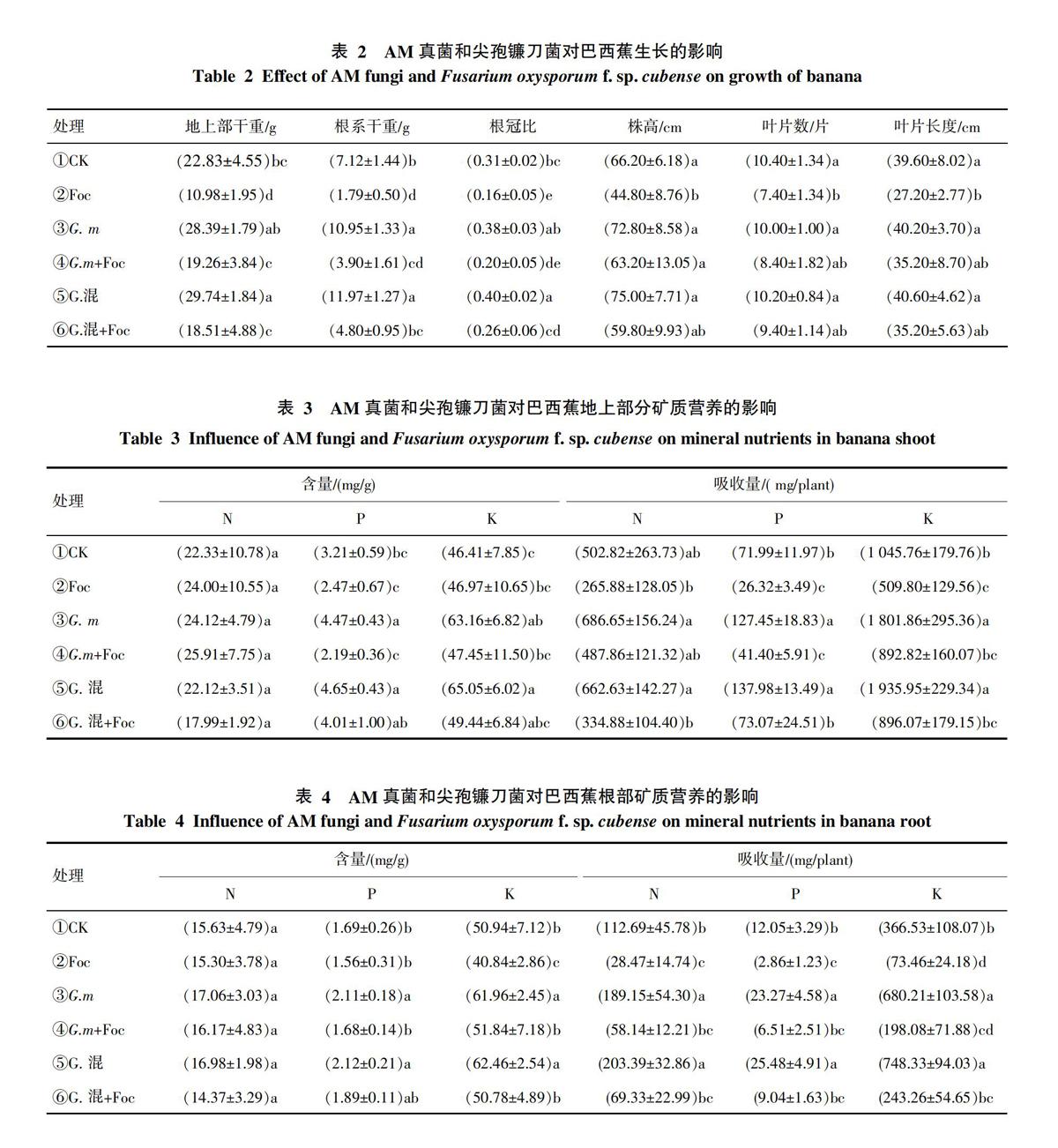
2.2 AM真菌和尖孢镰刀菌对巴西蕉生长的影响
接种AM真菌处理的植株干重、根冠比显著大于其它处理。其中, 以单接种G.混促进香蕉生长的效果最好(表2)。AM真菌与Foc病原菌双接种的植株干重均显著高于单接种Foc病原菌植株,接种AM真菌的处理的植株干重显著高于对照,而单接种Foc病原菌处理的植株干重、株高、叶片数、叶片长度最小(表2),这与该病菌对巴西蕉的致病性有关。
接种AM真菌对巴西蕉植株的地上部的生长产生一定的影响。对于株高、叶片数和叶片长度而言, 单接种AM真菌处理比CK有所增加(表2),但是差异未达到显著水平;双接种AM真菌和病原菌处理比单接种Foc有所增加(表2),但是差异也未达到显著水平。
2.3 AM对巴西蕉植株矿质营养吸收的影响
从表3可以看出,与CK相比,单接种AM真菌能显著提高巴西蕉处理地上部分P和K的含量和吸收量;混合AM真菌与Foc病原菌双接种植株地上部分P含量和吸收量均显著高于单接种Foc病原菌植株。
从表4可以看出,单接种AM真菌的巴西蕉处理植根部P、K含量和N、P、K吸收量均显著高于CK。AM真菌与Foc病原菌双接种的植株根系部分K含量均显著高于单接种Foc病原菌植株,并且双接种中的G. 混植株根系部分K吸收量显著高于单接种Foc病原菌植株。
3 讨论与结论
AM真菌能够显著促进巴西蕉生长,而尖孢镰刀菌则抑制其生长。当AM真菌与尖孢镰刀菌双接种时,AM真菌能显著降低香蕉枯萎病的发病率和病情指数,提高植株生长量,这与AM真菌可以通过改善植株矿质营养、水分状况等促进植株生长健壮,从而提高其抗病性[4]是一致的。这一结果表明,AM真菌促进植物生长的效应在其降低土传病害发病程度过程中具有一定作用。关于AM真菌与Foc病原菌的关系,李敏等[23]在研究AM真菌与西瓜枯萎病的关系时发现, 接种AM真菌能显著减少西瓜根内和根围土壤中镰刀菌群体数量及其对根系的侵染率。本研究也发现,接种AM真菌显著减少巴西蕉根围土壤中Foc病菌数量。
由于AM真菌的防治效果受到AM真菌的种类、病原菌的毒力及外界环境条件等诸多因素的影响,因此AM真菌对土传病害的防治效果很难一概而论。其中,病原菌侵入植物体时,AM真菌和植物建成共生体(菌根)的状况是影响AM真菌防治效果的一个重要因素。有研究表明,AM真菌对植物抗病性的诱导依赖于较高(大于50%)的菌根侵染率[24-25]。但是对于菌根侵染率高低的界定往往因植物基因型、AM真菌种类、接种病原菌时间及取样时间等而不同。具体到本研究,巴西蕉育苗时接种AM真菌,7周后移栽到塑料盆进行盆栽同时接种病原菌,幼苗生长3个月后,尽管菌根侵染率不到50%,但共生体已初步建成,能对病原菌的侵害进行有效抵制,降低香蕉枯萎病的发病率和病情指数。
研究表明,当植株根系受到病原侵害时,菌根化植株可利用分布于土壤中的菌丝提高植物根系的吸收表面积,同时,根细胞内丛枝的形成维持了根细胞的活性,进而使得受病原侵害的植物根系功能在一定程度上得到了改善[26]。本研究中,在先接种AM真菌后接种Foc病原菌的条件下,育苗时接种AM真菌可促进巴西蕉根系生长,且AM真菌的促生作用最终表现为植株地上部分和根系干重的增加。由此看来,接种AM真菌后巴西蕉干重的增加间接补偿了因病原菌侵入而对植株根系造成的损伤。
Hu等[27]的试验发现,与单一菌种的接种剂相比,混合接种剂促进黄瓜生长和降低黄瓜枯萎病的效果更好。本研究结果也表明混合接种剂对巴西蕉的生长防病效果好于单一接种剂。这可能是因为混合接种剂处理的菌丝感染率比单一接种剂处理的高,导致菌丝密度大,所以吸收能力更强。
AM真菌促进植株生长的原因在于养分吸收得到增强。一般而言,在灌溉良好、養分适宜的土壤中,AM真菌对植株的P元素有很好的促进作用,而对N元素和K元素的促进作用不明显。本研究发现在3种矿质营养中,巴西蕉地上和根部的P、K含量和吸收量因接种AM真菌而明显提高,更有利于巴西蕉的生长,因为巴西蕉是需K量较高的果树之一。
综上所述,AM真菌与感病巴西蕉可以形成共生体,且促进植株的生长,降低植株根系周围Foc病原菌数量及香蕉枯萎病的发病率和病情指数。由于AM真菌对香蕉枯萎病的显著防效,因此,可将农业生态系统中丰富的AM真菌资源应用于巴西蕉的育苗生产环节,为大田中香蕉枯萎病的防治提供一条经济有效的生防途径。
参考文献
[1] 王振中. 香蕉枯萎病及其防治研究进展[J]. 植物检疫, 2006, 20(3): 198-200.
[2] 杨永华, 姚 健,华晓梅. 农药污染对土壤微生物群落功能多样性的影响[J]. 微生物学杂志, 2000, 20(2): 23-25, 47.
[3] Smith S E, Read D J. Mycorrhizal Symbiosis(2nd ed)[M]. London: Academic Press, 1997: 1-589.
[4] 刘润进,李晓林. 丛枝菌根及其应用[M]. 北京:科学出版社, 2000: 97-113.
[5] Hernández-Montiel L G, Rueda-Puente E O, Cordoba-Matsona M V, et al. Mutualistic interaction of rhizobacteria with arbuscular mycorrhizal fungi and its antagonistic effect on Fusarium oxysporum in Carica papaya seedlings[J]. Crop Protection, 2013, 47: 61-66.
[6] Nurhayati. Effects of inoculation time of mycorrhiza vesicular arbuscular on fusarium oxysporum infection and tomatoes growth[J]. Journal of Agrivigor, 2010, 9(3): 280-284.
[7] Dehne H W. Interaction between vesicular-arbuscular mycorrhizal fungi and plant pathogens[J]. Phytopathology, 1982(72): 1 115-1 119.
[8] 刘润进,沈崇尧. 棉花VA菌根研究与应用前景[J].世界农业, 1992(9): 30-31.
[9] 顾向阳,胡正嘉. VA菌根真菌Glomus mosseae对棉花根区微生物量和生物量的影响[J]. 生态学杂志, 1994, 13(2): 7-11.
[10] Wacker T L, Safir G R, Stephens C T. Mycorrhizal fungi in relation to asparagus growth and Fusarium wilt[J]. Acta horticulturae, 1990(271): 417-422.
[11] Wacker T L, Safir G R, Stephens C T. Effect of Glomus fasciculatum on the growth of asparagus and the incidence of Fusarium root rot[J]. Journal of the American Society for Horticultural Science, 1990(115): 550-554.
[12] Matsubara Y, Hasegawa N, Fukui H. Incidence of Fusarium rot in asparagus seedlings infected with arbuscular mycorrhizal fungus as affected by several soil amendments[J]. Journal of Japan Society Horticultural Science, 2002(71): 370-374.
[13] Filion M, St-Arnaud M, Jabaji-Hare S H. Quantification of fusarium solani f. sp phaseoli in mycorrhizal bean plants and surrounding mycorrhizosphere soil using real-time polymerase chain reaction and direct isolations on selective media[J]. Phytopathology, 2003(93): 229-235.
[14] Christine V, Daphné V D B, Franklin M L, et al. Mycorrhiza-induced resistance in banana acts on nematode host location and penetration[J]. Soil Biology & Biochemistry, 2012(47): 60-66.
[15] Yano-Melo A M, Saggin O J, Lima-Filho J M, et al. Effect of arbuscular mycorrhizal fungi on the acclimatization of micropropagated banana plantlets[J]. Myconhiza, 1999, 9(2):119-123.
[16] Yan-Melo A M, Saggin O J, Maia L C .Tolerance of mycorrhized banana(Musa sp. cv. Pacovan)plantlets to saline stress[J]. Agrculture and Ecosystem Environment, 2003(95): 343-348.
[17]姚 青, 朱紅惠, 羊宋贞. 丛枝菌根真菌对香蕉试管苗植株生长和矿物质营养吸收的影响[J]. 果树学报, 2004, 21(5): 425-428.
[18] 景晓辉, 吴伦英, 区小玲,等. 一种简便分离香蕉枯萎病菌的选择性培养基[J]. 热带作物学报, 2009, 30(11): 1 671-1 673.
[19] Berch S M, Kendrick B. Vesicular-arbuscular mycorrhizae of southern Ontario ferns and fern-allies[J]. Mycologia, 1982(74): 769-776.
[20] McGonigle T P, Miller M H, Evans D G, et al. A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi[J]. New Phytol, 1990(115): 495-501.
[21] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000, 308-316.
[22]许志刚. 普通植物病理学[M]. 北京: 中国农业出版社, 2002:236-262.
[23] 李 敏, 孟祥霞, 姜吉强, 等. AM真菌与西瓜枯萎病关系初探[J]. 植物病理学报, 2000, 30(4): 327-331.
[24] Slezack S, Dumas-Gaudot E, Paynot M, et al. Is a fully established arbuscular mycorrhizal symbiosis required for bioprotection of Pisum sativum roots against Aphanomyces euteiches[J]. Molecular Plant-microbe Interactions, 2000(13): 238-241.
[25] Khaosaad T, Garcia-Garrido J M, et al. Take-all disease is systemically reduced in roots of mycorrhizal barley plants[J]. Soil Biology & Biochemistry, 2007(39): 727-734.
[26] Cordier C, Gianinazzi S, Gianinazzi-Pearson V. Colonisation patterns of root tissues by Phytophthora nicotianae var. parasitica related to reduced disease in mycorrhizal tomato[J]. Plant and Soil, 1996, 185(2): 223-232.
[27] Hu J L, Lin X G, Wang J H, et al. Arbuscular Mycorrhizal Fungal Inoculation Enhances Suppression of Cucumber Fusarium Wilt in Greenhouse Soils[J]. Pedosphere, 2010, 20(5): 586-593.

