巴西橡胶树HbCytb561的克隆及表达分析
王立丰 王纪坤 安锋 谢贵水

摘 要 细胞色素b561通过参与抗坏血酸的再生在活性氧淬灭、生长发育和抗旱等生理过程中起作用。从巴西橡胶树热研7-33-97叶片中克隆一个细胞色素b561基因,其推导氨基酸含有特征性Cyt_b561家族结构域,命名为HbCytb561。该基因在花、叶片和胶乳中表达,在树皮中不表达。干旱、机械伤害和白粉菌侵染均显著上调该基因在橡胶树叶片中表达。结果说明HbCytb561基因受逆境反应诱导,参与橡胶树抗逆响应的生理和分子机制。
关键词 巴西橡胶树;干旱;细胞色素b561;活性氧;机械伤害
中图分类号 S794.1 文献标识码 A
Abstract Cytochrome b561 takes part in reactive oxygen species scavenges, growth and development as well as drought tolerance through regeneration of ascorbic acid. In this study, a HbCytb561 was cloned and designated from the leaves of rubber tree clone CATAS7-33-97, which containing specific Cyt_b561 superfamily domain. The highest expression was observed in flowers, then in leaves and latex. No expression was found in the bark. Drought, mechanical wounding and powdery mildew infection up regulated its expression at significant level. These suggested that HbCytb561, inducted by stress environment, play roles in physiological and molecular mechanisms of stress resistance in rubber tree.
Key words Hevea brasiliensis; Drought; Cytb561; ROS; Mechanical wounding
doi 10.3969/j.issn.1000-2561.2015.11.008
細胞色素b561(Cytochrome b561)家族含有b561核心结构域,根据其特征基序的不同,将其分为7个亚家族,其中B组为植物家族[1]。细胞色素b561是含有2个血红素分子的内膜蛋白,参与抗坏血酸(维生素C)再生[2]。其作用机制是作为电子传递体携带电子跨过质膜,将电子从抗坏血酸分子转移到受体分子上。抗坏血酸单电子氧化的产物-单脱氢抗坏血酸(MDHA)在哺乳动物和植物中被鉴定为是细胞色素b561的电子受体。细胞色素b561催化MDHA还原导致还原性抗坏血酸的再生。细胞色素b561在人类[3]、动物[4]和植物中都有发现,大多数物种含有3~4个细胞色素b561同源蛋白,是疏水性蛋白,含有6个跨膜结构(TMH1~TMH6)。TMH2~TMH5这4个跨膜螺旋是最保守区域,TMH1和TMH6则保守型相对较差。在植物拟南芥、葡萄、大豆和玉米等植物中发现了Cytb561基因家族成员[5],证明其参与拟南芥抗病[6]、西瓜抗旱[7]等生理过程,其功能受到膜电势[8]、小RNA[9]和二氢硫辛酸[10]等调节。
中国橡胶树种植经常面对寒害[11]、风害和干旱[12]等逆境的威胁。目前,发现橡胶树寒害和干旱逆境响应均与活性氧代谢和淬灭有关[13]。活性氧淬灭可分为酶促和非酶促2个类型,主要与SOD、抗坏血酸、酚类等相关[14]。例如,干旱可导致巴西橡胶树病虫害发生率[15]、死皮率增加,还增加灾害预报和管理成本[16-17], 降低胶乳产量[18]。已有研究结果证明,干旱会诱导橡胶树渗透调节能力变化[19],也会导致叶片中蛋白质含量变化[20]。笔者发现干旱会诱导抗坏血酸过氧化物酶的上调表达[13],因此推测抗坏血酸再生与橡胶树抗旱性紧密相关。笔者拟从巴西橡胶树热研7-33-97叶片中克隆与抗坏血酸再生密切相关的HbCytb561基因,研究其在逆境条件下的表达规律,为阐明HbCytb561基因在橡胶逆境响应中的作用奠定基础。
1 材料与方法
1.1 材料
以位于中国热带农业科学院实验场二队15年生巴西橡胶树品种热研7-33-97开割树为材料,采集叶片、胶乳、花和树皮用于组织表达分析[21]。以中国热带农业科学院实验场五队培育的热研7-33-97芽接苗为材料,选取均匀一致的2蓬叶且顶篷叶片处于稳定期的芽接苗进行干旱、机械伤害和白粉菌侵染处理。
1.2 方法
1.2.1 植物材料RNA提取和cDNA合成 胶乳、叶片等材料总RNA提取根据Qin等[21]的方法,利用DNaseⅠ去除RNA中残留的少量DNA。所提取的RNA经紫外分光光度计测定OD230、OD260、OD280吸收值以检测纯度,同时采用1%甲醛变性胶电泳检测RNA的完整性。cDNA第Ⅰ链合成参照RevertAidTM First Strand cDNA Synthesis Kit, Fermentas试剂盒说明书[22]。
1.2.2 HbCytb561基因的克隆 根据GenBank公布的人类、拟南芥和蓖麻等细胞色素b561蛋白序列,在橡胶树EST数据库中做TBLASTN搜索,通过DNAman软件拼接同源片段,得到巴西橡胶树细胞色素b561基因的cDNA序列。采用primer 6.0软件设计基因特异引物Cytb561F1(5′-CTCACAGG
CTCACACTTAA-3′)和cytb561R1(5′-TCAGTTGAAG
TCATAGGACG-3′),以反转录的cDNA第Ⅰ链为模板,扩增巴西橡胶树细胞色素b561基因的cDNA序列。使用2×Taq PCR MasterMix(天根生化)进行PCR扩增,反应体系为:cDNA 2 μL,上下游引物(10 μmol/L)各1 μL,2×PCR MasterMix 25 μL,加ddH2O至50 μL。PCR扩增程序为:94 ℃变性3 min,94 ℃变性30 s;55 ℃退火50 s,72 ℃延伸2 min,共35个循环;最后72 ℃延伸10 min。扩增产物经1%的琼脂糖凝胶电泳后,切下目的片段,凝胶回收纯化,并克隆到pMD19-T载体上,经菌落PCR检测,送上海立菲生物技术有限公司广州测序部进行测序验证[23]。
1.2.3 HbCytb561的生物信息学分析 采用NCBI ORF Finder 在线分析工具预测基因的ORF及其编码的氨基酸序列,通过Expasy的ProtParam在线分析软件分析巴西橡胶树细胞色素b561蛋白中各种氨基酸含量,并预测得到理论分子量和等电点;用NCBI Conserved Domains数据库和SMART在线分析软件分析蛋白的结构;用SignalP 4.1 Server在线分析软件分析信号肽结构;用TMHMM 2.0 Server在线分析软件分析蛋白跨膜结构域。在NCBI蛋白数据库中通过blastp搜索其它物种的细胞色素b561同源蛋白并获取其序列,利用DNAman8.0软件进行多重序列比对[23]。
1.2.4 HbCytb561基因表达分析 干旱处理采用先将芽接苗浇水至饱和,然后放在光照培养箱进行断水处理,连续采集0~10 d叶片为材料[13];机械伤害处理采用Qin等[21]的方法;白粉菌处理采用笔者发表的方法[24]。以荧光定量引物N561F(5′-CTAC
AGTTAGGAGCGAGTC-3′)和N561R(5′-ACAGCAG
TGAAGTTGATGA-3′)扩增,以HbACTIN为内参基因,分析HbCytb561的表达量。
1.3 统计分析
采用SPSS软件(版本号21)进行统计分析,采用单因素方差分析和Duncan检验分析不同处理间基因表达的差异显著性。采用Origin2015科技绘图软件作图。
2 结果与分析
2.1 HbCytb561基因克隆与生物信息学分析
HbCytb561(基因登录号:KM086717)基因,全长977 bp,其5′端长度为228 bp,3′端长度为50 bp,编码区长度为702 bp,编码233个氨基酸(图1)。其推导氨基酸分子量为25.3 ku,等电点8.61,分子式为C1 211H1 876N282O298S5,为疏水性蛋白。推导氨基酸与蓖麻RcCytb561(Ricinus communis,XP_002510795.1)、花烟草NsTAF1L(Nicotiana sylvestris,XP_009778201.1)、烟草NtTAF1L(Nicotiana tomentosiformis,XP_009590952.1)和苜蓿MtCytb(Medicago truncatula,XP_003638360.1)相似性分别为77%、68%、67%和69%,是细胞色素b561家族成员。第80位赖氨酸和第105位组氨酸是底物识别位点(图2)。
生物信息学分析可以看出(图3),HbCytb561基因推导的氨基酸序列中1~37位氨基酸编码信号肽,49~175位氨基酸编码特异的Cyt_b561 superfamily结构域(图3-A)。亚细胞定位分析表明,其在质膜、高尔基体、内质网膜和内质网囊腔的几率分别为0.64、0.46、037和0.10,表明细胞色素b561定位在质膜上(图3-B)。根据跨膜软件分析,发现细胞色素b561蛋白在10~32、45~67、82~104、116~138、
153~175和195~217具有6个跨膜结构域(图3-C)。
2.2 HbCytb561基因的表达分析
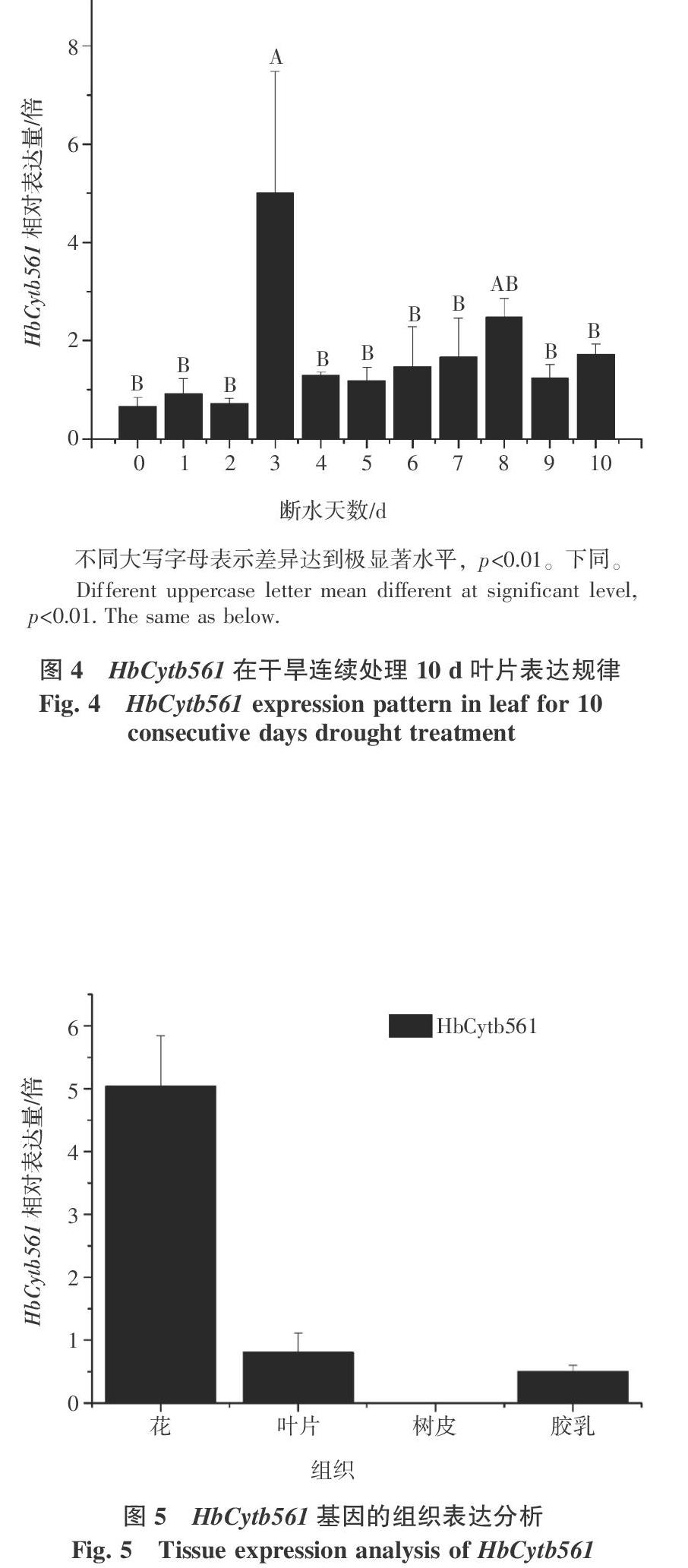
干旱处理橡胶树芽接苗10 d叶片中,HbCytb561在第3天有显著上调表达的趋势,随后随着干旱处理时间的延长,其表达量逐渐下降,在第8天又呈现上升趋势,随后下降(图4)。这说明,细胞色素b561参与橡胶树干旱响应的关键时期为第3天。
从图5的组织表达分析可以看出,HbCytb561在花中的表达量最高,在叶片和胶乳中表达量次之,在树皮中不表达。说明其主要在花、叶片和胶乳中起作用。
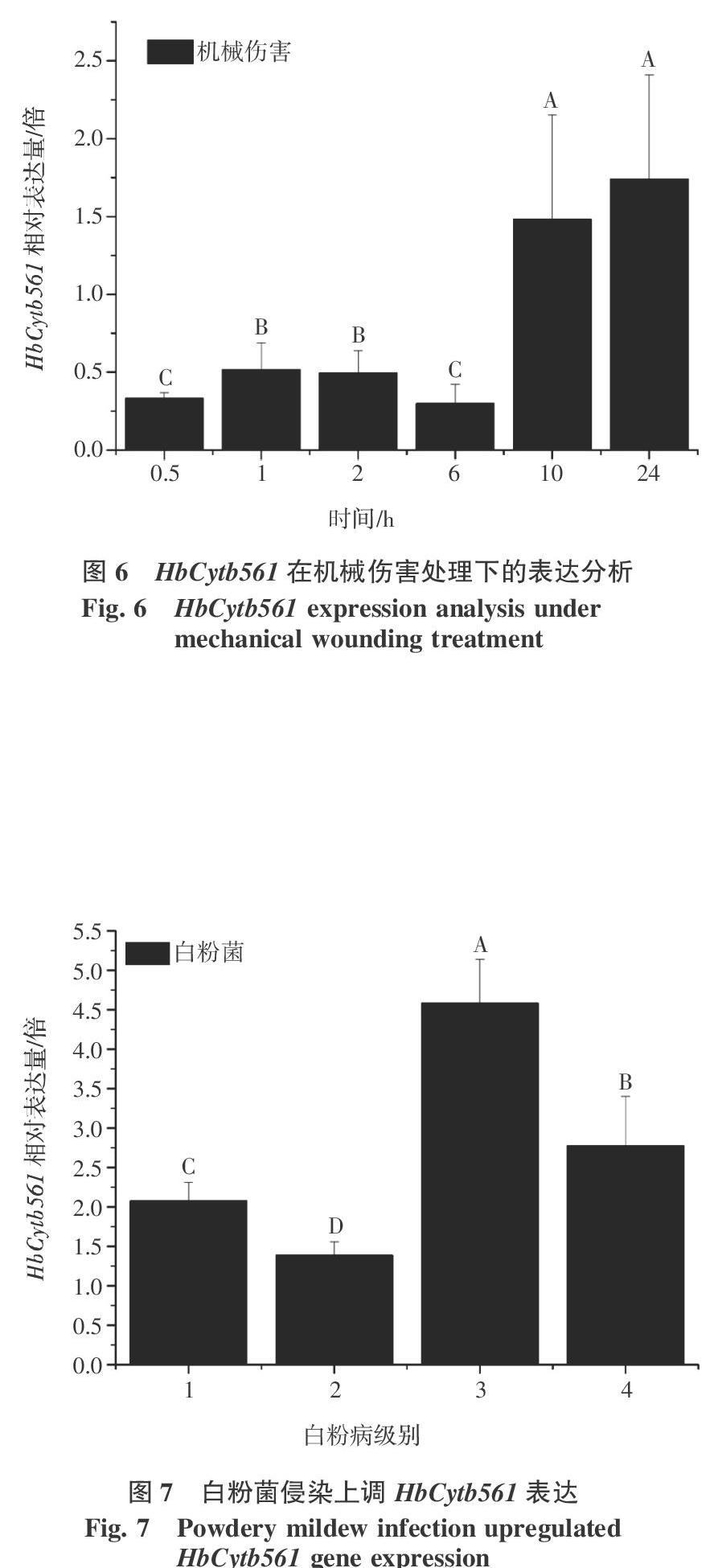
从图6可以看出,机械伤害处理叶片后,在1~2 h上调HbCytb561的表达,随后下降,其表达最高峰出现在在机械伤害处理后的10~24 h,说明HbCytb561参与橡胶树对机械伤害的早期反应。
白粉菌侵染后不同级别的叶片中HbCytb561的表达显著上调,尤其在3级和4级叶片中上调分别为4.5和3倍。说明白粉菌侵染会导致HbCytb561表达的显著增加,与干旱和机械伤害的结果一致。
3 討论与结论
3.1 HbCytb561是植物细胞色素b561家族成员
抗坏血酸在真核生物中参与多种基础的代谢反应,细胞色素b561是抗坏血酸依赖的氧化还原酶,具有高度保守的跨膜结构,在抗坏血酸循环和离子吸收起到重要作用[6]。目前,其结构与功能研究进展迅速[25]。笔者从橡胶树品种热研7-33-97叶片中克隆了HbCytb561基因,与蓖麻、烟草中的细胞色素b561基因相似度达70%以上,含有特征性Cytb561结构域,并含有6个跨膜结构域。物种间差异会引起细胞色素b561基因结构和定位的差异。例如,亚细胞定位已发现细胞色素b561基因定位在溶酶体[26]和液泡膜上[27],而笔者发现HbCytb561定位在质膜上。在拟南芥中发现赖氨酸81和组氨酸106对于底物识别和催化具有重要作用[28],在玉米中发现精氨酸72和酪氨酸71是保守位点[29]。HbCytb561由于物种差异,其底物结合位点与拟南芥相差一位。上述分析说明HbCytb561是植物细胞色素b561家族成员。
3.2 HbCytb561參与橡胶树干旱等抗逆反应
尽管植物中对细胞色素b561基因结构研究较多,但对其生理功能研究较少。已经证明,细胞色素b561具有促进抗坏血酸再生[30]、生长发育[31]和参与抗旱[7]的作用。橡胶树生长发育过程中经常遇到干旱、白粉菌侵染等胁迫,同时割胶亦会导致对橡胶树树皮的伤害。笔者发现,干旱会诱导橡胶树叶片产生活性氧,进而导致活性氧淬灭酶基因表达和活性增加。干旱处理3~5 d是橡胶树生理反应的关键时期。本文中,HbCytb561基因受干旱上调表达,其在第3天表达丰度最高,说明同其它活性氧淬灭酶一起参与了橡胶树抗旱生理反应。随后,由于干旱的加重,导致其基因表达持续下降。在西瓜中证明上调表达细胞色素b561和抗坏血酸氧化酶基因能提高野生西瓜对干旱和高光照的抗性[7]。机械伤害和白粉菌侵染会导致叶片中活性氧含量上升,进而导致HbCytb561基因上调表达。笔者证明了在橡胶树叶片中HbCytb561参与抗逆调控,是对细胞色素b561基因生物功能的深入诠释。
本研究结果说明HbCytb561含有细胞色素b561家族特征的结构域,参与橡胶树对干旱、机械伤害和白粉菌侵染的响应,将为阐明细胞色素家族成员功能和筛选橡胶树抗逆诊断指标打下坚实基础。
参考文献
[1] Tsubaki M, Takeuchi F, Nakanishi N. Cytochrome b561 protein family: expanding roles and versatile transmembrane electron transfer abilities as predicted by a new classification system and protein sequence motif analyses[J]. Biochim Biophys Acta, 2005, 1 753(2): 174-190.
[2] Lane D J, Bae D H, Merlot A M, et al. Duodenal cytochrome b(DCYTB)in iron metabolism: an update on function and regulation[J]. Nutrients, 2015, 7(4): 2 274-2 296.
[3] Zhang K, Deacon D C, Rao F, et al. Human heart rate: heritability of resting and stress values in twin pairs, and influence of genetic variation in the adrenergic pathway at a microribonucleic acid microRNA motif in the 3′-UTR of cytochrome b561[J]. J Am Coll Cardiol, 2014, 63(4): 358-368.
[4] Srivastava M, Pollard H B, Fleming P J. Mouse cytochrome b561: cDNA cloning and expression in rat brain, mouse embryos, and human glioma cell lines[J]. DNA Cell Biol, 1998, 17(9): 771-777.
[5] Opiyo S O, Moriyama E N. Mining Cytochrome b561 proteins from plant genomes[J]. Int J Bioinform Res Appl, 2010, 6(2): 209-221.
[6] Costa A, Barbaro R, Sicilia F, et al. AIR12, a b-type cytochrome of the plasma membrane of Arabidopsis thaliana is a negative regulator of resistance against Botrytis cinerea[J]. Plant Science, 2015, 233: 32-43.
[7] Nanasato Y, Akashi K, Yokota A. Co-expression of cytochrome b561 and ascorbate oxidase in leaves of wild watermelon under drought and high light conditions[J]. Plant Cell Physiol, 2005, 46(9): 1 515-1 524.
[8] Picco C, Scholz-Starke J, Naso A, et al. How are cytochrome b561 electron currents controlled by membrane voltage and substrate availability?[J]. Antioxid Redox Signal, 2014, 00(00): 1-8.
[9] Huang H, Zhang K, Zhou Y, et al. MicroRNA-155 targets cyb561d2 in zebrafish in response to fipronil exposure[J]. Environ Toxicol, 2014. DOI: 10.1002/tox.22099.
[10] Berczi A, Zimanyi L, Asard H. Dihydrolipoic acid reduces cytochrome b561 proteins[J]. Eur Biophys J, 2013, 42(2-3): 159-168.
[11] 王立豐, 吴绍华, 田维敏. 巴西橡胶树抗寒机制研究进展[J]. 热带作物学报, 2012, 37(7): 1 320-1 325.
[12] 王立丰, 王纪坤, 谢贵水. 巴西橡胶树抗旱机制研究进展[J]. 热带作物学报, 2015, 36(2): 426-431.
[13] Wang L F. Physiological and molecular responses to drought stress in rubber tree(Hevea brasiliensis Müll. Arg.)[J]. Plant Physiol Biochem, 2014, 83: 243-249.
[14] 王立丰, 陆艳茜, 邓玉杰. 光照强度对巴西橡胶树淡绿期叶片光合特性和活性氧代谢的影响[J]. 热带作物学报, 2014, 35(6): 1 131-1 136.
[15] 郭金斌. 干旱要加强防治橡胶树虫害[J]. 农药市场信息, 2012(10): 47.
[16] 温福光. 物候因子干旱灾害长期预报[J]. 灾害学, 1991, 6(1): 89-94.
[17] 李新梅. 干旱期橡胶树的管理[J]. 致富天地, 2010(05): 31.
[18] 邓光辉, 黄学全. 浅析海南垦区干旱地区采胶方法及思路[J]. 中国热带农业, 2014(04): 15-19.
[19] 宫丽丹, 田耀华, 龙云峰, 等. 持续干旱胁迫及复水对橡胶树渗透调节能力的影响[J]. 中国农学通报, 2012, 28(01): 35-38.
[20] 林秀琴, 袁 坤, 王真辉, 等. 干旱胁迫下橡胶树叶片差异表达蛋白的鉴定与功能解析[J]. 热带作物学报, 2009, 30(12): 1 782-1 788.
[21] Qin B, Zheng F, Zhang Y. Molecular cloning and characterization of a Mlo gene in rubber tree(Hevea brasiliensis)[J]. J Plant Physiol, 2015, 175: 78-85.
[22] 覃 碧, 王 萌, 薛 松, 等. 巴西橡胶树1个Mlo基因克隆及其序列特征分析[J]. 中国农学通报, 2013, 29(31): 21-26.
[23] 覃 碧, 王 萌, 林雨见, 等. 巴西橡胶树HbMlo9基因克隆及其序列特征分析[J]. 热带农业科学, 2013, 33(08): 47~52.
[24] Wang L F, Wang M, Zhang Y. Effects of powdery mildew infection on chloroplast and mitochondrial functions in rubber tree[J]. Trop Plant Pathol, 2014, 39(3): 242-250.
[25] Liu W, Da Silva G F, Wu G, et al. Functional and structural roles of residues in the third extramembrane segment of adrenal cytochrome b561[J]. Biochemistry, 2011, 50(15): 3 149-3 160.
[26] Zhang D L, Su D, Berczi A, et al. An ascorbate-reducible cytochrome b561 is localized in macrophage lysosomes[J]. Biochim Biophys Acta, 2006, 1760(12): 1 903-1 913.
[27] Griesen D, Su D, Berczi A, et al. Localization of an ascorbate-reducible cytochrome b561 in the plant tonoplast[J]. Plant Physiol, 2004, 134(2): 726-734.
[28] Lu P, Ma D, Yan C, et al. Structure and mechanism of a eukaryotic transmembrane ascorbate-dependent oxidoreductase[J]. Proc Natl Acad Sci USA, 2014, 111(5): 1 813-1 818.
[29] Rahman M M, Nakanishi N, Sakamoto Y, et al. Roles of conserved Arg(72) and Tyr(71) in the ascorbate-specific transmembrane electron transfer catalyzed by Zea mays cytochrome b561[J]. J Biosci Bioeng, 2013, 115(5): 497-506.
[30] Asard H, Kapila J, Verelst W, et al. Higher-plant plasma membrane cytochrome b561: a protein in search of a function[J]. Protoplasma, 2001, 217(1-3): 77-93.
[31] Verelst W, Kapila J, De Almeida Engler J, et al. Tissue-specific expression and developmental regulation of cytochrome b561 genes in Arabidopsis thaliana and Raphanus sativus[J]. Physiol Plant, 2004, 120(2): 312-318.

